丹红注射液对脑梗死患者外周血中血管内皮生长因子的影响
李文玉, 董斌春, 王 路, 王晓红, 杨 鑫, 宋春伶
急性脑梗死后成人脑组织再生能力有限,血管新生及侧枝循环建立是治疗关键,对脑梗死后神经元存活及预后有重要意义,但其内源性保护机制、细胞信号转导途径等过程尚未阐明。正常机体内存在多种促血管新生的因子,与抑制血管新生因子相互作用,两者保持平衡。促进血管新生因子主要包括:VEGF、bFGF、转化生长因子(TGF-α)、血小板源生长因子(PDGF)、肿瘤坏死因子(TNF-α)、胎盘生长因子(PIGF)。抑制血管新生因子目前发现的有:血管生成抑素(angiostatin)、内皮抑素(endostatin)、凝血酶敏感蛋白(TSPs)、干扰素α、干扰素β、色素上皮源性生长因子(PEDF)、白细胞介素10、12(IL-10、IL-12)等。
目前研究较多的是VEGF及bFGF在血管新生中的作用,VEGF是一种重要的促血管新生因子,脑组织正常情况下无VEGF表达,脑缺血、缺氧后,VEGF/VEGF受体(VEGFR)系统被激活,诱导VEGF高表达,并与其受体结合,刺激神经元生长,对神经系统起直接保护作用,并延长细胞存活时间[1~3],促使内皮细胞增殖,诱导血管形成[4,5],改善缺血半暗带区血流供应,为脑组织重建、功能恢复提供基础环境。bFGF是一种血管活性多肽,可能通过上调超氧化物歧化酶起到抗氧化作用,减少缺血再灌注损伤后细胞凋亡,从而减少组织坏死[6]。郭翠平等在其实验中发现VEGF、bFGF在缺血预处理大鼠局灶性脑缺血再灌注区域表达明显增高,缺血面积及缺血程度均减轻,推测两者可能对缺血再灌注鼠神经细胞起保护作用[7]。
本文中我们着重研究脑梗死后外周血中VEGF水平变化,通过在不同条件处理下VEGF的浓度间接反应其对血管新生的影响,以及应用丹红注射液后对VEGF的影响。
1 材料与方法
1.1 仪器与试剂
恒温水浴箱(HG-75-4,南京)、酶标分析仪(PHOMO,郑州安图生物工程有限公司)、离心机(3K15,德国Sigma公司)、注射用丹红注射液,菏泽步长制药有限公司生产,规格10 ml。人血管内皮生长因子定量酶联检测试剂盒(吉林恒晟生物科技有限公司生产,长春)。
1.2 病例选择
随机选取于本科住院的脑梗死患者60例,发病均在48 h内,全部病例均符合1995年第四届全国脑血管病学术会议制定的《各类脑血管疾病的诊断要点》诊断标准,并经头部CT或MRI检查证实,排除颅内出血及其他颅内疾患。另除外下列情况:(1)年龄<18岁的住院患者;(2)严重肝肾功能障碍;(3)全身出血倾向或出血性疾病;(4)过敏体质患者;(5)处于妊娠期或哺乳期的妇女。共入选60例,其中男37例,女23例。年龄43~82岁,平均57.02 ±10.21 岁。
1.3 治疗方法
将入选的60例新发脑梗死患者随机分为丹红注射液治疗组与对照组,治疗组30例(男21例,女9例,平均年龄55.67±9.87岁),对照组30例(男20例,女10例,平均年龄 57.48 ±11.33 岁),其中治疗组使用常规治疗,即改善循环,营养神经,抗血小板聚集治疗,并加用丹红注射液40 ml溶解于0.9%生理盐水100 ml中,每日1次静脉输注(输注时间为1 h);而对照组使用常规治疗。两组均以7~12 d为1个疗程,在用药前24 h和用药周期内,严禁使用ACEI类降压药物。两组患者高血压、冠心病、糖尿病、高脂血症等危险因素无明显差异,具有可比性,并均对上述疾病进行治疗。
1.4 样品的提取及保存
分别于入院后2 d与治疗12 d后采静脉血(用EDTA抗凝),经离心后将上层清夜即血浆分离出来,放入-20℃冰箱保存,样品血浆于实验前24 h内放入2~8℃冰箱保存,于实验前0.5~1 h取出在室温下搁置,以备检测血浆中VEGF的含量,进行比较。
1.5 检测 VEGF
操作步骤严格按照说明书进行(采用双抗体夹心ELISA法)。(1)实验前30 min取出试剂盒,以平衡至室温(20~25℃)。(2)取出所需板条,剩余密封放回4℃冷藏。配置洗涤液(浓缩洗涤液与蒸馏水1∶30倍稀释)。(3)建立标准曲线:设标准孔10孔,在第1孔、第2孔中分别加入标准品100 μl,然后在第1孔、第2孔中分别加入标准品稀释液50 μl,混匀,然后从第 1 孔、第 2 孔中各取 100 μl分别加到第3孔和第4孔,再在第3孔、第4孔分别加入标准品稀释液50 μl,混匀,然后从第3孔和第4孔中先各取50 μl弃掉,再各取50 μl分别加到第5孔、第6孔,然后在第5孔、第6孔中分别加入标准品稀释液50 μl,混匀,然后从第5孔、第6孔中各取50 μl分别加到第7孔、第8孔,再在第7孔、第8孔中分别加入标准品稀释液50 μl,混匀,然后从第7孔、第8孔中各取50 μl分别加到第9孔、第10孔,再在第9孔、第10孔中分别加入标准品稀释液50 μl,混匀,然后从第 9 孔和第 10 孔中各取 50 μl弃掉。使之各孔体积均为50 μl。(浓度分别为900 pg/L、600 pg/L、300 pg/L、150 pg/L、75 pg/L)。(4)加样:分别设空白对照孔(空白对照孔不加样品和酶标抗体工作液,其余各步操作相同)和待测样品孔。在待测样品孔中先加入样品稀释液40 μl,然后再加样品10 μl,(样品最终稀释了5倍)。将样品加于酶标板孔底部,尽量不触及孔壁,轻轻摇动混匀。(5)用封板纸封板后置37℃ 30 min。(6)洗板:小心揭掉封板纸,弃去液体,甩干,每孔加满洗涤液,静置30 s后弃去,如此重复5次,向滤纸印干。(7)每孔加入酶标抗体工作液50 μl,轻轻摇动混匀。(8)用封板纸封板后置37℃ 30 min。(9)洗板:小心揭掉封板纸,弃去液体,甩干,每孔加满洗涤液,静置30 s后弃去,如此重复5次,向滤纸印干。(10)每孔先加入底物液 A 50 μl,再加入底物液 B 50 μl。(11)将反应板充分混匀后置37℃暗处反应15 min。(12)每孔加入终止液50 μl,混匀,终止反应。此时蓝色立转黄色。(13)以空白孔调零,在45 nm处测吸光值。测定应在加终止液后15 min内进行。
1.6 测定结果计算与判断
(1)以标准品浓度分别为900 pg/L、600 pg/L、300 pg/L、150 pg/L、75 pg/L之 OD值得出标准曲线。将浓度作为X轴(对数轴),OD值作为Y轴(线性轴)。(2)根据样品OD值代入标准曲线算出相应人VEGF含量,再乘以稀释倍数5。
1.7 统计学处理
2 结果
经统计软件分析后得出:治疗前两组VEGF水平相比,差别无统计学意义(P>0.05),治疗后两组VEGF水平相比,差别有统计学意义(P<0.05)(见表1、图 1)。
表1 两组治疗前后VEGF水平变化(pg/mg,)
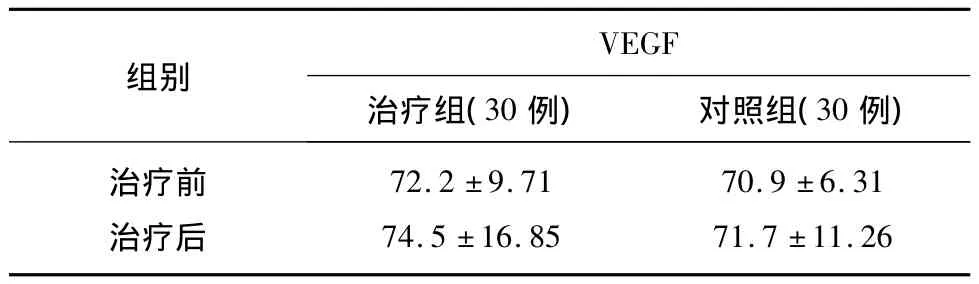
表1 两组治疗前后VEGF水平变化(pg/mg,)
组别VEGF治疗组(30例) 对照组(30例)治疗前治疗后72.2 ±9.71 74.5 ±16.85 70.9 ±6.31 71.7 ±11.26

图1 两组治疗前后VEGF水平变化
3 讨论
3.1 脑梗死与VEGF
3.1.1 VEGF对血管生成的影响 VEGF是影响血管生成一个关键的因素,脑梗死后VEGF介导血管生成的治疗潜力逐渐得到重视,一些研究显示VEGF是血管生成过程、神经保护和脑缺血后神经再生最重要的生长因子。脑梗死后VEGF表达上调,低氧依赖性HIF-1、HIF-2也参与VEGF表达,低氧是增加VEGF表达的一个关键[8]。缺血性梗死后,VEGF和VEGFRs在梗死部位、缺血半暗带区以及较远处皮质区域都有明显表达,其中主要是通过脉络丛上皮细胞和小脑,也通过海马神经元和齿状回(DG)和星形胶质细胞和小胶质细胞。VEGF的两个受体VEGFR-1和VEGFR-2在缺血48 h后先后在缺血灶周围及缺血区表达。此外,在缺血再灌注后大约3 d VEGF-C和VEGFR-3在CA1和齿状回开始表达,并至少持续14 d,这种改变与缺血性损伤后星形胶质细胞聚集时间点有关。脑梗死后缺血周围血管会再生,事实上已经证实脑梗死后VEGF明显加速了血管生成,促进神经功能恢复[9,10]。此外,Harrigan等[11]发现在心室内缓慢注入VEGF165与血管密度增加呈剂量依赖关系,VEGF有增强血管生成的作用是由VEGF通过下游VEGFR-2介导而生成。Sun等[5]证实在缺血再灌注的1~3 d脑室通过VEGF调节可以减小梗死面积,提高神经系统功能,增加并延长齿状回(DG)和脑室下区(SVZ)神经元新生。然而,VEGF在脑缺血中的急性效应极其复杂的,这种神经保护作用机制尚未完全阐明。有研究证实VEGF神经保护作用是通过刺激血管内皮细胞及神经元细胞实现的,VEGFR-2与VEGF提高内皮细胞和神经元生存的能力密切相关;VEGFR-1则与VEGF减小脑梗死面积,减轻脑水肿有关[12];下游的受体水平、信号PI3-K/Akt和ERK1/2等因素均有助于提高VEGF神经保护作用。有实验发现缺氧和葡萄糖不足时,VEGF通过VEGFR-2和PI3-K途径减少细胞死亡。
3.1.2 VEGF对神经发生的影响 VEGF作为内源性神经保护因子除具有促进血管生成的作用,还可抑制细胞凋亡、刺激神经再生,并对胶质细胞的增殖、分化有直接促进作用,这种作用可能与少突胶质前体细胞(oligoderndrocyte precursor cells,OPC)有关。OPC在不同环境下可以分化为星形胶质细胞(Ast)、少突胶质细胞(OL)、甚至可以分化为神经元[13]。星形胶质细胞在微环境中发挥着重要作用,而少突胶质细胞则是神经系统髓鞘形成细胞,在信息传递及整合方面起着重要作用。此外,OPC能够分泌神经营养因子和神经生长因,如神经生长因子、胰岛素样生长因子等,促进神经系统发育。脑缺血缺氧后,VEGF在脑缺血区促进血管生长、促进细胞存活的同时还通过FLK-1促进神经前体细胞增殖,并通过Nocth信号通路对OPC起到促进增殖作用,为其迁移到受损部位以完成修复功能提供前提条件。VEGF能直接刺激体内外的神经发生[14~16],VEGF则能上调这些区域的神经发生[2,5]。事实上,在携带VEGF基因的鼠实验中,脑梗死1~4 w室管膜下区神经再生明显增加,成神经细胞链从室管膜下区一直扩展到缺血半暗带层,脑梗死2~4 w后大脑皮质新生成的神经元显著增加。也有研究发现重组腺病毒VEGF-1相关病毒可能通过提高SVZ区的神经发生和促进神经前体迁移到缺血病变周围组织,进而减少梗死病灶的大小并促进神经功能恢复。VEGF在体外诱导神经元增殖研究中需要PLC、PKC、PI3-K、MEK 参与,并进一步通过上调E2F的表达促进皮质神经元的增殖[17]。VEGF可能通过提高脑缺血后神经发生,对脑损伤的修复起到治疗作用。
3.2 丹红注射液与VEGF
本实验中治疗后VEGF均有升高,丹红治疗者较对照组升高明显,其差别具有统计学意义(P<0.05),说明丹红注射液可以增加缺血性脑卒中患者血液中VEGF的表达,VEGF含量的增加对促进脑缺血区血管的新生及神经细胞再生发挥了一定的积极作用。丹红注射剂由丹参、红花提炼而成,主要成分有丹参酮、丹参酚,红花黄醇酮、红花黄色素等,前两者有降低血栓烷素A2水平、抗血小板聚集、降低血浆中D-二聚体及纤维蛋白原从而降低血液黏度[18]及红细胞聚集指数,改善微循环,抑制动脉粥样硬化形成、清除自由基作用;后两者则有抗凝溶栓、改善ATP酶活性、刺激组织纤溶酶活性物质释放,调节纤维蛋白溶解活性进而起到防止血栓形成及促进血栓溶解作用[19]。目前丹红注射液已广泛应用与临床,治疗心脑血管等疾病,临床疗效观察发现急性脑梗死患者在早期应用该药后,患者神经功能恢复及预后均有提高。席晓华等研究中证实丹红注射液有促进血管新生、侧枝循环扩张、抗血小板聚集、降低血栓烷素B2水平、抗血栓形成、抗氧化和清除自由基、提高细胞耐缺氧能力等作用,谭来勋等在动物实验中发现其可促进大鼠脑梗死区星形胶质细胞增殖、突触数目增加,从而达到促进运动功能恢复的作用。我们的试验结论也证实使用丹红注射液后患者血中VEGF水平明显提高,间接证实丹红注射液可能在缺血性脑卒中患者血管再生及神经功能恢复中发挥了积极作用。
[1]Yao X,Miao W,Li M,et al.Protective effect of albumin on vegf and brain edema in acute ischemia in rats[J].Neurosci Lett,2010,472(3):179-183.
[2]Wang YQ,Cui HR,Yang SZ,et al.VEGF enhance cortical newborn neurons and their neurite development in adult rat brain after cerebral ischemia[J].Neurochem Int,2009,55(7):629 -636.
[3]Li B,Piao CS,Liu XY,et al.Brain self-protection:The role of endogenous neural progenitor cells in adult brain after cerebral cortical ischemia[J].Brain Res,2010,1327:91 -102.
[4]Shin YJ,Choi JS,Lee JY,et al.Differential regulation of vascular cendothelial growth factor-c and tis receptor in the rat hippocampus following transient forebrain ischemia[J].Acta Neuropathol,2008,116(5):517-527.
[5]Sun Y,Jin K,Xie L,et al.VEGF-induced neuroprotection,neurogenesis,and angiogenesis after focal cerebral ischemia[J].J Clin Invest,2003,111(12):1843 -1851.
[6]闻公灵,娄季宇,白宏英,等.bFGF对大鼠局灶性缺血再灌注脑组织的保护作用[J].实用神经疾病杂志,2005,6(8):1-2.
[7]郭翠平,王小月,马如静,等.血管内皮生长因子和碱性成纤维细胞生长因子在缺血预处理大鼠局灶性脑缺血再灌注区域的表达[J].中国组织工程研究与临床康复,2010,14(37):6895-6898.
[8]Marti HJ,Bernaudin M,Bellail A,et al.Hypoxia-induced vascular endothelial growth factor expression precedes neovascularization after cerebral ischemia[J].Am J Pathol,2000,156(3):965 -76.
[9]Manoonkitiwongsa PS,Schultz RL,McCreery DB,et al.Neuroprotection of ischemic brain by vascular endothelial growth factor is critically dependent on proper dosage and may be compromised by angiogenesis[J].J Cereb Blood Flow Metab,2004,24(6):693 - 702.
[10]Udo H,Yoshida Y,Kino T,et al.Enhanced adult neurogenesis and angiogenesis and altered affective behaviors in mice overexpressing vascular endothelial growth factor 120[J].J Neurosci,2008,28(53):14522-14536.
[11]Harrigan MR,Ennis SR,Masada T,et al.Intraventricular infusion of vascular endothelial growth factor promotes cerebral angiogenesis with minimal brain edema[J].Neurosurgery,2002,50(3):589 -598.
[12]Kumai Y,Ooboshi H,Ibayashi S,et al.Postischemic gene transfer of soluble Flt-1 protects against brain ischemia with marked attenuation of blood-brain barrier permeability[J].J Cereb Blood Flow Metab,2007,27(6):1152 -1160.
[13]Belachew S,Chittajallu R,Aguirre AA,et al.Postnatal NG2 proteoglycan-expressing progenitor cells are intrinsically multipotent and generate functional neurons[J].J Cell Biol,2003,161(1):169 -186.
[14]Jin K,Zhu Y,Sun Y,et al.Vascular endothelial growth factor(VEGF)stimulates neurogenesis in vitro and in vivo[J].Proc Natl Acad Sci USA,2002,99(18):11946 -11950.
[15]Wang Y,Jin K,Mao XO,et al.VEGF-overexpressing transgenic mice show enhanced postischemic neurogenesis and neuromigration[J].J Neurosci Res,2007,85(4):740 -747.
[16]Wang YQ,Guo X,Qiu MH.VEGF overexpression enhances striatal neurogenesis in brain of adult rat after a transient middle cerebral artery occlusion[J].J Neurosci Res,2007,85(1):73 -82.
[17]Zhu Y,Jin K,Mao XO,et al.Vascular endothelial growth factor promotes proliferation of cortical neuron precursors by regulating E2F expression[J].FASEB J,2003,17(2):186 -193.
[18]马飞月,宋永健,何文绮,等.丹红注射液治疗复发脑梗死168例临床效果观察[J].蚌埠医学院学报,2011,36(8):825-827.
[19]李 琴.丹红注射液对老年高血压血流变学影响[J].实用心脑肺血管病杂志,2010,18(3):365 -366.

