以TIA为临床表现的急性脑梗死溶栓观察
陈淑媛, 王新平, 王世民, 陈荣杰, 张东菊, 王江川
传统短暂性脑缺血发作(transient ischemic attack,TIA)定义考虑为脑血管的可逆性的功能缺损,症状于24 h之内完全消失,不留任何残损症状。其主要考虑发作持续时间及临床症状,但由此很多患者即失去溶栓治疗时间窗,随2009年美国心脏协会(American Heart Association,AHA)/美国卒中协会(American Storke Association,ASA)发布 TIA新定义,越来越重视组织损伤,使部分既往考虑为TIA的患者被重新界定为急性脑梗死,成为具有溶栓适应证的人群。在此探讨此类患者采用组织型纤溶酶原激活剂(rt-PA)静脉溶栓治疗的预后,以指导进一步临床治疗。
1 资料和方法
1.1 研究对象
试验组,也称溶栓组,收集2010~2013年在天津市环湖医院神经内科住院的以TIA为临床表现的急性脑梗死患者34例。男性25例,女性9例,年龄42~74岁,平均54±3.6岁,患者符合以下条件:(1)患者年龄18~80岁;(2)为颈内动脉系统病变,且为单侧病变;(3)患者多次TIA发作,均已完全缓解,就诊时正处于发作期,发作时间介于1~4.5 h;(4)发作期间有明确的肢体瘫痪,美国国立卫生院神经功能缺损评分(NIHSS)≥4分;(5)急查头部MR示弥散加权相(diffusion-weighted imaging,DWI)阳性,而T1加权像(T1WI),T2加权像(T2WI)未见本次症状责任病灶,且病灶不超过1/3大脑半球;(6)无溶栓禁忌证:包括颅内动脉瘤或动静脉畸形;既往发生过出血性脑卒中;1 y内发生过缺血性脑卒中或脑血管事件;近期(2~4 w)有活动性内脏出血;入院时高血压[收缩压>180和(或)舒张压>110 mmHg];目前正在使用治疗剂量的抗凝药或已知有出血倾向;血小板数<10万;近期(2~4 w)创伤史,包括头部外伤、创伤性心肺复苏或较长时间(>10 min)的心肺复苏;近期(<3 w)外科大手术;近期(<2 w)曾有在不能压迫部位的大血管性穿刺术;活动性肺结核;月经期、妊娠期、产后10 d以内;严重肝肾功能障碍;溶栓药物过敏;急性亚急性细菌性心内膜炎等。
对照组,也称未溶栓组,收集2010年前于我院住院未行溶栓治疗的以TIA为临床表现的急性脑梗死患者32例。男性24例,女性8例,年龄37~76岁,平均57±4.6岁,该组患者亦满足以上(1)~(5)要求。
排除标准:(1)脑实质或蛛网膜下腔出血、颅内肿瘤或颅内感染;(2)局灶性癫痫后出现的Todd麻痹、偏瘫型偏头痛、颈椎病;(3)安装心脏起搏器、血管内支架、金属义齿等不能完成头部MRI检查的患者;(4)急查头部MRI未见DWI异常信号,仍考虑为TIA者。两组患者性别比例,年龄,血常规,肝肾功能,血糖,血脂,凝血功能等化验无统计学差异,有可比性。
1.2 研究方法
所有患者均于入院前后急查头部MR,血常规,肝肾功能,血糖,血脂,凝血功能等检查化验,并依患者最重时体征行HIHSS评分。对照组予氯吡格雷(波立维)75 mg,QD口服,及常规改善脑供血,促进脑代谢液体治疗。试验组采用rt-PA静脉溶栓,依据美国国立神经疾病与脑卒中研究院(NINDS)研究用量与方法:总量为0.9 mg/kg体重,其中10%剂量于1 min内静脉推注,90%剂量静脉点滴>60 min。24 h内严格监控血糖、凝血功能、生命体征。24 h后复查头部CT,如无出血,加用对照组治疗方案。入院7 d时复查头部MR,比较两组梗死率,临床症状继续发作情况,及梗死体积。于入院24 h、7 d、14 d时再行NIHSS评分,与入院时比较。
1.3 观察项目与检测方法
1.3.1 观察项目 至入院7 d,与入院时头部MR比较,DWI与T2WI均阴性者,考虑未进展为脑梗死,同时TIA症状停止发作连续超过72 h者,称完全缓解;在与DWI阳性部位相对应处出现长T2WI信号考虑为不可逆性脑梗死;72 h内仍有发作者,考虑为继续发作,影像检查可以阴性,也可以阳性;溶栓前及溶栓后24 h、7 d、14 d行NIHSS评分。
1.3.2 头部MR的检查方法 采用SIEMENS NOVUS 1.5T核磁共振扫描仪,标准头线圈,行常规轴位及矢状位 T1WI,T2WI,FLAIR,及 DWI扫描,扫描范围覆盖从颅底至颅顶的全部脑组织,层厚5 mm,间隔1.5 mm,结果经影像科医师证实。
1.3.3 脑梗死的评定标准 根据1995年全国第四届脑血管病学术会议制定的脑梗死诊断标准。
1.3.4 脑梗死体积的计算方法 使用MRIcro软件(1.40版),半自动测量脑梗死灶体积。脑梗死患者采用T2WI图像进行梗死灶体积测量。本研究脑梗死灶体积测量均由同1名有经验的影像科医生进行。因研究对象间的脑容积存在个体差异。因此需要对全部研究对象的脑梗死灶体积数值进行标准化处理。颅脑组织正中矢状面面积与颅内脑体积高度相关(相关系数 =0.98)[1],本研究采用 Ferguson等测量正中矢状面面积进行标准化处理[2,3]。标准化脑梗死体积=脑梗死灶体积×平均颅脑组织正中矢状面面积/患者颅脑组织正中矢状面面积。
1.4 统计学方法
应用SPSS 13.0统计软件进行统计学分析。计量资料采用表示,计量资料组间比较采用t检验,计数资料比较采用 χ2检验,P<0.05认为差异有统计学意义。
2 结果
2.1 MR 所见
发病7 d时,试验组脑梗死20例(58.82%),DWI转为阴性者13例(38.24%),完全缓解11例(32.35%),继续发作4例,其中2例头部MR阳性,2例阴性,1例出现脑出血;对照组脑梗死27例(84.38%),DWI转为阴性者 5 例(15.63%),完全缓解3例(9.38%),继续发作5例,其中3例头部MR阳性,2例阴性,两组比较试验组预后明显好于对照组(P<0.05),有统计学意义(见表1)。
2.2 TIA发作情况
入院7 d时部分患者仍有反复临床发作,以≤3次/d,为偶发,以≥4次/d,为频发。试验组有4例仍有临床发作,其中2例头部MR阳性,2例阴性,均为偶发,平均发作1.92±0.52次/d,发作时间均<30 min,平均 18.64 ±2.25 min,而对照组有 5 例仍有临床发作,其中3例头部MR阳性,2例阴性,3例为偶发,2例为频发,平均发作4.76±1.58次/d,且发作时间介于22~86 min,平均32.47±4.36 min。两组比较,P<0.05,有统计学意义(见表2),提示溶栓治疗能降低临床发作频率,缩短发作时间。
2.3 NIHSS 评分比较
比较两组患者入院时及入院24 h、7 d、14 d时NIHSS评分。试验组入院NIHSS评分13.35±1.63分,24 h时 7.64 ±1.42 分,7 d时 3.12 ±1.04 分,14 d时2.83 ±1.12 分,对照组入院 13.16 ±2.07分,24 h时14.76±2.85 分,7 d 时8.58 ±2.46 分,14 d时 5.36±1.89分,试验组明显好转(P<0.05),有统计学意义,提示溶栓治疗能降低梗死患者致残率(见表3)。
2.4 脑梗死体积
入院7 d时复查头部MR,明确脑梗死患者,测量脑梗死体积进行比较,试验组 5.46 ±1.63 ml,而对照组9.38 ±2.16 ml,P <0.05,有统计学意义(见表4)。
2.5 出血率
试验组有脑出血1例,牙龈出血1例,呕吐物潜血(+)1例,总出血率8.82%,对照组多发皮下瘀斑1例,出血率3.13%,所有出血均为非致死性出血。

表1 两组患者MR变化比较

表2 两组患者继续发作情况比较
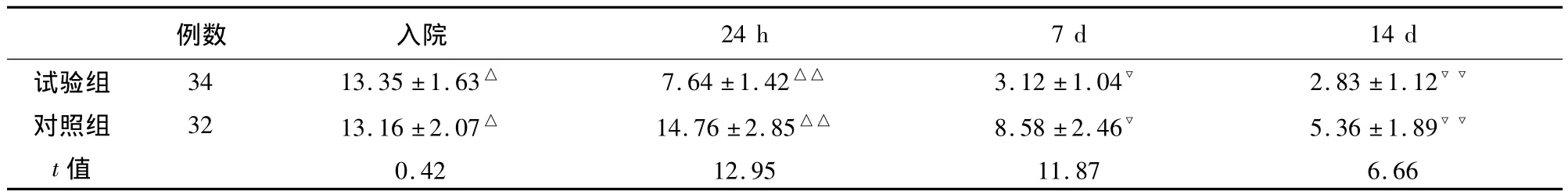
表3 两组患者NIHSS评分比较
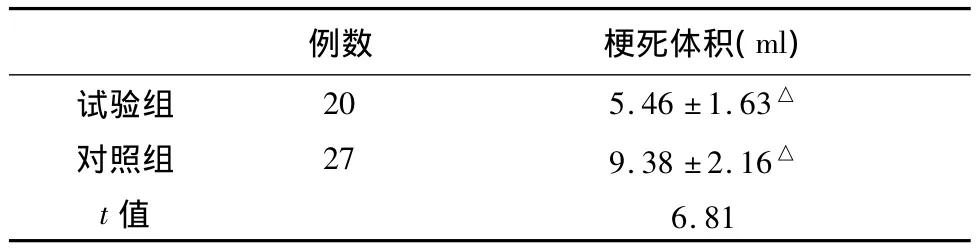
表4 两组患者脑梗死体积比较
3 讨论
1965年美国第四届脑血管病普林斯顿会议将TIA定义为:突然出现的局灶性或全脑神经功能障碍,持续时间不超过24 h,且排除非血管源性原因[4]。这一定义强调临床症状及持续时间,一直沿用至21世纪初。但随着对TIA研究的深入,这一定义越来越受到人们的质疑。至2009年,美国心脏病协会(AHA)/美国脑卒中协会(ASA)发布TIA新定义:脑、脊髓或视网膜局灶性缺血所致的、未伴发急性脑梗死的短暂性神经功能障碍[5]。由此,TIA症状持续时间在其定义中彻底淡化,而有无组织学损害是诊断TIA的唯一依据。从疾病本质上来说,TIA和脑梗死是缺血性脑损伤这一动态过程的不同阶段。脑缺血病变有3种不同的组织类型变化与MR表现相对应,按严重程度依次为突触传递失败、细胞性水肿及永久性组织损伤。突触传递失败影像学上仅表现为MR灌注加权相(Perfusion-weighted imaging,PWI)的异常,局部脑血流的减少,但 DWI和T2WI都不能发现病灶。细胞性水肿表现为PWI和DWI异常,但 T2WI正常。永久性损伤时患者的PWI、DWI、T2WI 均表现为异常[6]。故 MRI 平扫(T1WI,T2WI)、DWI及 PWI可区分病灶新旧、是已发生脑组织损害还是只有灌注障碍而有挽救可能[7]。DWI反映体内水分子的弥散运动,DWI异常高信号提示弥散异常可能系细胞内外水分比例变化引起,脑缺血时组织细胞膜离子泵功能障碍,细胞外水向细胞内移,导致细胞毒性水肿,故TIA患者出现DWI阳性,即提示超早期脑损伤。有文献报道[8],21%~44%TIA患者出现DWI阳性。TIA症状持续超过1 h,且DWI阳性的患者,约40%未来可发生永久性脑梗死。Kidwell等[9]研究发现,部分患者早期DWI异常,而后期无缺血性卒中证据,提示DWI异常是可逆的。故处于DWI阳性,而MR常规检查阴性的患者,尚有积极挽救的必要,是超早期溶栓的适宜人群。
急性脑梗死(Acute cerebral infarction,ACI)的发病率呈逐年上升趋势,急性脑梗死的溶栓治疗也越来越受到国内、外神经病学界的广泛关注。超早期溶栓治疗可以最大限度地重建缺血区循环、抢救处于可逆性损伤状态的神经细胞、缩小梗死面积、降低致残率、改善患者预后。rt-PA是目前获得循证医学支持并被美国食品药品管理局(FDA)批准的用于急性脑梗死溶栓治疗的药物。20世纪90年代中晚期,由NINDS组织进行rt-PA溶栓治疗脑卒中试验,结果提示急性缺血性脑卒中患者起病3 h内用rt-PA治疗,在3 m时至少30%的患者没有残疾或仅有轻微的残疾,而病死率没有变化,可以显著改善患者预后[10]。2002年欧洲联合卫生当局批准rt-PA急性卒中溶栓安全应用的监测研究,并对所有病例进行登记(SITS)[11],该研究比较了患者发病后 3 ~4.5 h 与3 h内接受rt-PA溶栓治疗的疗效及安全性,结果发现,两组预后无统计学差异,提示rt-PA在急性脑梗死发病后3~4.5 h使用仍然是安全和有效的。2008年欧州协作性急性卒中研究(ECASSⅢ)[12]也证明,急性脑梗死患者发病后3~4.5 h静脉使用rt-PA溶栓能使患者显著受益,增加30%预后良好的机会。因此,2009年欧洲卒中组织(ESO)将rt-PA溶栓时间窗延长至4.5 h。
我们选择以TIA为临床症状的急性脑梗死患者行静脉溶栓治疗。发病7 d时,试验组患者出现脑梗死20 例(58.82%),13 例(38.24%)DWI转为阴性,未进展为脑梗死,而对照组进展为脑梗死者27例(84.38%),5 例(15.63%)DWI转为阴性,未进展为脑梗死,本实验提示溶栓后发生梗死的比率明显下降。两组均仍有临床反复发作的病例,溶栓组4例(11.76%),发作次数均≤3 次/d,平均发作 1.92 ±0.52 次/d,发作时间均短于 30 min,平均 18.64 ±2.25 min,其中2例头部MR阳性,2例阴性。而对照组5例(15.63%)继续发作,3例发作次数≤3次/d,2例发作次数≥4次/d,平均发作 4.76±1.58次/d,发作时间介于 22 ~6 min,平均 32.47 ±4.36 min,其中3例头部MR阳性,2例阴性。显示溶栓治疗能较大程度降低临床发作频率,缩短发作时间。对两组患者治疗前后进行NIHSS评分比较,试验组NIHSS评分由13.35±1.63分下降至2.83±1.12分,而对照组由 13.16 ±2.07 分下降至5.36 ±1.89分,溶栓组NIHSS评分下降明显,提示溶栓治疗使患者致残率明显降低。而两组梗死体积比较,试验组 5.46 ±1.63 ml,对照组 9.38 ±2.16 ml,溶栓组明显小于对照组。故静脉溶栓治疗可减少以TIA为临床症状的急性脑梗死患者的梗死率,降低临床发作频率,缩短发作时间,缩小梗死体积,降低致残率,改善预后。而两组出血率比较,试验组8.82%高于对照组3.13%,但均为非致死性。故应高度关注以TIA为临床表现的急性脑梗死患者的治疗,抓住此类患者的溶栓时间窗,积极溶栓治疗。
[1]Gurol ME,Irizarry MC,Smith EE,et al.Plasma beta-amy-loid and white matter lesions in AD,MCI,and cerebral amy-loid angiopathy E[J].Neurology,2006,66:23 -29.
[2]Ferguson KJ,Wardlaw JM,Edmond CL,et al.Intracranial area:a validated method for estimating intraeranial volume[J].J Neuroimaging,2005,15:76 -78.
[3]Nandigam RN,Chen YW,Gurol ME,et al.Validation of in-tracranial area as a surrogate measure of intracranial volume when using clinical MRI[J].J NeFuroimaging,2007,17:74 -77.
[4]Siendert RG,Whisnant JP.Cerbrovascular diseases:forth conference[M].New York:Grune Stratton,1965.
[5]Easton JD,Saver JL,Albers GW,et al.Definition and evaluation of transient isehemic attack:a scientific statement for healthcare professionals from the American Heart Association/American Stroke Association Stroke Council;Council on cardiovascular Surgery and Anesthesia;Council on Cardiovascular Radiology and Intervention;Council on Cardiovascular Nursing;and the Interdisciplinary Council on Peripheral Vascular Disease.The American Academy of Neurology affirms the value of this statement as an educational tool for neurologists[J].Stroke,2009,40:2276 -2293.
[6]Kidwell CS,Alger JR,Di Salle F,et al.Diffusion MRI in patients with transient isehemic attack[J].Stroke,1999,30:1174 - 1180.
[7]Saver JL,Kidwell C.Neuroimaging in TIAs[J].Neurdogy,2004,62(Suppl 6):22-25.
[8]Purroy F,Montaner J,Molina CA,et al.Patterns and predictors of early risk of recurrence after transient isehemic attack with respect to etiologic subtypes[J].Stroke,2007,38:3225 -3229.
[9]Kidwell CS,Wintermark M.The role of CT and MRI in the emergency evaluation of persons with suspected stroke[J].Curr Neurol Neurosci Rep,2010,10:21 -28.
[10]Robinson T,Zaheer Z,Mistri AK.Thrombolysis in acute ischaemic stroke:an update[J].Ther Adv Chronic Dis,2011,2:119 -131.
[11]Wahlgren N,Ahmed N,Dávalos A,et al.Thrombolysis with alteplase 3 ~4.5 h after acute ischaemic stroke(SITSISTR):an observational study[J].Lancet,2008,372(9646):1303 -1309.
[12]Hacke W,Kaste M,Bluhmki E,et al.Thrombolysis with Alteplase 3 to 4.5 hours after acute ischemic stroke[J].New Engl J Med,2008,359(13):1317-1329.

