基于体素的形态测量学方法分析视神经脊髓炎患者的灰质体积变化
陈 聪,侯 波,有 慧,吕悦雷,徐 雁,冯 逢
中国医学科学院 北京协和医学院 北京协和医院 1放射科 2神经科,北京100730
视神经脊髓炎 (neuromyelitis optica,NMO)也称Devic病或Devic综合征,是一种以侵犯视神经和脊髓为主的特发性炎性脱髓鞘疾病,部分NMO患者脑部存在病灶,但是在常规磁共振成像 (magnetic resonance imaging,MRI)上的表现不显著,且缺乏特异性。有研究显示即使NMO患者的常规颅脑MRI未显示明显病灶,也存在隐匿性脑损伤[1]。应用弥散张量成像的研究显示NMO患者部分表现正常的脑白质区域存在扩散异常[2-4]。基于体素的形态测量学 (voxel-based morphometry,VBM)是一种全面、客观的脑结构影像学分析技术,能定量分析脑结构的微小变化,发现隐匿性脑结构损伤。有研究显示NMO患者有脑灰质萎缩的现象[5-7]。目前,学者对NMO患者脑结构改变尚未形成统一结论。本研究采用3T MRI系统采集数据,应用VBM分析NMO患者脑灰质结构变化,探讨NMO患者的脑损伤模式。
对象和方法
对象 选取2013年8月至2014年1月就诊于北京协和医院神经内科的NMO患者16例。其中男性4例、女性12例;年龄17~44岁,平均 (31.8±8.5)岁。病程12~300个月,中位病程41.5个月;复发次数1~23次,中位复发次数3次。扩展残疾状态量表(expanded disability status scale,EDSS)评分1~5.5分,中位评分2.75分。14例患者的血清NMO-IgG呈阳性,2例呈阴性。所有患者均符合2006年Wingerchuk等[8]制订的NMO诊断标准:(1)必要条件:视神经炎和急性脊髓炎;(2)支持条件 (至少满足下述条件中的两项):脑部MRI表现不符合多发性硬化的诊断标准;脊髓MRI显示长T2信号病灶连续达到3个或3个以上椎体节段;血清NMO-IgG阳性。排除标准:(1)脑内有明确梗死、肿瘤等病变;(2)有高血压、高血脂、糖尿病等心、脑血管病危险因素;(3)患者拒绝参加本项研究。选取性别、年龄与NMO患者相匹配的健康志愿者16名作为对照组。其中男性4名、女性12名;年龄18~44岁,平均 (31.1±7.8)岁。排除标准同病例组。病例组及对照组所有个体均为右利手,均否认神经及精神系统病史。检查前详细告知所有受试者研究目的及方法,患者签署知情同意书。
数据采集 磁共振成像应用GE Discovery MR750 3.0T磁共振成像系统和头部8通道相控阵线圈采集完成。成像序列包括:(1)横轴位快速自旋回波T2加权序列,定位线平行于前联合-后联合线,成像参数为:回波时间 (echo time,TE)100 ms,重复时间 (repetition time,TR)7 825 ms,激励次数 (number of excitations,NEX)4,视野 (field of view,FOV)24 cm ×24 cm,成像矩阵480×480,层厚4.0 mm,层间距0 mm,连续36层图像覆盖全脑。(2)横轴位液体衰减翻转恢复序列,定位线平行于前联合-后联合线,成像参数为:TE 120 ms,TR 12 000 ms,反转时间2 200 ms,NEX 2.00,FOV 24 cm×18 cm,成像矩阵352×224,层厚4.0 mm,层间距0 mm,连续36层图像覆盖全脑。(3)全脑等体素矢状位T1加权结构像采用三维快速扰相梯度回波序列,成像参数为:TE 2.9 ms,TR 7.7 ms,反转时间400 ms,NEX 2.00,FOV 25.6 cm×25.6 cm,成像矩阵256×256,层厚1.0 mm,层间距0 mm,共180层。所有图像均经目测评价以确保成像质量。
图像后处理及数据分析 将所有病例组及对照组三维快速扰相梯度回波原始数据传输至PC机,数据分析采用最新版统计参数图 (statistical parametric mapping,SPM)8软件,运行环境为MatlabR2012b。使用VBM8 Toolbox(http://dbm.neuro.uni-jena.de/vbm/download/)工具箱进行数据预处理,处理过程依据VBM8 Toolbox官方的操作指南及教程。具体步骤如下:(1)采用MRIcron软件 (http://www.nitrc.org/projects/mricron)将所有受试者的原始图像转换为SPM8可处理的格式。(2)将上一步生成的图像分割为灰质、白质和脑脊液,在分割过程中自动为每个研究对象产生一个文件,其中包含灰质、白质和脑脊液的原始体积值。(3)利用DARTEL算法将上一步生成的文件标准化至由蒙特利尔神经学研究所 (Montreal Neurological Institute,MNI)定义的MNI模板。(4)对标准化后的图像进行质量和均质性检查。 (5)采用8 mm半高全宽高斯核对脑灰质、脑白质及脑脊液进行平滑。 (6)平滑后的图像用于灰、白质体积的比较,提取灰质变化的区域。
脑组织体积 (brain tissue volume,BTV)为受试者脑灰质体积 (grey matter volume,GMV)和脑白质体积 (white matter volume,WMV)之和。全脑体积(total intracranial volume,TIV)为受试者GMV、WMV及脑脊液体积的总和。脑组织体积变量的计算:脑灰质分数 (grey matter fraction,GMF)、脑白质分数(white matter fraction,WMF)和全脑组织分数 (brain tissue fraction,BTF)分别为受试者GMV、WMV、BTV与TIV的比值。
统计学处理 使用IBM SPSS 20.0软件对组间GMV、WMV、BTV、TIV、GMF、WMF及BTF进行独立样本t检验比较,P<0.05为差异有统计学意义。采用SPM8的两独立样本t检验比较病例组与对照组基于体素的灰质体积,P<0.005为差异有统计学意义,簇阈值为30个相邻体素。将NMO患者与对照组之间有显著差异的脑区提取出来,利用Rest(http://pub.restfmri.net/)相关分析分别对上述各个脑区的体积与患者的临床病程、复发次数及EDSS评分进行相关性检验,P<0.05为差异有统计学意义,簇阈值为30个相邻体素。
结果输出及解剖定位 应用xjview(http://www.alivelearn.net/xjview/)将SPM生成的统计结果叠加至标准解剖成像模板,设定适当的阈值和P值,得到t值分布图,并以簇为单位得到各簇的解剖定位。
结 果
全脑体积 NMO组和对照组的 GMV、WMV、BTV、TIV、GMF、WMF、BTF差异均无统计学意义(P值均>0.05)(表1)。
局部脑灰质体积 与对照组相比,NMO组双侧小脑半球、双侧额叶、右侧顶叶、双侧枕叶、双侧颞叶、双侧尾状核、双侧丘脑的多个区域灰质体积减小 [P<0.005(非校正)](表2、图1)。幕上灰质体积减小区域具体分布为中央前回、中央后回、舌回、颞中回、颞下回、枕上回、枕下回、楔叶、楔前叶、距状裂周围皮层、尾状核 (头、体)、丘脑、视束、Brodmann 1、3、4、6、17、18及19区。多数灰质丧失分布于双侧脑内结构,簇的体素数有一定的偏侧性,如左侧小脑半球的灰质丧失较右侧明显。
NMO患者灰质萎缩脑区的体积与患者的临床指标相关性 NMO患者少部分灰质萎缩脑区的体积与EDSS评分、病程、复发次数呈负相关,与EDSS评分呈负相关的区域主要有双侧小脑、右侧颞叶、右侧丘脑,NMO患者双侧颞下回、右侧颞极的体积与病程和复发次数呈负相关 (表3)。
表1 健康对照组与NMO组脑体积的比较 (n=16,±s)Table 1 Comparison of brain volumes between healthy controls and NMO patients(n=16,±s)
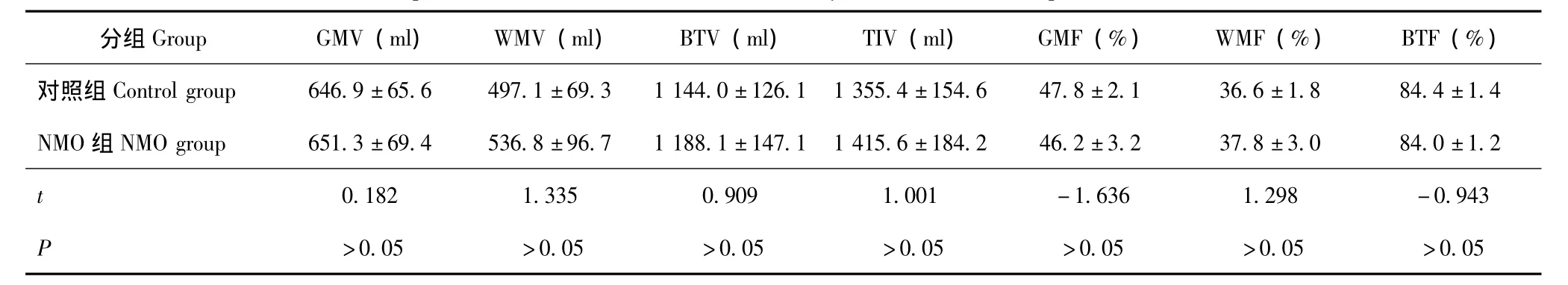
表1 健康对照组与NMO组脑体积的比较 (n=16,±s)Table 1 Comparison of brain volumes between healthy controls and NMO patients(n=16,±s)
NMO:视神经脊髓炎;GMV:脑灰质体积;WMV:脑白质体积;BTV:脑组织体积;TIV:全脑体积;GMF:脑灰质分数;WMF:脑白质分数;BTF:全脑组织分数NMO:neuromyelitis optica;GMV:grey matter volume;WMV:white matter volume;BTV:brain tissue volume;TIV:total intracranial volume;GMF:grey matter fraction;WMF:white matter fraction;BTF:brain tissue fraction
分组Group GMV(ml) WMV(ml) BTV(ml) TIV(ml) GMF(%) WMF(%) BTF(%)对照组Control group 646.9±65.6 497.1±69.3 1 144.0±126.1 1 355.4±154.6 47.8±2.1 36.6±1.8 84.4±1.4 NMO组NMO group 651.3±69.4 536.8±96.7 1 188.1±147.1 1 415.6±184.2 46.2±3.2 37.8±3.0 84.0±1.2 t>0.05 >0.05 >0.05 >0.05 >0.05 >0.05 >0.05 0.182 1.335 0.909 1.001 -1.636 1.298 -0.943 P
讨 论
本研究利用VBM技术将年龄及性别分布差异无统计学意义的NMO患者组和健康志愿者组的脑体积进行组间差异比较,结果显示与对照组相比,NMO组存在多个脑区的灰质体积下降。这与以往使用VBM技术的类似研究所取得的结果具有较好的一致性[1,5,9]。中央前回 (Brodmann 4 区) 和 Brodmann 6区为初级运动皮层和前运动皮层,支配躯体的随意运动和协调姿势动作。中央后回 (Brodmann 1、3区)为体感皮层,接受身体的痛、温、触和本体感觉。NMO患者发生脊髓炎时会出现一系列临床症状,包括运动障碍和感觉障碍,上述区域的灰质体积减小提示NMO脊髓病变可能引起继发性运动和感觉皮层损伤。NMO患者常出现急性视神经炎,视力迅速部分或全部丧失,视力丧失在数月内稳步进展,进行性加重。与多发性硬化 (multiple sclerosis,MS)相比,NMO患者的视神经病变更容易累及双侧视神经,预后较差,尽管使用抗炎和免疫抑制治疗,患者的视觉功能也很难完全恢复。视觉中枢位于枕叶,包括楔叶、舌回、距状裂周围皮层 (Brodmann 17、18及19区),本研究显示NMO患者视觉中枢灰质体积减小,符合NMO患者的临床特点,从结构上揭示NMO视神经病变可能引起患者视皮层受损。Pichiecchio等[9]利用VBM技术研究显示,与健康对照组比较,NMO患者感觉运动皮层和视皮层的灰质体积减小。丘脑和尾状核与神经
节和大脑皮层广泛连接,在感觉、意识、注意力和运动功能方面发挥重要作用。颞叶和边缘叶与精神、记忆、情感和认知相关。有研究显示NMO患者常出现认知障碍[10-11],本研究显示NMO患者的上述区域灰质萎缩,提示NMO患者可出现感觉、运动及认知障碍。Duan等[5]利用VBM技术研究显示,NMO患者灰质体积减少的区域位于额叶、颞叶、顶叶和岛叶。Chanson等[1]报道与对照组相比,NMO患者的丘脑和前额叶皮层灰质体积减小。

表2 NMO组较对照组灰质减少的簇及极值点坐标Table 2 Clusters and peak values of decrease of grey matter volume in NMO patients relative to healthy controls
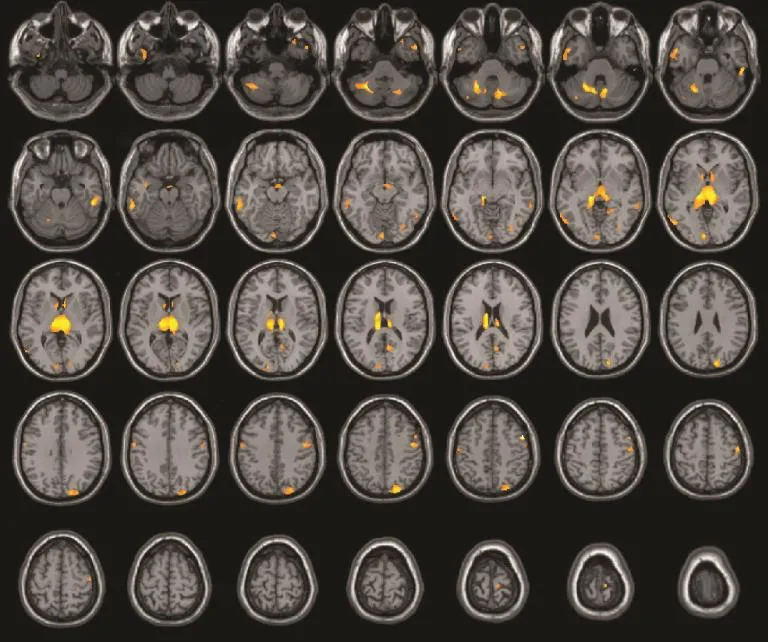
图1 NMO组较对照组灰质体积减少的簇分布图Fig 1 Clusters of decrease of grey matter volume in NMO patients compared to healthy controls

表3 NMO组灰质萎缩脑区的体积与患者的临床指标相关性Table 3 Correlations between grey matter volumes and clinical variables in NMO group
本研究利用VBM技术研究显示,NMO患者存在灰质体积减小,这与其他MRI研究方法所取得的结果[12-15]具有较好的一致性。Rocca等[12]利用磁化传递成像研究显示,NMO患者表现正常的脑灰质区域的磁化传递率减少,说明表现正常的脑灰质存在隐匿性脑损伤。Calabrese等[13]利用FreeSuerfer软件研究显示,与健康志愿者相比,NMO患者的中央前回、中央后回及距状回有局部的轻微皮层厚度变薄。Yu等[14]等利用扩散张量成像研究显示,MRI表现正常的NMO患者,其脑组织扩散存在异常,并认为这种异常可能是继发于视神经和脊髓病变的退行性改变。Rocca等[15]研究显示,与对照组相比,NMO患者的感觉运动皮层、颞叶和枕叶存在功能异常。
病程较长的MS患者几乎都会出现脑灰质病变,病理和影像研究显示,即使第1次发病的MS患者,皮层病变也非常常见。目前尚未发现NMO患者有明确的灰质病变。Calabrese等[13]使用双反转回复序列成像研究NMO、MS和健康志愿者,结果显示超过2/3的复发性MS患者有皮层病变,而NMO和健康志愿者无皮层病变。水通道蛋白4(aquaporins 4,AQP4)抗体在NMO的发病机制中发挥重要作用。在补体存在的情况下,AQP4抗体与AQP4结合后可以激活补体依赖途径和抗体依赖的细胞介导的细胞毒性作用,导致星形胶质细胞受损、坏死[16]。星形细胞坏死后,少突胶质细胞迅速死亡,导致继发性脱髓鞘[17]。Popescu等[18]对 19 例 NMO 患者的脑组织进行免疫组织化学分析,未发现皮层脱髓鞘改变,作者认为NMO患者的认知损害和皮层影像异常改变不是由皮层脱髓鞘引起的,而且认为无皮层病变是NMO和MS的一个鉴别点。近来,Saji等[10]对NMO、MS患者和健康对照进行神经病理检查显示,NMO患者大脑皮层Ⅱ、Ⅲ、Ⅳ层有神经元丢失,Ⅱ层有大量活化的小胶质细胞,在NMO患者脑内未发现皮层脱髓鞘改变。本研究的结果证实,NMO患者脑内存在灰质萎缩,考虑为继发改变,但NMO患者灰质体积减小的机制尚需要进一步研究。
本研究显示NMO患者双侧小脑半球灰质体积减小,既往未见相似报道。小脑的功能主要是调节肌肉紧张程度、维持躯体姿势和平衡、协调随意运动,协调人体运动。NMO主要累及视神经和脊髓,且大部分NMO患者会反复发作视神经炎和 (或)脊髓炎。而且随着复发次数增加,脊髓病变的恢复率不断下降。因此脊髓炎的反复发作会增加NMO患者的致残率,加重运动障碍。笔者认为小脑灰质体积减小可能是脊髓病变所致运动障碍的继发改变。目前有关NMO患者小脑灰质萎缩的报道较少,其损伤的病理生理机制尚需要进一步探讨。
本研究显示双侧小脑、右侧颞叶、右侧丘脑灰质体积与EDSS评分呈负相关,表明这些受累区域的体积与患者临床症状的程度相关,但既往类似报道较少。本研究显示NMO患者双侧颞下回、右侧颞极的灰质体积与病程和复发次数呈负相关,即随着NMO患者病程的增加和复发次数增多,这些区域将会出现进行性的灰质丧失。
本研究采用非校正的分析方法得到NMO患者脑灰质体积减小的分布结果。而当采用错误发现率校正比较时,未发现NMO患者有显著的灰质萎缩区域,提示NMO患者的脑灰质体积改变比较轻微,并不显著,这与部分学者的观点[1,5]较一致。Duan 等[5]采用校正的多因素比较 (P<0.01)分析NMO患者的皮层体积变化时发现,NMO患者与健康对照组的脑皮层体积差异无统计学意义;而当使用非校正 (P<0.001)的方法分析时,发现NMO患者组在额叶、颞叶、顶叶和岛叶部分区域出现明显的皮质萎缩。Chanson等[1]比较NMO患者和对照组的灰质体积差异时,也采取的是非校正的方法。
本研究显示NMO患者的灰质体积减小情况尚存在以下不足之处:(1)本组病例样本量相对较少;(2)缺乏组织病理学证据;(3)未考虑脊髓病变可能对脑体积的影响;(4)未考虑激素治疗对研究结果的影响;(5)关于NMO患者灰质萎缩脑区的体积与临床指标相关性分析缺乏随访研究证据。
综上,在全脑水平,NMO患者并无明显的脑体积减小。使用VBM技术的研究结果显示,NMO患者存在脑灰质异常,表明VBM方法可以有效的反应NMO患者与对照组在局部脑区灰质体积的差异。本研究显示部分区域体积变化与EDSS评分、病程及复发次数呈负相关,提示随着EDSS评分、病程及复发次数的增加,患者的灰质体积减小更明显,但需要进一步研究证实。本研究显示脑灰质萎缩区域与既往使用VBM技术的研究结果具有部分一致性,并且发现既往文献未提及的小脑灰质萎缩情况,表明NMO患者确实存在脑隐匿性损伤,为NMO患者脑结构异常和临床症状提供了影像学证据和基础。但NMO患者局部灰质萎缩的机制尚需要进一步研究探讨。
[1] Chanson JB,Lamy J,Rousseau F,et al.White matter volume is decreased in the brain of patients with neuromyelitis optica[J].Eur J Neurol,2013,20(2):361-367.
[2] Yu C,Lin F,Li K,et al.Pathogenesis of normal-appearing white matter damage in neuromyelitis optica:diffusion-tensor MR imaging[J].Radiology,2008,246(1):222-228.
[3] Zhao DD,Zhou HY,Wu QZ,et al.Diffusion tensor imaging characterization of occult brain damage in relapsing neu-romyelitis optica using 3.0T magnetic resonance imaging techniques[J].Neuroimage,2012,59(4):3173-3177.
[4] Rueda Lopes FC,Doring T,Martins C,et al.The role of demyelination in neuromyelitis optica damage:diffusion-tensor MR imaging study [J].Radiology,2012,263(1):235-242.
[5] Duan Y,Liu Y,Liang P,et al.Comparison of grey matter atrophy between patients with neuromyelitis optica and multiple sclerosis:a voxel-based morphometry study[J].Eur J Radiol,2012,81(2):e110-e114.
[6] 肖慧,马林,陈志谦,等.基于体素的形态测量学技术在视神经脊髓炎脑改变中的初步应用[J].中华放射学杂志,2011,45(4):336-340.
[7] 段云云,刘亚欧,梁佩鹏,等.应用基于体素的形态测量学方法分析视神经脊髓炎患者的脑体积变化[J].中华放射学杂志,2012,46(11):983-987.
[8] Wingerchuk DM,Lennon VA,Pittock SJ,et al.Revised diagnostic criteria for neuromyelitis optica [J].Neurology,2006,66(10):1485-1489.
[9] Pichiecchio A,Tavazzi E,Poloni G,et al.Advanced magnetic resonance imaging of neuromyelitis optica:a multiparametric approach[J].Mult Scler,2012,18(6):817-824.
[10] Saji E,Arakawa M,Yanagawa K,et al.Cognitive impairment and cortical degeneration in neuromyelitis optica[J].Ann Neurol,2013,73(1):65-76.
[11] Blanc F,Noblet V,Jung B,et al.White matter atrophy and cognitive dysfunctions in neuromyelitis optica [J].PloS One,2012,7(4):e33878.
[12] Rocca M,Agosta F,Mezzapesa D,et al.Magnetization transfer and diffusion tensor MRI show gray matter damage in neuromyelitis optica[J].Neurology,2004,62(3):476-478.
[13] Calabrese M,Oh MS,Favaretto A,et al.No MRI evidence of cortical lesions in neuromyelitis optica [J].Neurology,2012,79(16):1671-1676.
[14] Yu CS,Lin FC,Li KC,et al.Diffusion tensor imaging in the assessment of normal-appearing brain tissue damage in relapsing neuromyelitis optica [J].AJNR Am J Neuroradiol,2006,27(5):1009-1015.
[15] Rocca MA,Agosta F,Mezzapesa DM,et al.A functional MRI study of movement-associated cortical changes in patients with Devic’s neuromyelitis optica [J].Neuroimage,2004,21(3):1061-1068.
[16] Kinoshita M,Nakatsuji Y,Moriya M,et al.Astrocytic necrosis is induced by anti-aquaporin-4 antibody-positive serum[J].Neuroreport,2009,20(5):508-512.
[17] Wrzos C,Winkler A,Metz I,et al.Early loss of oligodendrocytes in human and experimental neuromyelitis optica lesions[J].Acta Neuropathol,2013,127(4):523-538.
[18] Popescu BF,Parisi JE,Cabrera-Gomez JA,et al.Absence of cortical demyelination in neuromyelitis optica[J].Neurology,2010,75(23):2103-2109.

