干扰IDH-2基因对小细胞肺癌生长抑制作用的研究
陆建红, 陈国军, 董长林, 郭绍文, 金益军△
(1武警浙江总队医院检验科,浙江 嘉兴 314000; 2上海中医药大学附属曙光医院病理科,上海 200130)
异柠檬酸脱氢酶(isocitrate dehydrogenase, IDH)家族借助 NAD 或NADP 作为辅助因子,催化异柠檬酸的氧化脱酸反应, 生成α-酮戊二酸的酶类,同时分别生成 NADH 或 NADPH[1]。IDH 分为 3个亚型, 其中 IDH-2 在能量代谢和细胞氧化损伤反应中发挥重要的调控作用。国内外研究发现在多种肿瘤中 IDH-2 发生突变。目前 IDH-2 在急性髓细胞白血病、骨髓增殖性肿瘤、胶质瘤[2-3]等疾病中研究较为集中,发现密码子 R140 和 R172 的精氨酸被其它氨基酸替代,使细胞中α-酮戊二酸水平明显下降、2-羟戊二酸水平增高,但 IDH-2在小细胞肺癌中作用的研究国内外鲜有报道。本研究利用RNA 干扰技术抑制人小细胞肺癌细胞 NCI-H446 中IDH-2表达,探讨 IDH-2 在小细胞肺癌中发生与发展的作用,从而为小细胞肺癌的诊断及治疗提供新的靶基因。
材 料 和 方 法
1 材料
人小细胞肺癌细胞株NCI-H446购自中国科学院细胞库;脂质体转染试剂盒 Lipofectamine 2000购自 Invitrogen;siRNA由上海吉玛公司合成;小鼠抗人 IDH-2单抗和小鼠抗人 MAPK p42购自Cell Signal;人HRP标记的β-actin抗体购于上海康成生物工程有限公司;总 RNA提取试剂 Trizol和RT-PCR试剂盒 (TaKaRa);Cell Counting Kit-8 (CCK-8) 试剂盒购于Dojindo;Western blotting试剂盒购于Sigma;二氧化碳培养箱 (NU-3500)、倒置荧光显微镜 (Olympus)和实时定量荧光PCR仪 (ABI 7500)。
2 细胞培养与转染
细胞培养于DMEM培养液 (含10% 胎牛血清,青霉素1×105U/L,链霉素100 mg/L), 37 ℃、5% CO2培养箱内培养。
培养NCI-H446细胞使其充分贴壁,覆盖率达到约60%~70%。IDH-2(BC071828)特异性干扰RNA siRNA-IDH-2和无关对照siRNA-NC由上海吉玛制药技术有限公司设计合成,用 Lipofectamine 2000按说明书进行转染,转染后siRNA浓度为250 nmol/L, siRNA 转染率约达到90%。
3 主要方法
3.1Real-time PCR检测mRNA的表达 用Trizol一步抽提法提取细胞总RNA, 用TaKaRa RT 试剂盒反转录成cDNA。按照SYBR绿色荧光标记试剂盒 (TaKaRa) 说明进行PCR扩增,实时定量荧光PCR仪为ABI 7500。反应程序为:95 ℃ 30 s后;95 ℃ 5 s,60 ℃ 34 s,40个循环。比较阈值法计算目的基因的相对表达。
3.2Western blotting检测蛋白的表达 细胞裂解提取蛋白后,进行SDS-PAGE,转移至硝酸纤维素膜上,5% 脱脂奶粉室温下封闭2 h,Ⅰ抗为IDH-2或MAPK p42(1∶1 000)和 HRP标记的Ⅱ抗室温孵育1 h。
3.3CCK-8 法检测细胞增殖 siRNA-IDH-2 和 siRNA-NC 转染 NCI-H446细胞后,取1×107cells/L 种入 96 孔培养板中(100μL),各组6个平行孔,培养72 h。检测时每孔加入 100 μL CCK-8 混合液(含10 μL CCK-8试剂,90 μL培养液)继续孵箱培养2 h,后酶标仪 450 nm 测定吸光度(A),实验重复3次。细胞存活率(%)=(实验组A-空白对照A)/(NEG组A-空白对照A)×100%。
3.4细胞周期分析 选用对数生长期的 NCI-H446 细胞,以 4×108/L的细胞密度接种于 24 孔培养板中,各组3个平行孔。过夜后按上述方法转染 siRNA,48 h 后收集细胞,用 4 ℃ 预冷 4% 多聚甲醛固定10 min, PBS 洗涤2次后,PI (100 mg/L)37 ℃ 孵育细胞30 min, 后流式细胞术检测。实验重复3次。
3.5细胞迁移实验 NCI-H446 细胞以每孔2×105个铺于 24 孔板,各组3个平行孔。过夜后用 siRNA 转染,8 h 后胰酶消化,用无血清培养基种于孔径为8 μm Transwell 孔中,孔底加10% FCS的培养液。48 h 后,用结晶紫染色,荧光显微镜下观察拍照,并计算40倍目镜下细胞个数,以对照NEG组为 100%,计算各组迁移率。实验重复3次。
3.6动物实验 NCI-H446 细胞铺于6孔板,当细胞处于对数生长期时,siRNA(250 nmol/L)转染细胞。 转染72 h后,将 siRNA-IDH-2和siRNA-NC 2组细胞以及未处理的处于对数生长期的 NEG 组细胞一起消化计数,调整细胞密度后,分别于裸鼠背部皮下接种 1×107cells/100 μL,每组10 只,接种后在恒温、恒湿、新鲜空气、除尘除菌的无特殊病原菌(SPF级)饲养室条件下饲养。接种后连续观察是否成瘤,成瘤后每周由同一测量者用游标卡尺测量肿瘤的最大直径(a)和最小直径(b),按公式V=1/2ab2计算肿瘤体积。
4 统计学处理
数据以均数±标准差(mean±SD)表示,应用SPSS 15.0统计软件分析,多组样本的比较采用方差分析。以P<0.05为差异有统计学意义。
结 果
1 siRNA-IDH-2对 NCI-H446 细胞中 IDH-2 表达的影响
通过 real-time PCR和Western blotting分别检测 IDH-2 mRNA和蛋白表达水平,结果显示,siRNA-IDH-2 能够有效地沉默小细胞肺癌 NCI-H446细胞中IDH-2的表达,与对照组和未处理 NEG 组比较,差异有统计学意义(P<0.01),而对照组和 NEG 组比较差异无统计学意义(P>0.05), 见图1。

Figure 1. The effect of siRNA-IDH-2 on the expression of IDH-2 at mRNA (A) and protein (B) levels in NCI-H446 cells. Mean±SD. n=3. **P<0.01 vs siRNA-NC or NEG.
2 siRNA-IDH-2 对 NCI-H446 细胞增殖及细胞中 MAPK p42蛋白表达的影响
CCK-8方法检测结果显示,siRNA-IDH-2组细胞增殖明显比siRNA-NC和NEG对照组受到抑制,差异有统计学意义 (P<0.01),见图2A。同时 Western blotting结果显示,siRNA-IDH-2 组 MAPK p42 蛋白表达弱于对照组,见图2B,说明是通过MAPK信号通路来抑制细胞生长的。
3 siRNA-IDH-2 对 NCI-H446 细胞周期的影响
siRNA-IDH-2处理组的 S 期细胞明显增加,与对照组相比差异有统计学意义(P<0.01),见图 2C。
4 siRNA-IDH-2 对 NCI-H446 细胞迁移能力的影响
与siRNA-NC组和NEG组比较,3 d 后siRNA-IDH-2组有明显抑制细胞迁移的作用,见图3。
5 siRNA-IDH-2对裸鼠移植瘤生长的影响
siRNA-IDH-2组中裸鼠肿瘤生长明显缓慢,体积明显小于siRNA-NC组和空白组(P<0.01), 而siRNA-NC组和空白组裸鼠肿瘤体积之间差异无统计学意义(P>0.05),见图4。
讨 论
肺癌的发病率和死亡率居恶性肿瘤之首,其中小细胞肺癌(small-cell lung carcinoma, SCLC)是肺癌中恶性度最高的一种,约占原发性肺癌的 20%~30%,以高侵袭性及不良预后为其特征。SCLC 传统治疗以全身化疗为主,90% 以上的患者治疗后复发,5 年生存率仅 1%~3%。SCLC 预后差,迫切需要发展新的疗法,针对小细胞肺癌的基因治疗是其防治的一个方向,其中RNA 干扰[4-5]治疗在小细胞肺癌治疗中有更为广阔的应用前景。
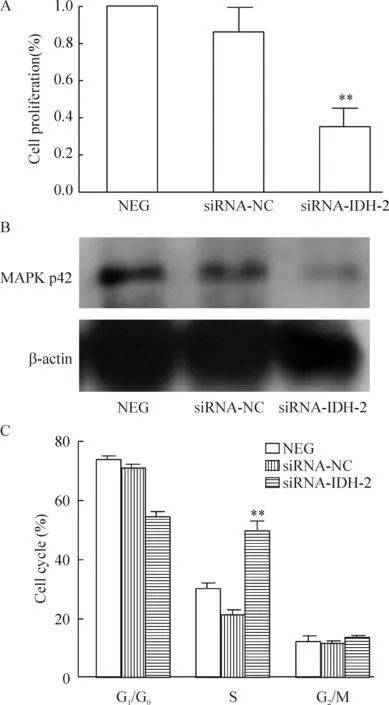
Figure 2. The effect of siRNA-IHH-2 on the cell proliferation(A), the protein expression of MAPK p42 (B) and the cell cycle (C) in NCI-H446 cells. Mean±SD. n=3. ** P<0.01 vs siRNA-NC or NEG.
IDH在能量代谢、氨基酸和维生素合成中扮演重要角色,而且对该酶的活性调节将直接影响 IDH 或 IDH 底物参与不同的生物途径、发挥不同的生物功能。完整的 IDH 活性可保护细胞免于氧化应激,而突变的 IDH 与异柠檬酸的亲和力降低,且突变体催化α-酮戊二酸,最终导致α-酮戊二酸的供应减少[6-7]。α-酮戊二酸的减少又可导致促进肿瘤生长的厌氧诱导因子水平显著升高,因而诱发肿瘤。

Figure 3. The effect of siRNA-IDH-2 on the migration of NCI-H446 cells. Mean±SD. n=3. **P<0.01 vs siRNA-NC or NEG.
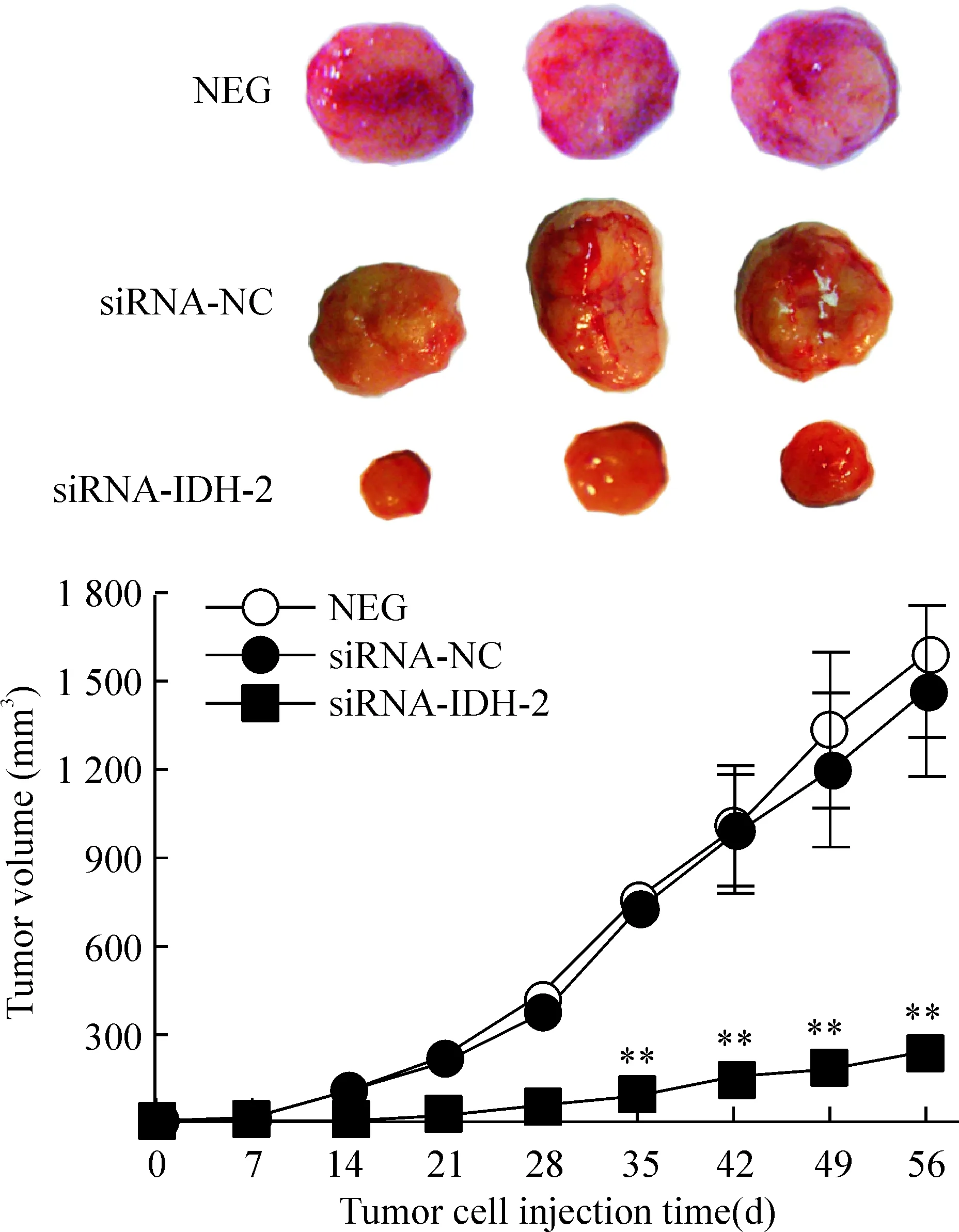
Figure 4. The effect of siRNA-IDH-2 on the xenograft tumors in the nude mice.Mean±SD.n=3.**P<0.01 vs siRNA-NC or NEG.
MAPK p42/44是维持细胞增殖的重要信号通路,在多种肿瘤的发生发展中都有MAPK通路主要蛋白的遗传性和表遗传性活化。本研究中通过siRNA-IDH-2抑制IDH-2表达,同时抑制MAPK p42蛋白的表达,从而说明NCI-H446细胞的生长抑制是通过抑制MAPK信号通路而产生的。MAPK p42蛋白下调引起细胞增殖抑制,细胞周期阻滞于S期,从而引起细胞凋亡,达到良好的抑瘤作用。
目前研究证实细胞内编码 NADP 依赖性 IDH的IDH-1 和IDH-2亚型基因的突变可促进肿瘤发生, 且这2个基因在神经胶质瘤和星状细胞瘤等脑瘤中经常发生突变[8]。以上成果提示,IDH-2可能在肿瘤的发生发展过程中起重要作用。在本研究证实了在NCI-H446细胞中用siRNA特异沉默IDH-2基因后,能有效抑制NCI-H446小细胞肺癌细胞增殖和迁移能力,更重要的是在沉默IDH-2基因后能显著抑制小鼠移植瘤的生长。
[参 考 文 献]
[1] Yen KE, Bittinger MA, Su SM, et al. Cancer-associated IDH mutations: biomarker and therapeutic opportunities[J]. Oncogene, 2010, 29(49):6409-6417.
[2] Nicolas B, Olivier N, Aline R, et al. Prognostic impact of isocitrate dehydrogenase enzyme isoforms l and 2 mutations in acute myeloid leukemia: a study by the Acute Leukemia French Association group[J]. J Clin Oncol, 2010, 28(23):3717-3723.
[3] Jackman DM, Johnson BE. Small-cell lung cancer[J]. Lancet, 2005, 366(9494):1385-1396.
[4] 张德太,张 科,杨 文,等.siRNA沉默G6PD 对人结肠癌细胞HIF-1α表达的影响[J]. 中国病理生理杂志, 2011, 27(8):1544-1548.
[5] 郭 鹏, 沈维高, 赵丽晶, 等. Survivin-siRNA真核重组质粒对前列腺癌移植瘤的抑制作用 [J]. 中国病理生理杂志, 2012, 28(12):2178-2181.
[6] Gross S, Cairns RA, Minden MD, et al. Cancer-asso-ciated metabolite 2-hydroxyglutarate accumulates in acute myelogenous leukemia with isocitrate dehydrogenase 1 and 2 mutations[J]. J Exp Med, 2010, 207(2):339-344.
[7] Ward PS, Patel J, Wise DR, et al. The common feature of leukemia-associated IDH1 and IDH2 mutations is a neomorphic enzyme activity converting alpha-ketoglutarate to 2-hydroxyglutarate[J]. Cancer Cell, 2010, 17(3):225-234.
[8] Parsons DW, Jones S, Zhang X, et al. An integrated genomic analysis of human glioblastoma multiforme[J]. Science, 2008, 321(5897):1807-1812.

