酸敏感离子通道在中枢化学感受器呼吸调节中的作用*
李 丽, 刘文彦, 高 波
(1济宁医学院基础医学教研室,山东 日照 276826; 2济宁医学院生理学教研室,山东 济宁 272100)
中枢化学感受器位于延髓腹外侧的浅表部位,当其局部的细胞外液中或脑脊液中[H+]升高时,可使其受到刺激,并将信号传至呼吸中枢引起呼吸加深加快的反应。血液中的CO2能迅速透过血-脑脊液屏障,与脑脊液中的H2O在碳酸酐酶的作用下反应生成H2CO3,然后解离出H+,间接刺激中枢化学感受器进而引起呼吸兴奋的效应[1]。因此,中枢化学感受器能特异地感受[H+]的变化,进而对呼吸产生重要的调节作用,但目前对于中枢化学感受器呼吸调节的机制尚不完全清楚。酸敏感离子通道(acid sensing ion channels, ASICs)是一类存在于细胞膜上的蛋白复合体,属于非电压门控的对Na+有高度通透性的离子通道,由细胞外酸化激活,可以特异地感受[H+]的变化,并在外周和中枢广泛表达。ASIC1a是ASICs的一种亚型,当pH值小于6.9时,ASIC1a即可被激活,并能被PcTx1特异性阻断[2]。由此我们推测,ASICs尤其是ASIC1a可能在由中枢化学感受器介导的呼吸调节中发挥重要作用。因此,在本研究中,以膈肌肌电为指标,通过脑室内注射酸化人工脑脊液(artificial cerebrospinal fluid, aCSF),观察中枢化学感受器受到刺激时呼吸的变化;然后通过脑室内注射ASICs的阻断剂阿米洛利和ASIC1a特异性阻断剂PcTx1,观察阿米洛利和PcTx1对脑室内注射酸化aCSF所致呼吸效应的影响,以期探讨ASICs在中枢化学感受器呼吸调节中的作用。
材 料 和 方 法
1 动物与主要试剂
实验选用健康成年SD大鼠共30只,雌雄不限,体重250~300 g,由山东大学实验动物中心提供。
阿米洛利(amiloride)购自Sigma,PcTx1购自Spider Pharm。
2 方法
2.1实验分组 健康成年SD大鼠随机分为6组,aCSF(pH 7.4)对照组(4只)、aCSF(pH 6.5)组(6只)、amiloride对照组(4只)、amiloride+aCSF(pH 6.5)组(6只)、PcTx1对照组(4只)及PcTx1+aCSF(pH 6.5)组(6只)。
2.2侧脑室注射 所有动物经氨基甲酸乙酯(1 g/kg)腹腔注射麻醉后,将大鼠固定在手术台上,行颈部气管插管,切断双侧迷走神经,一侧股动脉插管以监测血压,于剑突下打开腹腔并暴露膈肌,并在膈肌上找到合适位置连接电极,以膈肌肌电记录呼吸运动的变化。 然后以先固定双耳、再固定门齿的顺序将大鼠固定在脑立体定位仪中以保持大鼠头位的水平。参照Paxinos和Watson的《鼠脑立体定位图谱》,以Bregma点向后1.0 mm、中线旁开1.5 mm处为穿刺点,通过微量进样器垂直进针3.5~4.0 mm向侧脑室内缓慢匀速注射药物。aCSF(pH 7.4)对照组注射aCSF(pH 7.4) 10 μL;aCSF(pH 6.5)组注射aCSF(pH 6.5) 10 μL;amiloride对照组注射amiloride(10 mmol/L)10 μL;amiloride+aCSF (pH 6.5)组注射amiloride(10 mmol/L)10 μL后立刻注射aCSF(pH 6.5)10 μL;PcTx1对照组注射PcTx1(10 nmol/L)10 μL;PcTx1+aCSF(pH 6.5)组注射PcTx1(10 nmol/L)10 μL后立刻注射aCSF(pH 6.5)10 μL。
2.3观察指标 所有动物在手术基本结束、微量进样器药物注射前恢复30 min。自微量注射器注射药物前 5 min、注射药物即刻及注射药物后每5 min监测1次血压和呼吸,每次监测1 min,呼吸和血压均经BL-420生物机能实验系统进行观察和分析。股动脉平均压(mean blood pressure, MBP)以mmHg表示,膈肌肌电呼吸的变化以吸气时程(inspiratory time, TI)、呼气时程(expiratory time, TE)、呼吸频率(respiratory frequency, RF)和吸气幅度(amplitude of inspiration, Amp)为指标进行观察。
2.4注射部位鉴定 实验结束后,向脑室内注入20 g/L美蓝溶液0.5 μL并处死动物开颅取脑,100 mL/L甲醛固定24 h,切开鉴定药物注射部位,凡未注入侧脑室的动物结果弃去。
3 统计学处理
数据以均数±标准差(mean±SD)表示,采用SPSS分析软件,通过两均数比较t检验,对结果进行统计分析,以P<0.05为差异有统计学意义。
结 果
所有动物在注射药物前后血压无显著变化(P>0.05),见表1。aCSF(pH 7.4)对照组动物、amiloride对照组动物及PcTx1对照组动物药物注射前后呼吸无明显变化(P>0.05);aCSF(pH 6.5)组及PcTx1+aCSF(pH 6.5)组动物,药物注射时呼吸无明显变化,药物注射5 mim后开始出现呼吸兴奋,但尚未有统计学差异(P>0.05),药物注射10 min后呼吸明显兴奋(P<0.05),药物注射15 min呼吸兴奋程度明显减弱,与注射药物前无显著差异(P>0.05),药物注射后20 min呼吸基本恢复正常;amiloride+aCSF(pH 6.5)组动物药物注射前后无明显变化(P>0.05),见表1、图1。aCSF(pH 6.5)组动物及PcTx1+aCSF(pH 6.5)组动物在药物注射后10 min,计算其TI、TE、RF、Amp的变化率(injection 10-pre-injection)/pre-injection×100%,结果显示PcTx1+aCSF(pH 6.5)组的动物以上数据的变化率明显低于aCSF(pH 6.5)组的动物,即药物注射10 min后呼吸兴奋程度明显低于aCSF(pH 6.5)组动物(P<0.05),见表2。
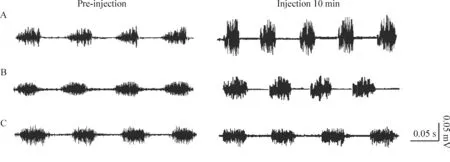
Figure 1. The effect of amioride and PcTx1 on the respiratory reactions induced by intracerebroventricular injection of aCSF (pH 6.5) in the rats. A: injection of aCSF (pH 6.5); B: injection of PcTx1 plus aCSF (pH 6.5); C: injection of amiloride plus aCSF (pH 6.5).
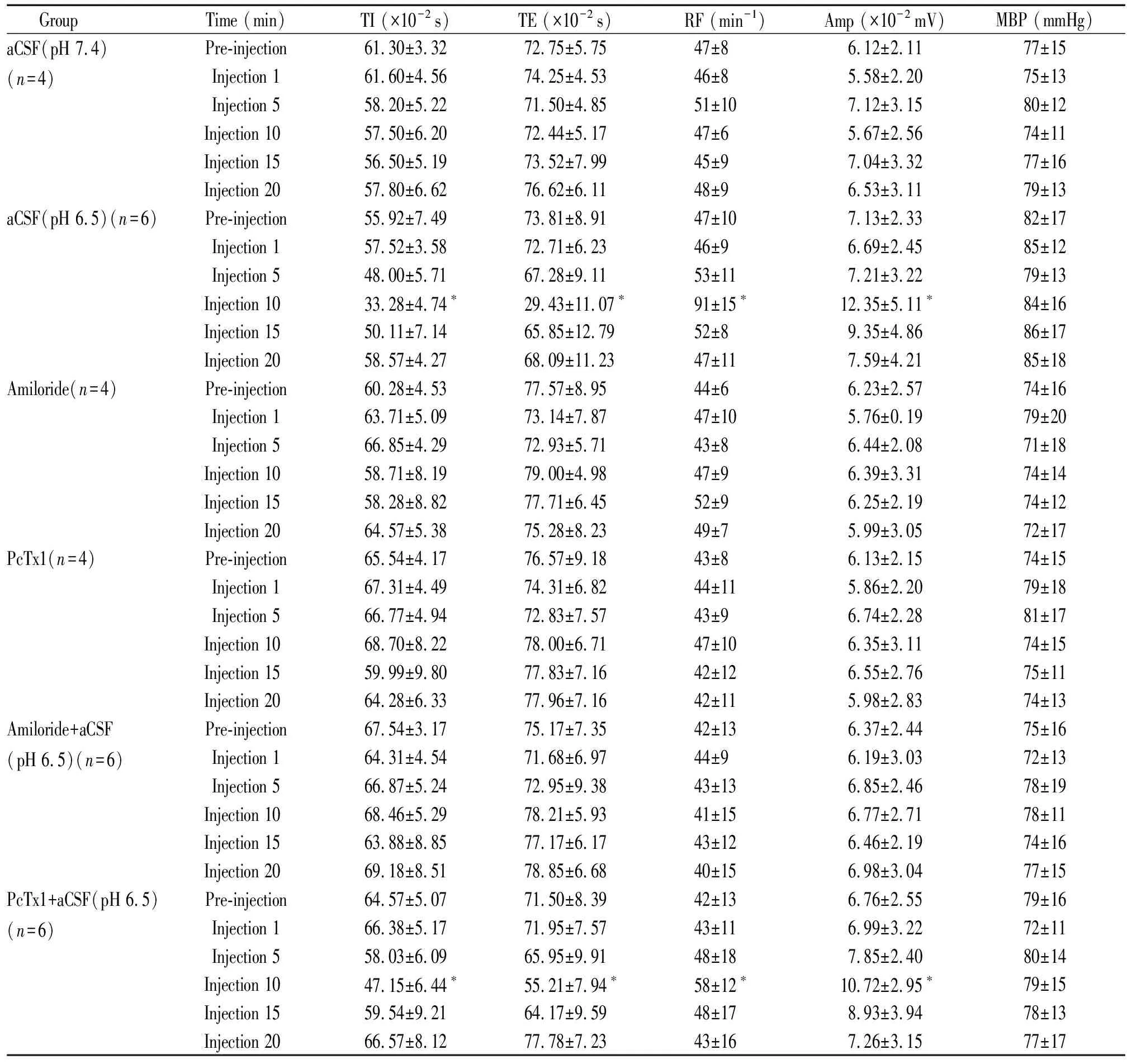
表1 Amiloride和PcTx1 对脑室内注射aCSF(pH 6.5)所致的呼吸效应和股动脉平均压的影响

表2 PcTx1对脑室内注射aCSF(pH 6.5)引起呼吸效应变化的影响
讨 论
1 脑室内注射aCSF(pH 6.5)对呼吸的影响
在本研究中,脑室内注射aCSF(pH 6.5)后10 min TI、TE明显缩短,RF明显增快,Amp明显增大,即呼吸出现明显兴奋,而脑室内注射aCSF(pH 7.4)后呼吸没有明显变化,提示呼吸兴奋的出现是脑室内注射酸化aCSF所致。脑室内注射aCSF(pH 6.5)后造成脑脊液中[H+]升高,可直接刺激位于延髓腹外侧浅表部位中枢化学感受器头端区和尾端区的化学敏感神经元,并将此信号传至脑干呼吸中枢,引起呼吸兴奋[3]。近年来的研究表明,斜方体后核、孤束核、蓝斑及下丘脑等部位也存在化学敏感神经元,当它们受到酸化刺激时也会引起呼吸兴奋[4]。
2 Amiloride对脑室内注射aCSF(pH 6.5)引起的呼吸效应的影响
ASICs属于非电压门控的对Na+有通透性的离子通道,由细胞外酸化激活,在外周和中枢神经系统广泛表达。目前的研究表明,ASICs有ASIC1a、ASIC1b、ASIC2a、ASIC2b、ASIC3及ASIC46种亚型,在外周与触觉、酸味觉、视觉及伤害性刺激的感知有关,在中枢与脑组织缺血缺氧、癫痫等病理过程有关。6种亚型都可被阿米洛利阻断[5]。在本研究中,脑室内先注射amiloride,随后注射aCSF(pH 6.5),呼吸并未表现出明显的兴奋,而脑室内单独注射amiloride,呼吸也未出现明显的变化,提示amiloride对正常呼吸不存在明显的影响,但能阻断脑脊液酸化后引起的呼吸兴奋效应。这与宋娜娜[6]在中枢化学感受器-延髓腹外侧浅表部位微量注射amiloride 后注射酸化aCSF引起的呼吸效应基本一致。由此可知,ASICs是参与中枢化学感受器呼吸调节的关键通道,但究竟是ASICs哪一种亚型在此过程中起主要作用,还有待进一步的研究证实。
3 PcTx1对脑室内注射aCSF (pH 6.5)引起的呼吸效应的影响
ASIC1a是ASICs的一种亚型,当细胞外液pH值小于6.9时即可被激活,随即引发快速激活及快速失活的电流,主要通透钠离子,在脑及感觉神经元广泛表达。PcTx1最初是从一种南美洲狼蛛千里达老虎尾的毒腺中提取的毒素,能特异性阻断ASIC1a[7]。在本研究中,脑室内注射PcTx1,随后注射aCSF(pH 6.5),呼吸兴奋程度较单独注射aCSF(pH 6.5)明显减弱,而脑室内单独注射PcTx1呼吸没有出现明显的变化,提示ASIC1a在脑室内注射aCSF(pH 6.5)引起的呼吸效应中发挥了部分作用。
综上所述,脑室内注射酸化aCSF能刺激中枢化学感受器引起呼吸兴奋,ASICs是参与此过程的关键离子通道,而ASIC1a在此过程只发挥了部分作用,推测ASICs其它的亚型也参与了此过程。
[参 考 文 献]
[1] 郑 煜. 呼吸[M]∥朱大年.生理学. 第8版. 北京: 人民卫生出版社,2013:177-185.
[2] 李 丽. 酸敏感的离子通道研究简介[J]. 中华生物医学工程杂志, 2010, 16(1):79-82.
[3] Guyenet PG, Abbott SB. Chemoreception and asphyxia-induced arousal[J]. Respir Physiol Neurobiol, 2013, 188(3):333-343.
[4] Guyenet PG, Abbott SB, Stornetta RL. The respiratory chemoreception conundrum: light at the end of the tunnel[J]. Brain Res, 2013, 1511:126-137.
[5] Benarroch EE. Acid-sensing cation channels: structure, function, and pathophysiologic implications[J]. Neurology, 2014, 82(7):628-635.
[6] 宋娜娜.中枢酸敏感离子通道对呼吸的调节及机制研究[D].上海: 复旦大学,2010.
[7] Diochot S1, Salinas M, Baron A, et al. Peptides inhibitors of acid-sensing ion channels[J]. Toxicon, 2007, 49(2):271-284.

