硫化铟氧化酸浸与常规酸浸的动力学比较
韦岩松 黎铉海 马 宸
(1.河池学院化学与生物工程学院,广西 宜州 546300;2.广西大学化学化工学院,广西 南宁 530004)
硫化铟氧化酸浸与常规酸浸的动力学比较
韦岩松1黎铉海2马 宸2
(1.河池学院化学与生物工程学院,广西 宜州 546300;2.广西大学化学化工学院,广西 南宁 530004)
为了提高硫化铟的浸出率,从研究硫化铟常规酸浸、高锰酸钾或双氧水氧化酸浸的晶粒参数、表观活化能、反应级数的变化规律入手,对不同状态下硫化铟的浸出动力学进行了研究。结果表明:①硫化铟浸出反应的表观活化能、反应级数、晶粒参数,在常规酸浸状态下分别为35.6 kJ/mol、0.770、0.576,高锰酸钾氧化酸浸状态下分别为13.9 kJ/mol、0.390、0.366,双氧水氧化酸浸状态下分别为17.5 kJ/mol、0.220、0.466。②硫化铟常规酸浸的铟浸出率对浸出温度、硫酸初始浓度的变化比较敏感;而硫化铟氧化酸浸的表观活化能和反应级数均大幅度下降,化学活性显著增强,反应速率明显加快,浸出温度和硫酸初始浓度对铟浸出影响的敏感度下降。③硫化铟的常规酸浸及氧化酸浸动力学模型符合n<1的Avrami方程,常规酸浸受化学反应与扩散混合控制,而氧化酸浸则受扩散控制,因此,强化搅拌扩散有利于提高铟浸出率。
硫化铟 常规浸出 氧化浸出 动力学模型 Avrami方程
铟是一种珍贵的稀散金属,在地壳中的储量只有黄金的1/6。由于铟锡氧化物是生产电脑、电视、手机等液晶屏或接触屏所不可或缺的原材料,因此,2000年以来,全球铟的需求量年均增速高达30%以上[1]。
铟具有亲硫性,其硫化物常伴生于铅、锌、锡等金属矿物中。在主金属冶炼过程中,硫化铟最终以铟氧化物、铟硫化物和铟铁酸锌等形式富集在炉渣和烟尘中[2]。为了从含铟矿物中高效提取铟,不少学者研究后提出了多种强化铟浸出的手段[3-4],但铟浸出率始终不高。
要解决铟浸出率不高的问题,就必须深入了解各相态铟的浸出规律。笔者及合作者此前曾就硫化铟常规酸浸和氧化酸浸工艺[5]及常压下硫化铟在硫酸体系中的浸出动力学[6]发表过研究论文。本试验将在硫酸体系中,以高锰酸钾、双氧水为氧化剂,研究浸出温度和硫酸初始浓度对铟浸出率的影响,探索浸出反应表观活化能、反应级数的变化规律,揭示浸铟动力学模型,为提高浸铟效率提供基础数据和理论依据。
1 浸出动力学模型
文献[5-6]已对硫化铟的常规酸浸、氧化酸浸原理作过系统介绍,并指出浸出动力学研究的目的在于确定浸出速度与浸出温度、浸出剂浓度等的关系。文献[7-8]指出此浸出过程是一个复杂的多相反应过程,其浸出规律曲线可采用Avrami模型进行拟合[9-10],Avrami模型为
(1)
式中,x为铟浸出率,%;k为反应速率常数;t为反应时间,min;n为晶粒参数(与成核机理、矿物中晶粒性质及几何形状有关),当n≤1时,属于先快后慢的浸出类型,n=1表明浸出受化学反应控制,1>n≥0.5表明浸出受化学反应和扩散混合控制,n<0.5表明浸出受扩散控制;k0为指前因子;C为浸出剂浓度,mol/L;N为反应级数;Ea为反应活化能,kJ/mol;R为气体反应常数;T为反应温度,K。
2 浸出试验结果
试验用硫化铟为实验室自行合成的粒度为0.096~0.075 mm的高纯硫化铟。浸出温度对浸出率影响试验的硫酸初始浓度为1.0 mol/L,搅拌速度为800 r/min,不同浸出状态下的试验结果见图1、图2、图3;硫酸初始浓度对浸出率影响试验的浸出温度为80 ℃,搅拌速度为800 r/min,不同浸出状态下的试验结果见图4、图5、图6。

图1 常规酸浸不同温度下试验结果Fig.1 Test results of conventional acid leaching under different temperature■—50 ℃;●—60 ℃; ▲—70 ℃;×—80 ℃;◆—90 ℃

图2 高锰酸钾(4.66 g)氧化酸浸不同温度下试验结果Fig.2 Test results of potassium permanganate(4.66 g) oxidizing acid leaching under different temperature■—50 ℃;●—60 ℃; ▲—70 ℃;×—80 ℃;◆—90 ℃

图3 双氧水(10 mL)氧化酸浸不同温度下试验结果Fig.3 Test results of hydrogen peroxide(10 mL) oxidizing acid leaching under different temperature■—50 ℃;●—60 ℃; ▲—70 ℃;×—80 ℃;◆—90 ℃

图4 常规酸浸不同硫酸初始浓度下试验结果Fig.4 Test results of conventional acid leaching under different initial concentration of sulfuric acid■—0.5 mol /L;●—0.75 mol/L; ▲—1.0 mol/L; ×—1.5 mol/L;◆—2.0 mol/L
从图1~图6可以看出,随着浸出时间的延长,浸出率均呈先快后慢的上升趋势;氧化剂的添加使浸出率在浸出最初的短暂时间内就达到相当高水平;氧化剂的添加可以提高最终浸出率;浸出温度和硫酸初始浓度的提高均有促进浸出的效果。
3 模型参数的确定
3.1 晶粒参数的确定与比较
将图1~图6中的试验数据分别代入式(1),以ln(-ln(1-x))对lnt作图,并对图中数据进行线性回归,结果见图7~图12。
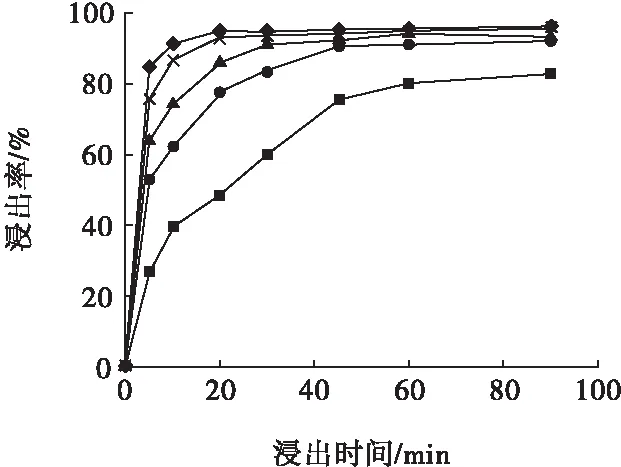
图5 高锰酸钾(4.66 g)氧化酸浸不同硫酸初始浓度下试验结果Fig.5 Test results of potassium permanganate (4.66 g) oxidizing acid leaching under different initial concentration of sulfuric acid■—0.5 mol /L;●—0.75 mol/L; ▲—1.0 mol/L; ×—1.5 mol/L;◆—2.0 mol/L

图6 双氧水(10 mL)氧化酸浸不同硫酸初始浓度下试验结果Fig.6 Test results of hydrogen peroxide(10 mL) oxidizing acid leaching under different initial concentration of sulfuric acid■—0.5 mol /L;●—0.75 mol/L; ▲—1.0 mol/L; ×—1.5 mol/L;◆—2.0 mol/L
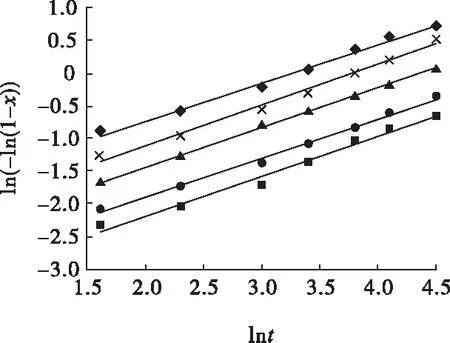
图7 常规酸浸不同温度下ln(-ln(1-x))与lnt的关系Fig.7 Relationships between ln(-ln(1-x)) and lnt under different temperature of conventional acid leaching■—50 ℃;●—60 ℃;▲—70 ℃;×—80 ℃;◆—90 ℃
从图7~图12可知,常规浸出状态下,不同温度或不同硫酸初始浓度下回归方程的斜率非常接近,说明常规浸出状态下温度或硫酸初始浓度变化对浸出率的影响规律相似;加入氧化剂高锰酸钾或双氧水后,不同温度或不同硫酸初始浓度下,随着温度升高或硫酸初始浓度增大,回归方程的斜率变小,表明温度或硫酸初始浓度因素对浸出率影响的敏感度下降,此时氧化剂主导了化学反应的速度,且在反应最初的短暂时间内就达到了较高的浸出率;以高锰酸钾为氧化剂时回归方程的斜率低于以双氧水为氧化剂时,表明以高锰酸钾为氧化剂时,温度或硫酸初始浓度因素对浸出率影响的敏感度低于以双氧水为氧化剂时,即高锰酸钾所产生的氧化效果强于双氧水,这是由于双氧水在一定温度下更容易挥发和分解,从而影响其氧化效果。

图8 高锰酸钾氧化酸浸不同温度下 ln(-ln(1-x))与lnt的关系Fig.8 Relationships between ln(-ln(1-x))and lnt under different temperature of potassium permanganate oxidizing acid leaching■—50 ℃;●—60 ℃;▲—70 ℃;×—80 ℃;◆—90 ℃
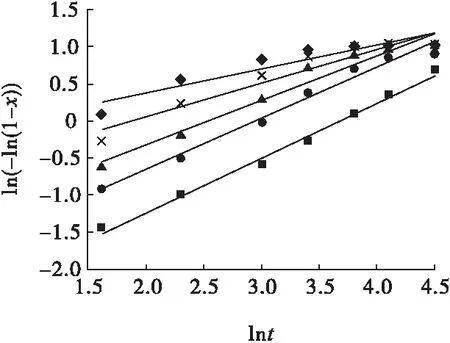
图9 双氧水氧化酸浸不同温度下ln(-ln(1-x))与lnt的关系Fig.9 Relationships between ln(-ln(1-x)) and lnt under different temperature of hydrogen peroxide oxidizing acid leaching■—50 ℃;●—60 ℃;▲—70 ℃;×—80 ℃;◆—90 ℃

图10 常规酸浸不同硫酸初始浓度下ln(-ln(1-x))与lnt的关系Fig.10 Relationships between ln(-ln(1-x)) and lnt under different initial concentration of sulfuric acid of conventional acid leaching■—0.5 mol /L;●—0.75 mol/L; ▲—1.0 mol/L; ×—1.5 mol/L;◆—2.0 mol/L
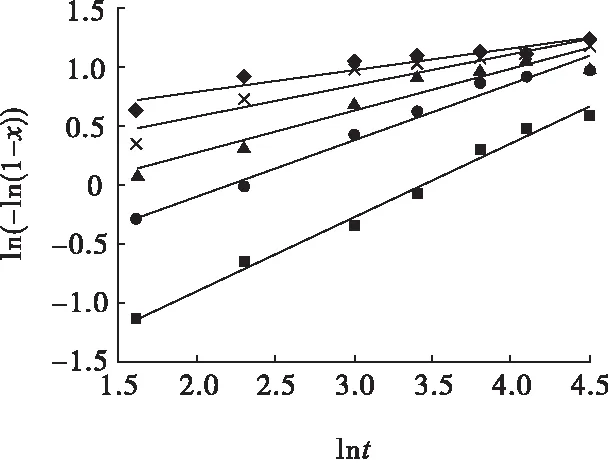
图11 高锰酸钾氧化酸浸不同硫酸初始浓度下ln(-ln(1-x))与lnt的关系Fig.11 Relationships between ln(-ln(1-x)) and lntunder different initial concentration of sulfuric acid of potassium permanganate oxidizing acid leaching■—0.5 mol /L;●—0.75 mol/L; ▲—1.0 mol/L; ×—1.5 mol/L;◆—2.0 mol/L
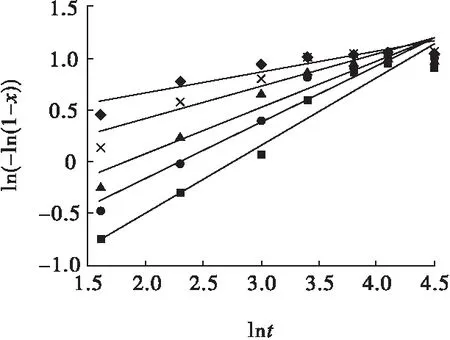
图12 双氧水氧化酸浸不同硫酸初始浓度下ln(-ln(1-x))与lnt的关系Fig.12 Relationships between ln(-ln(1-x)) and lnt under different initial concentration of sulfuric acid of hydrogen peroxide oxidizing acid leaching■—0.5 mol /L;●—0.75 mol/L; ▲—1.0 mol/L; ×—1.5 mol/L;◆—2.0 mol/L
图7、图10中各回归方程斜率的均值即为硫化铟常规硫酸浸出时的晶粒参数,即nC=0.576,表明该浸出过程受化学反应和扩散混合控制;图8、图11中各回归方程斜率的均值即为硫化铟高锰酸钾氧化酸浸时的晶粒参数,即nG=0.336,表明该浸出过程受扩散控制;图9、图12中各回归方程斜率的均值即为硫化铟双氧水氧化酸浸时的晶粒参数,即nS=0.466,表明该浸出过程受扩散控制。
3.2 表观活化能和指前因子的确定与比较
将3.1节确定的晶粒参数n与图1~图3试验结果代入式(1),以-ln(1-x))对tn作图,并对图中的数据进行线性回归,结果见图13~图15。
图13~图15中各回归方程的斜率即为对应状态、对应温度下的反应速率常数k。然后将k、T值代入式(1),以lnk对1/T作图,并对图中数据进行线性回归,结果见图16。
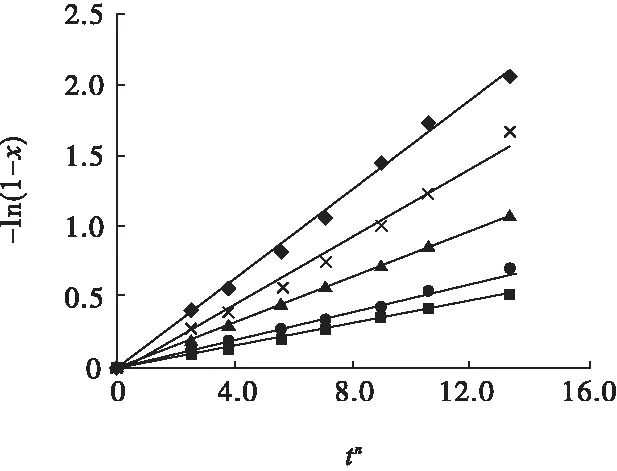
图13 常规酸浸不同温度下-ln(1-x))与tn的关系Fig.13 Relationships between -ln(1-x) and tnunder different temperature of conventional acid leaching■—50 ℃;●—60 ℃;▲—70 ℃;×—80 ℃;◆—90 ℃

图14 高锰酸钾氧化酸浸不同温度下-ln(1-x))与tn的关系Fig.14 Relationships between -ln(1-x) and tnunder different temperature of potassium permanganate oxidizing acid leaching■—50 ℃;●—60 ℃;▲—70 ℃;×—80 ℃;◆—90 ℃
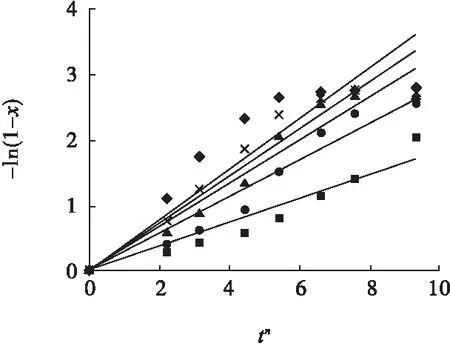
图15 双氧水氧化酸浸不同温度下-ln(1-x))与tn的关系Fig.15 Relationships between -ln(1-x) and tnunder different temperature of hydrogen peroxide oxidizing acid leaching■—50 ℃;●—60 ℃;▲—70 ℃;×—80 ℃;◆—90 ℃
利用图16中3个回归方程的斜率-Ea/R和截距lnk0可求得硫化铟常规浸出、高锰酸钾氧化酸浸及双氧水氧化酸浸时的表观活化能Ea分别为35.6、13.9和17.5 kJ/mol,指前因子k0分别为2.17×104、71.7和138.38。
由不同浸出状态下表观活化能数值的变化可知,高锰酸钾和双氧水的加入分别使浸出反应的活化能下降了61%和51%,说明硫化铟在常规酸浸体现中浸出最难,在高锰酸钾-硫酸体系中浸出最容易,高锰酸钾比双氧水对反应速率加快的作用更显著。硫化铟在硫酸体系中进行常规浸出时,浸出温度对铟浸出率的影响比较敏感,浸出过程由化学反应和扩散过程共同控制;加入氧化剂后反应的活化能有较大幅度的降低,致使反应体系中硫化铟的化学活性增强,反应速率加快,氧化剂的强氧化性主导了硫化铟的浸出行为,因而温度对铟浸出影响的敏感度下降。

图16 3种浸出状态下lnk与T-1的关系Fig.16 Relationships between lnk and T-1under three different leaching conditions■—常规酸浸;◆—高锰酸钾氧化浸出;▲—双氧水氧化浸出
3.3 反应级数的确定与比较
将3.1节确定的晶粒参数n与图4~图6试验结果代入式(1),以-ln(1-x))对tn作图,并对图中的数据进行线性回归,结果见图17~图19。
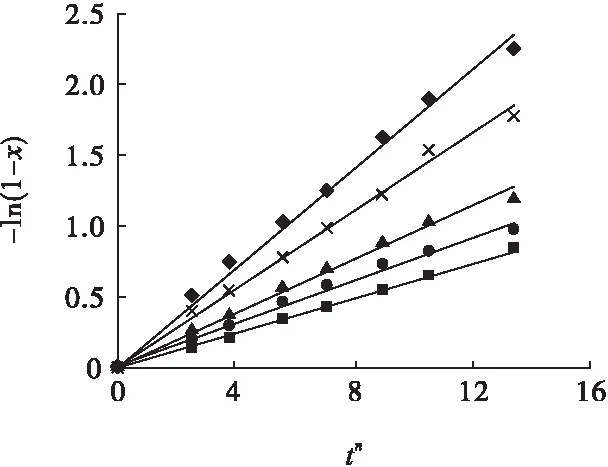
图17 常规酸浸不同硫酸初始浓度下-ln(1-x))与tn的关系Fig.17 Relationships between -ln(1-x) and tnunder different initial concentration of sulfuric acid of conventional acid leaching■—0.5 mol /L;●—0.75 mol/L; ▲—1.0 mol/L; ×—1.5 mol/L;◆—2.0 mol/L
图17~图19中各回归方程的斜率即为对应状态、对应硫酸初始浓度下的反应速率常数k。然后将k、Ea、C值代入式(1),以lnk对lnC作图,并对图中数据进行线性回归,结果见图20。
图20中3个回归方程的斜率即为硫化铟常规浸出、高锰酸钾氧化酸浸及双氧水氧化酸浸时的反应级数N,分别为0.770、0.390和0.220。

图18 高锰酸钾氧化酸浸不同硫酸初始浓度下-ln(1-x))与tn的关系Fig.18 Relationships between -ln(1-x) and tnunder different initial concentration of sulfuric acid of potassium permanganate oxidizing acid leaching■—0.5 mol /L;●—0.75 mol/L; ▲—1.0 mol/L; ×—1.5 mol/L;◆—2.0 mol/L

图19 双氧水氧化酸浸不同硫酸初始浓度下-ln(1-x))与tn的关系Fig.19 Relationships between -ln(1-x) and tnunder different initial concentration of sulfuric acid of hydrogen peroxide oxidizing acid leaching■—0.5 mol /L;●—0.75 mol/L; ▲—1.0 mol/L; ×—1.5 mol/L;◆—2.0 mol/L

图20 3种浸出状态下lnk与lnC的关系Fig.20 Relationships between lnk and lnC under three different leaching conditions◆—高锰酸钾氧化浸出;▲—双氧水氧化浸出
由不同浸出状态下反应级数的变化可知,高锰酸钾和双氧水的加入分别使浸出反应级数下降了49%和71%,即氧化剂的加入可显著降低硫酸初始浓度对铟浸出率影响的敏感度,浸出过程对硫酸初始浓度的依赖性显著降低,该过程属扩散控制。
4 浸出动力学方程比较及其意义
将求得的晶粒参数n、表观活化能Ea、指前因子k0以及反应级数N代入式(1),所得到的硫化铟常规酸浸、高锰酸钾氧化酸浸及双氧水氧化酸浸时的动力学方程分别为
-ln
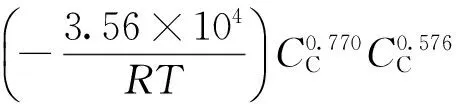
(2)
(3)

(4)
由硫化铟常规酸浸、高锰酸钾氧化酸浸及双氧水氧化酸浸的动力学方程可知,氧化剂高锰酸钾和双氧水的加入显著地降低了表观活化能,表明该浸出反应速度显著加快;同时由于氧化剂的加入,浸出反应的晶粒参数从常规硫酸浸出状态下的0.576降至0.5以下,表明该浸出反应受扩散控制。因此,强化浸出反应的扩散效应对提高铟浸出率具有重要意义。
5 结 论
(1)硫化铟常规硫酸浸出反应的表观活化能、反应级数、晶粒参数分别为35.6 kJ/mol、0.770、0.576;以高锰酸钾为氧化剂的氧化酸浸反应的表观活化能、反应级数、晶粒参数分别为13.9 kJ/mol、0.390、0.366;以双氧水为氧化剂的氧化酸浸反应的表观活化能、反应级数、晶粒参数分别为17.5 kJ/mol、0.220、0.466。
(2)硫化铟在硫酸体系中进行常规浸出时,铟浸出率对浸出温度、硫酸初始浓度的变化比较敏感,且影响规律相似,而加入氧化剂高锰酸钾或双氧水后,反应的表观活化能和反应级数均大幅度下降,致使化学活性增强,反应速率加快,温度和硫酸初始浓度对铟浸出影响的敏感度下降。
(3)硫化铟的常规酸浸及以高锰酸钾或双氧水为氧化剂的氧化酸浸动力学模型符合n<1的Avrami方程,常规酸浸受化学反应与扩散混合控制,而氧化酸浸则受扩散控制。因此,在实际硫化铟矿物的浸出时,无论是常规酸浸还是氧化酸浸,都应采取强化扩散的措施以提高铟浸出率。
[1] 谢 铿,温建康,华一新.硫化锌精矿中铟的赋存及提取工艺概况[J].矿产保护与利用,2008(1):39-43. Xie Keng,Wen Jiankang,Hua Yixin.A review on the occurrence characteristics of indium in zinc sulfide concentrates and its extraction techniques[J].Conservation and Utilization of Mineral Resources,2008(1):39-43.
[2] 赵秦生.铟在锌湿法冶金半成品中的存在形式[J].稀有金属与硬质合金,2008,36(2):44-48. Zhao Qinsheng.The form of indium existing in semifinished products of zinc hydrometal lurgy[J].Rare Metals and Cemented Carbides,2008,36(2):44-48.
[3] 李小英,王吉坤,麦振海.高铁硫化锌精矿氧压浸出铟的研究[J].云南冶金,2006,35(6):27-29. Li Xiaoying,Wang Jikun,Mai Zhenhai.Study on indium leaching by pressure-oxidation from high-iron zinc sulphide concentrate[J].Yunnan Metallurgy,2006,35(6):27-29.
[4] 车拥霞,李建成.从低品位含铟物料中富集铟[J].有色金属:冶炼部分,2006(6):40-41. Che Yongxia,Li Jiancheng.Indium enrichment from low grade indium containing material[J].Nonferrous Metals:Smelting Part,2006(6):40-41.
[5] 韦岩松,马 宸,黎铉海.硫化铟常规酸浸和氧化酸浸试验研究[J].金属矿山,2011(6):86-88. Wei Yansong,Ma Chen,Li Xuanhai.Research on the process for conventional leaching and oxidation leaching of indium sulfide[J].Metal Mine,2011(6):86-88.
[6] 黎铉海,马 宸,俸 余,等.硫化铟常压硫酸浸出动力学研究[J].金属矿山,2011(6):89-92. Li Xuanhai,Ma Chen,Feng Yu,et al.Study on sulfuric acid leaching kinetics of indium sulfide at normal pressure[J].Metal Mine,2011(6):89-92.
[7] Abdel L E A,Rashad M M.Kinetic study on the leaching of spent nickel oxide catalyst with sulfuric acid[J].Hydrometallurgy,2004,74(2):189-194.
[8] 张荣良,唐淑贞,佘媛媛,等.HCl-NaCl浸出铅锑合金氧化吹炼渣过程中锑的浸出动力学[J].过程工程学报,2006,6(4):544-547. Zhang Rongliang,Tang Shuzhen,She Yuanyuan,et al.Kinetics of antimony leaching from oxidizing-converting slag of Pb-Sb alloy by HCl-NaCl[J].The Chinese Journal of Process Engineering,2006,6(4):544-547.
[9] 肖 纯,杨声海.硫化锌精矿空气氧化硫酸浸出的动力学研究[J].有色金属:冶金部分,2008(1):7-10. Xiao Chun,Yang Shenghai.Leaching kinetics of zinc sulfide concentrate with air-oxidation and sulfuric acid[J].Nonferrous Metals:Smelting Part,2008(1):7-10.
[10] 畅永锋,翟秀静,符 岩,等.还原焙烧红土矿的硫酸浸出动力学[J].分子科学学报,2008,24(4):241-245. Chang Yongfeng,Zhai Xiujing,Fu Yan,et al.Sulphuric acid leaching kinetics of pre-reduced laterite ores[J].Journal of Molecular Science,2008,24(4):241-245.
(责任编辑 罗主平)
Kinetics Comparison of Oxidizing Acid Leaching and Conventional Acid Leaching of Indium Sulfide
Wei Yansong1Li Xuanhai2Ma Chen2
(1.CollegeofChemistryandBiologicalEngineering,HechiUniversity,Yizhou546300,China;2.CollegeofChemistryandChemicalEngineering,GuangxiUniversity,Nanning530004,China)
Kinetics of indium sulfide leaching under different conditions was investigated,in order to improve the leaching rate of indium sulfide fundamentally,by starting with the change law of grain parameter,apparent activation energy and reaction order of conventional acid leaching,potassium permanganate & hydrogen peroxide oxidizing acid leaching of indium sulfide.The results showed that:①The apparent activation energy,reaction order and crystalline parameter of the leaching reaction of indium sulfide were 35.6 kJ/mol,0.770,0.576 respectively under conventional acid leaching conditions,13.9 kJ/mol,0.390,0.366 under potassium permanganate oxidizing acid leaching and 17.5 kJ/mol,0.220,0.466 under hydrogen peroxide oxidizing acid leaching;②Indium leaching rate in conventional acid leaching was more sensitive to changes of leaching temperature and initial concentration of sulfuric acid,while for oxidizing acid leaching,the apparent activation energy and reaction order were significantly reduced,chemical activity significantly enhanced and the reaction rate was accelerated,the sensitivity of temperature and initial concentration of sulfuric acid on the influence of indium leaching was reduced;③The kinetics model of indium sulfide of conventional leaching and oxidation leaching fit Avrami equation well at n<1.Conventional leaching was controlled by both diffusion and reaction of chemistry,and the oxidation leaching process was controlled by diffusion.Therefore,intensive stir diffusion could increase the indium leaching rate.
Indium sulfide,Conventional leaching,Oxidation leaching,Kinetics model,Avrami equation
2013-12-09
国家自然科学基金项目(编号:51064002),广西教育厅科研项目(编号:201010LX486)。
韦岩松(1964—),男,副教授,硕士。
TD925.6,TD926.4
A
1001-1250(2014)-03-165-06

