染料敏化太阳能电池的研究进展
张云峰,刘 涛,薛慧玲,孙俊梅,李红梅
(成都学院(成都大学)生物产业学院,四川成都610106)
1 染料敏化太阳能电池的结构
太阳能是一种取之不尽、用之不竭的清洁能源,如何有效地将太阳能转化为电能或其他可利用的能源是物理和化学界的重大课题.其中太阳能电池是研究的热点项目,目前发展最成熟的是硅基太阳能电池,该类型电池实验室光电转换效率已接近25%,与理论值的29%非常接近.但是它对材料的纯度要求较高,制作工艺复杂,成本昂贵,这极大地限制了它的广泛应用.1991年,瑞士洛桑高等工业学院的 M.Grätzel小组[1]报道了染料敏化纳米太阳能电池(DSSCs)的光电转化效率为7.1%,由于其具有制造成本较低、制作工艺较简单、光电转化效率相对较高等优点,迅速成为研究热点.近年来,许多研究者致力于改进这类电池的光伏性能和稳定性,经过十多年的努力,现在的光电转化效率已经超过12%.
染料敏化太阳能电池是典型的“三明治”结构[2],由光阳极(通常为透明导电基底、纳米多孔半导体)、敏化染料、氧化还原电解质(通常为I-/I3-)以及对电极(Pt电极)组成,其构造和原理如图1所示.工作原理如下:
1)当太阳光照射在染料敏化太阳能电池上,染料分子中基态电子被激发(S+hv→S*);
2)激发态染料分子将电子注入到纳米多孔半导体的导带中,自身转化成氧化态染料,

3)由于染料的氧化还原电位高于氧化还原电解质电对的电位,这时处于氧化态的染料分子随即被还原态的电解质还原,即氧化态染料被电解质中的I-还原回基态,I-转化成I3-,此过程称为染料的再生或还原(3I-+2S+→I3-+2S);
4)注入到导带中的电子迅速富集到导电玻璃面上,传向外电路,并最终回到对电极上,然后氧化态的电解质扩散到对电极上得到电子再生(I3-+2e-(Pt)→3I-);如此循环下去,即产生电流.电池的最大电压是由氧化物半导体的费米能级和氧化还原电解质电对的电位决定的.另外,还伴随着两个暗电流的产生过程;
5)注入导带中的电子与氧化态染料间的电荷复合的过程,与过程3)中染料的再生存在竞争(S++e-→S);
6)注入到纳米多孔半导体的导带中的电子与电解液I3-的电荷复合,在此称为暗电流(I3-+2e-→3I-).
由以上循环过程可知:5)和6)在太阳能电池光电转换过程中导致其效率降低,抑制这2个过程是提高电池转换效率的行之有效的途径.
此外,DSSCs光阳极上的半导体材料多采用纳米多孔TiO2,它是染料分子的载体,同时分离并传输电荷,因此以下2项也可以提高电池转换效率:
(i)寻找制备半导体光阳极薄膜,增大TiO2比表面积和改善TiO2表面活性;
(ii)由于电子在TiO2薄膜中的传输阻力大,影响电池转换效率的进一步提高,故可寻找可以替代TiO2的其他半导体材料.
染料敏化太阳能电池的性能参数主要有以下几项指标来衡量DSSCs的性能:开路电压Voc、短路电流Jsc、填充因子(FF)、单色光光电转换效率(IPCE)、能量转换效率(η)等.
2 染料敏化剂
染料敏化剂是太阳能电池的关键部分,起着吸收可见光并提供电子的作用.高性能的染料敏化剂应具有以下特点[3-5]:
1)染料敏化剂能紧密地吸附在半导体表面上;
2)染料敏化剂尽可能地在紫外-可见光区,甚至部分近红外区有强的吸收;
3)染料敏化剂的禁带宽度需要比半导体薄膜的禁带宽度窄;
4)染料敏化剂的氧化态电位要比半导体的导带电位低,其还原态电位要比氧化还原电解质的电位高;
5)染料敏化剂的基态、激发态和氧化态应具备良好的光、电化学稳定性和热稳定性.
基于以上要求,染料敏化剂研究的工作集中在如下2个方面:一是合成和发展光谱响应范围更宽、成本更低、效率更高、稳定性更好的染料敏化剂;二是研究多种染料的协同敏化作用,拓宽光谱响应范围.
染料敏化剂按其结构中有无金属可分为无机染料敏化剂和有机染料敏化剂两大类.无机染料光敏化剂研究最多的是钌配合物.目前被广泛研究和应用的主要染料有:多吡啶钌配合物、卟啉类金属配合物、酞菁类金属配合物,香豆素类、多烯类、芴类、咔唑类、吲哚啉类、三苯胺类有机染料.
2.1 金属配合物染料
2.1.1 多吡啶钌配合物染料 多吡啶钌配合物具有较高的热稳定性和化学稳定性.是目前公认的应用于DSSCs中性能最为优异的一类敏化染料,它们在可见光区具有很宽的吸收光谱,同时具有较为合适的基态和激发能级,如图2所示.

图2 几种钌配合物染料的结构Fig.2 Molecular structures of ruthenium complexes
1993 年,M.Grätzel研究小组[6]报道了一系列羧酸联吡啶钌配合物敏化染料N3(1),N3(1)染料两个联吡啶环上的羧基与半导体氧化物形成电子耦合,增加了电子的注入效率,相应的光电能转换效率达到10%,但在光的长波区缺乏吸收.
2001 年 M.Grätzel等[7-8]合成了 1 种全吸收的黑染料(Black Dye)N749(2),配体是三联吡啶,共轭体系增大,该染料在整个可见光范围内都有较好的吸收,其IPCE达到了80%,在AM 1.5太阳光照射下其光电转换效率为10.4%.
2005 年,M.Grätzel等[9-10]还报道了联吡啶钌配合物N719(3),它是N3(1)的2个四丁基铵盐,四丁基铵基团可以有效地抑制暗电流,光电转换效率达到了11.18%.
由于以上3染料都存在不稳定、脱吸附的问题.为克服这个缺点,M.Grätzel等[11-12]将烷基链引入联吡啶环中合成了以Z907(4)为代表的两亲性染料敏化剂,由于此染料既具有亲水性的羧基又具有疏水性的烷基,其疏水基能在TiO2电极表面形成自组装层,减少了电极表面与电解质的接触,降低了暗电流的产生,提高了短路电流,其短路电流Jsc=14.6 mA/cm2,开路电压Voc=722 mV,填充因子FF=0.693,光电转换效率η=7.3%.另外,此类染料能够牢固地吸附在TiO2电极的表面,具有良好的热稳定性,可以在80℃条件下稳定工作1 000 h.
2005年,C.Klein等[13]在羧基与联吡啶之间加入烯键得到染料K8,K8与N3(1)相比,摩尔消光系数提高了30%,基于K8的电池总效率达到了8.64%.由于双键的引入使分子共轭体系增大,致使光电响应范围明显红移和拓宽.通过增加配体的共轭体系长度以增大染料的摩尔吸光系数.
2005年,P.Wang等[14-15]在共扼体系外引入烷基链以增加染料一端的疏水性,得到染料K19,同时,在联吡啶疏水配体上接入甲氧基后,得到了热稳定性强及总光电转换效率达10.2%的Z910(5).
2008年,P.Wang等[16]人在联吡啶上分别引入更加富电的电子供体取代基(噻吩、呋喃、噻吩并噻吩、呋喃并噻吩)合成了一系列高摩尔吸光系数的杂环多吡啶钌配合物染料(C101~C107).
C101的IPCE在480~660 nm光谱范围内超过80%,最大吸收峰达到547 nm,最大摩尔消光系数也大大提高.在模拟AM 1.5,100 mW/cm2的光照下,在乙腈为溶剂的液体电解质中,光电转换效率达到了 11.3%(Jsc=17.94 mA/cm2,Voc=777 mV,FF=0.79)[16].C103 在 60 ℃ 条件下,电池分别在甲氧基丙腈(效率为9.6%)和无溶剂离子液体(效率为8.5%)2种电解质中经过1 000 h的稳定性测试后,效率仍然可达以前的90%以上[17].C104染料在实现吸收波长的红移的基础上提高吸光系数,在AM 1.5光照下,达到11.53%的光电转换效率[18].C106染料在标准AM 1.5的模拟光照下,达到12%的光电转换效率[19].
虽然多吡啶钌络合物性能优异,但由于多吡啶钌类染料的合成复杂,钌属于贵重的稀有金属,价格相对较高,易对环境遭成破坏,因此限制了此类染料的应用.寻找其他合成容易,可降低太阳能电池低成本、经济性更强的染料成为人们研究的方向.
2.1.2 锌卟啉类配合物染料 卟啉化合物广泛存在于自然界中,在植物叶绿素进行光合作用中扮演着捕获光能并迅速将其转化为化学能的重要角色,它是由4个吡咯通过4个次甲基连接而成的具有芳香性的大环平面结构.具有18电子共轭的大环平面结构,使得其在近紫外区和可见区能有效的吸收太阳能.卟啉类化合物通常在400~500 nm波段呈现强烈的B带(Sore带)吸收,在500~700 nm波段呈现相对较弱的 Q带(Q-band)吸收[20].因此很适合在DSSCs中用作全谱响应的染料敏化剂[21].它同时具有较好的光热稳定性、化学稳定性、较高的摩尔吸光系数、较好的吸收光谱和较高的光电转换效率.卟啉类配合物还具备特殊的电子结构和光电性能,设计和合成新型卟啉类配合物已成为染料敏化太阳能电池研究的热点,如图3所示.

图3 卟啉染料的分子结构Fig.3 Molecular structures of porphyrin dye sensitizers
早在 1993 年,M.Grätzel等[22]报道的铜卟啉化合物6,该敏化剂IPCE达到80%,光电转换效率为2.6%,该染料的2个羧基可以很好地吸附于TiO2表面,利于电子的传输.后来,S.Cherian 等[23]报道了四羧酸取代卟啉.由于该卟啉的4个羧基都在同一个平面上,不能同时与TiO2表面相连,这使得电子注入效率下降.该染料不含任何金属离子的卟啉染料,IPCE达到了55%,光电转化效率为3.0%.
2004年,M.K.Nazeeruddin 等[24]合成了含有不同吸附基团的锌卟啉化合物,在卟啉β位连接拉电子基团作为电子注入端,这样可以拓展共轭体系并增加吸附基团,强化电子转移能力,其中制得的染料的IPCE达到了75%,光电转化效率达4.8%.这开辟了卟啉染料研究的新方向.
2005 年,Q.Wang[25]等报道了一种含有氰基丙烯酸基团的锌卟啉7,用此染料制作的电池的IPCE达85%,光电转换效率达到5.6%(Jsc=13.0 mA/cm2,Voc=610 mV,FF=0.70).2007 年,W.Campbell等[26]报道了对甲苯基取代的锌卟啉染料敏化剂,该分子采用反丁二烯共轭桥连接卟啉大环与羧酸锚定基团,在模拟太阳光照射下,光电转换效率达到了7.1%(Jsc=14.0 mA/cm2,Voc=680 mV,FF=0.74).
Y.J.Lin等[27]报道了含有氰基乙酸的锌卟啉化合物,其中卟啉作为电子给体,噻吩和乙烯键作为共轭链,氰基乙酸作为电子受体和吸附基团,该染料的光电转化效率达到5.2%,最大的IPCE值为72%.
2010年,H.Imahori等[28]合成了结构相似的锌卟啉配合物,其中的光电转换效率达到了6.5%.Y.C.Chang等[29]报道了一种新型的锌卟啉染料敏化剂8,其能量转换效率达到了10.17%.
2010 年,M.Grätzel等[30]合成了具有推拉电子(D-π-A)结构的锌卟啉YD-2(9),以二芳胺作为电子给体,卟啉作为π共轭体系桥,炔基苯甲酸作为电子受体.在AM 1.5光照条件下,Jsc=18.6 mA/cm2,Voc=770 mV,FF=0.764,光电转换效率达到11%.随后,M.Grätzel等对染料YD-2进一步优化,将与卟啉环相联的苯环上的叔丁基改为烷氧基.
2011 年,A.Yella等[31]合了染料 YD2—O—C8(10),用Co(II/III)三(联吡啶)为电解液,在 AM 1.5光照条件下,将染料YD2—O—C8和有机染料Y123共敏化,光电转化效率已达到12.3%.
锌卟啉敏化剂转换效率已经取得了很大的发展,但比起钌染料来说,锌卟啉染料还存在光谱比较窄、热稳定性不足,光吸收强度不够等问题.因此,需要寻找化学及热稳定性较高,光吸收强且光谱响应范围宽的卟啉染料,或者将卟啉与其他染料进行共敏化以获得较高的光电转换效率.
2.1.3 锌酞菁类配合物染料 酞菁又叫四氮杂卟啉,是一种具有18个电子的大共轭体系的化合物.它在可见光区(600~800 nm)具有很强的吸收,具有很好的光、电化学和热力学稳定性.由于在有机溶剂中溶解性较差,易在二氧化钛表面堆积,电子的方向性不好,所以不能有效的注入到二氧化钛表面,导致染料电池的效率较低.如图4所示.

图4 酞菁染料的分子结构Fig.4 Molecular structures of phthalocyanine dye sensitizers
2007 年,M.Nazeeruddin[32]合成了不对称锌酞菁11,该酞菁的3个叔丁基作为供电基团,酞菁作为π共轭体系桥,羧酸作为电子受体,具有推拉电子(D-π-A)结构,有利于电子的转移,同时,叔丁基能提高分子的溶解性,抑制分子的堆积,提高了电子的迁移效率.
以该染料作为敏化剂获得IPCE达到75%,总光电转换效率为 3.05%.同年,M.Grätzel等[33]合成了12,在700 nm处的IPCE达到80%,总光电转换效率为3.50%.
2011 年,S.Mori等[34]合成了 13,引入了较大的基团,避免了酞菁平面之间的共轭堆砌,该染料不会在TiO2表面的堆积.使其光电转换效率达到4.6%.
锌酞菁类配合物的IPCE较低,提高转换效率就需要改善溶解性和防止堆积,合成难度大,电子导向性差等特点导致酞菁在DSSCs方便的应用受到很大的限制.
由于其他金属卟啉或酞菁敏化剂相对于锌配合的卟啉或酞菁敏化剂的转换效率比较低,所以人们对它们研究的相对较少,具体原因还有待研究.
2.2 纯有机敏化染料纯有机染料不含中心金属离子,成本较低,吸光系数高,环境友好,分子结构多样化,便于进行结构设计以满足对不同波长光的有效吸收,逐渐成为一类很有潜力的光敏染料.
纯有机染料分子具有推拉电子(D-π-A)结构:分子由电子给体(Donor),π-共轭桥(π-Conjugated),电子受体(Acceptor)三部分构成[35],如图5所示.

可以通过对电子给体(Donor),π-共轭桥(π-Conjugated),电子受体(Acceptor)进行独立修饰,进而设计和合成出一系列的新型敏化染料子.其中电子给体(Donor)部分一般为含有富含电子基的香豆素、吲哚、咔唑、芴和三苯胺等,电子受体(Acceptor)部分一般为含有吸电子基的羧酸(—COOH),磷酸(—PO3H)、磺酸(—SO3H)等基团作为锚定基,以便于染料分子能够牢固的吸附在TiO2表面,有利于电子的注入.经过几年的发展,纯有机染料已经发展出包括香豆素类、咔唑类、吲哚类、芴类、三苯胺类在内的多种光敏染料.
2.2.1 香豆素类染料 香豆素基团具有较大的共轭平面和良好的供电子能力,在染料敏化太阳能电池中是一类很好的染料敏化剂,如图6所示.
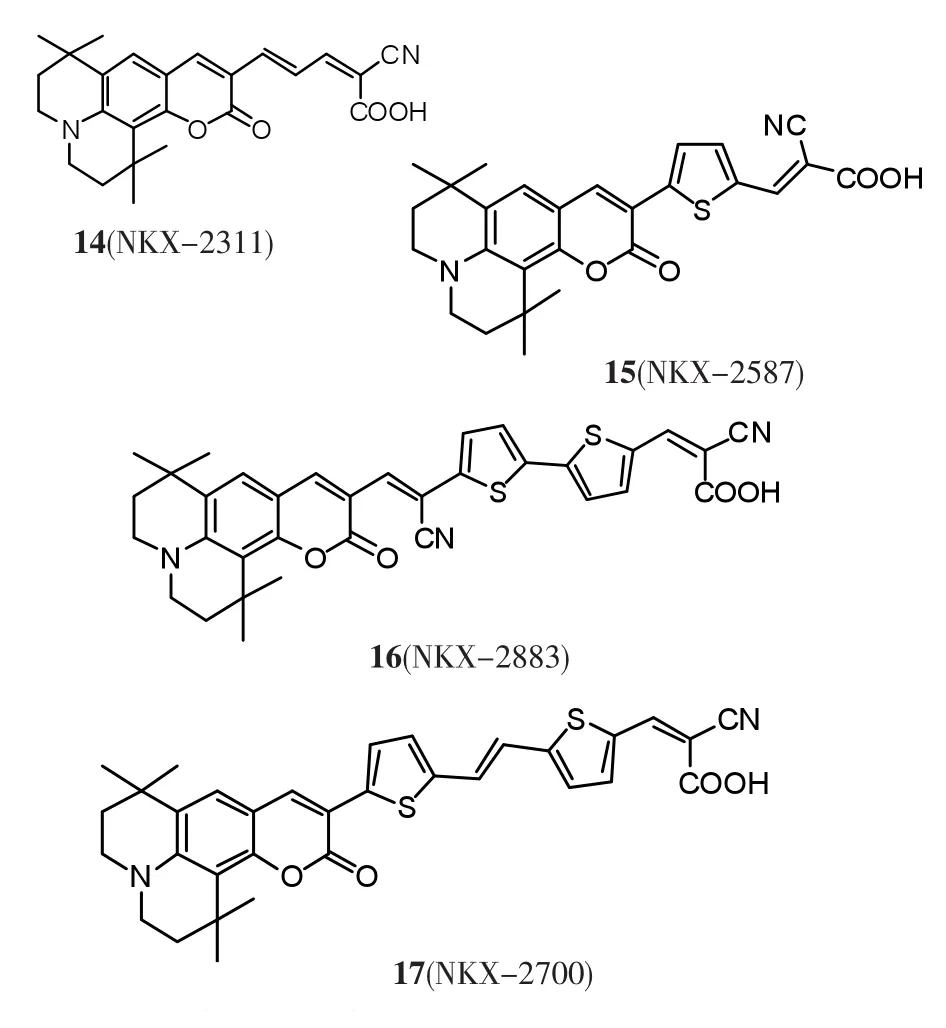
图6 香豆素类染料敏化剂分子结构Fig.6 Molecular structures of coumarin dye sensitizers
2001年,K.Hara等[36]对香豆素 C343进行了结构上的修饰,通过增加双键延长π-共轭桥和引入吸电子能力更强的氰基作为电子受体制得了染料NKX-2311(14),把该染料应用于 DSSCs,在460~600 nm的范围内IPCE值大于70%,470 nm处的最大IPCE为80%,取得了5.6%的光电转换效率 (Jsc=13.8 mA/cm2,Voc=630 mV,FF=0.63)[37].继续延长共轭体系得到的 NKX-2856,其光电响应进一步拓宽至近红外光区820 nm处,但IPCE值降低,总的光电转换效率也不高,说明共轭体系不能一味延长[36].
2003 年,K.Hara 等[38]在 NKX-2311(14)基础上,通过引入噻吩基团来制备了一系列新的染料分子,得到了吸收光谱更宽的光敏染料NKX-2587(15)、NKX-2593[39]、NKX-2677、NKX-2697,其中,NKX-2677(15)表现出良好的光电性能稳定性,光电转换效率达到了7.7%(Jsc=14.3 mA/cm2,Voc=730 mV,FF=0.74).
2007 年,Z.S.Wang等[40]报道了在染料 NKX-2677分子的π桥中增加一个氰基官能团能使染料的吸收光谱范围增大,拓宽到近红外区的香豆素染料NKX-2883(16),其敏化的DSSCs持续光照1 000 h后,仍表现很好的光热稳定性,光电转换效率保持在6.0%左右.同年,他们又报道了NKX-2700(17)[41],在 AM 1.5 的光照下光电转换效率达到8.2%.
香豆素基团具有大共轭平面和良好的供电子能力,是一类很好的染料敏化剂,但是较好的平面性导致其易于堆积,进而阻碍电流的传递,致使光电转换效率不高.
2.2.2 三苯胺染料 三苯胺是一种非平面的三围空间结构,具有强供电子能力的芳胺.三苯胺基团的非平面性,能够有效抑制染料分子的聚集,从而使其氧化态寿命较长,光电化学性质较好,如图7所示.
2004年,T.Kitamura等[42]首次报道了具有 D-π-A结构的三苯胺染料.以三苯胺作为给电子基团,乙烯基作为共轭桥键,氰基乙酸作为电子受体,其中18其光电转换效率达到了5.3%.
2006 年,D.P.Hasberg等[43]以三苯胺作为电子给体,噻吩乙烯作为共轭桥键,氰基乙酸基作为吸电子基合成了染料19.在模拟太阳光照射下,光电转换效率达到5.1%(Jsc=11.9 mA/cm2,Voc=660 mV,FF=0.68).
2007年,S.Y.Hwang等[44]将 19 中的噻吩换成苯环,合成的染料的光电转换效率达到9.1%(Jsc=18.1 mA/cm2,Voc=743 mV,FF=0.67).后来,作者往分子中引入更多的给电子基团以拓宽分子的吸收范围,2007 年,D.Hagberg等[45]通过在三苯胺上引入给电子基,合成了一系列的染料,发现甲氧基的引入能有效地提高染料的效率,其中化合物20的光电转换效率达7.0%(Jsc=13.5 mA/cm2,Voc=744 mV,FF=0.70).
2009年,P.Wang等[46]利用正己烷氧基三苯胺基团作为电子供体,并二噻吩和3,4-二氧乙烯噻吩单元作为π-共轭桥,氰基乙酸作为吸电子基,合成了染料 C206、C211、C217(21).基于 C217(21)的电池在400~700 nm范围内,其IPCE超过90%,在AM 1.5的光照条件下,在乙腈作为溶剂的电解质中,光电转换效率达到9.8%(Jsc=16.1mA/cm2,Voc=803 mV,FF=0.76).在离子液体电解质中,也获得了8.1%的光电转换效率.

图7 三苯胺染料敏化剂分子结构Fig.7 Molecular structures of triphenylamine dye sensitizers
2010年,P.Wang等[47]以支链烷氧基三苯胺基团作为电子供体,合成了以4,4-二己基取代的硅杂环戊二烯并二噻吩为π共轭桥的具有高摩尔吸光系数和宽吸收光谱的染料分子C219(22),在AM1.5的光照条件下,以乙腈为溶剂电解质的DSSCs中,光电转换效率达到10.1%(Jsc=17.94 mA/cm2,Voc=770 mV,FF=0.73).
2011年,B.S.Chen等[48]在 π 共轭桥中引入氟取代苯,合成了染料23.由于氟苯与腈基乙酸的共轭效应,染料23与TiO2的吸附力得到了加强.在1.5 AM光强下,基于乙腈的液态电解质中,光电转换效率达到8.22%.
2011年,P.Wang等[49]合成了氟代二噻吩并环戊二烯染料分子,由于该染料在TiO2表面的堆叠比较严重,导致光电转换效率只有5.6%,而以乙基取代的二噻吩并环戊烷染料在AM 1.5的光照条件下,光电转换效率达到8.0%.后来,P.Wang等[50]在环戊烷并二噻盼基团上引入二己基,合成了染料C229(24),在AM 1.5光强下,光电转换效率达到8.22%(Jsc=15.31 mA/cm2,Voc=580 mV,FF=0.73).
J.T.Lin等[51]合成以呋喃为π-共轭桥的染料,在标准光照下,呋喃为桥链的染料的电池效率为7.36%.P.Wang等[52]合成了以呋喃并呋喃为π-共轭桥的染料,在液态电解质中得到的光电转换效率为7.27%.
2011 年,E.Kozma等[53]报道了在三苯胺染料体系引入丁基基团,合成出染料分子如图7中的25和26,其光电转效率分别为7.17%和6.27%.
三苯胺具有强供电子能力,平面性较差,能够有效抑制染料分子的聚集,但是热稳定性较差,进而限制了进一步的应用.
2.2.3 芴类染料 芴类染料是由韩国Ko教授课题组首次合成而来的,以二甲基芴苯胺作为给电体,噻吩共轭桥键,氰基乙酸作为电子受体,由于二甲基芴苯胺分子的非平面性使得芴这类染料能够有效抑制分子的聚集,具有光稳定性和热稳定性,能够得到较高的光电转换效率.如图8所示.
2006年,S.Kim 等[54]首次报道了 JK-1(27)和JK-2(28)染料,以染料JK-1(27)、JK-2(28)制作的电池的光电转换效率分别为7.2%和8.0%(Jsc=14.0 mA/cm2,Voc=753 mV,FF=0.77).
2007 年,H.Choi等[55]将苯并噻吩引入分子中作为共扼连接桥,合成了染料分子JK-16和JK-17.以JK-16组装DSSCs,其光电转换效率达到7.4%.
后来,H.Choi等[56]在此基础上以苯并噻吩和正己烷噻吩作为共扼连接桥,制备了染料JK-45(29)和JK-46(30),烷基链的引入可以减少注入电子和I3-的复合,并抑制了分子的聚集.在乙腈电解质体系中,基于JK-45(29)和JK-46(30)为电池的光电转换效率分别达到7.4%和8.6%(Jsc=17.45 mA/cm2,Voc=664 mV,FF=0.74).2010 年,该课题组通过修饰JK-46(30)分子得到染料JK-113[57],该染料即延长共轭又链增加了分子的疏水性,以JK-113组装DSSC,在乙腈电解质体系中,光电转换效率达9.1%.K.Lim等[58]合成了JK-225光电转换效率到达8.2%.

图 8 芴染料敏化剂分子结构Fig.8 Molecular structures of flurene dye sensitizers
2008 年,M.K.Wang等[59]以二甲基芴苯胺作为给电体,并二噻吩为共扼连桥,合成了染料C201(31),其光电转换效率可达8.0%,接着又以并三噻吩为共扼连桥,合成了染料 C203(32)[60],基于C203(32)的电池在410~590 nm范围内,其IPCE超过80%,在AM 1.5的光照条件下,液体电解质中,光电转换效率达到8.0%(Jsc=14.3 mA/cm2,Voc=734 mV,FF=0.76).
2009年,M.F.Xu 等[61]以富电的 3,4- 二氧乙烯噻吩作为共扼连接桥,合成了染料C204和C205,基于C204,C205的电池中,其光电转换效率分别为7.9%和8.3%.基于染料C205的离子液体电解质电池在60℃标准光强下持续照射1 000 h后,电池效率仍能保持原有的92%.
芴类染料的非平面性使其能够有效抑制分子的聚集,具有光稳定性和热稳定性,能够得到较高的光电转换效率,与三苯胺染料同样存在热稳定性差等问题.
2.2.4 吲哚啉类染料 吲哚啉染料是一种应用于染料敏化太阳能电池的高效光敏染料,比三苯胺更强的给电子能力,以吲哚啉为给电子基,绕丹宁乙酸基为吸电子基,如图9所示.
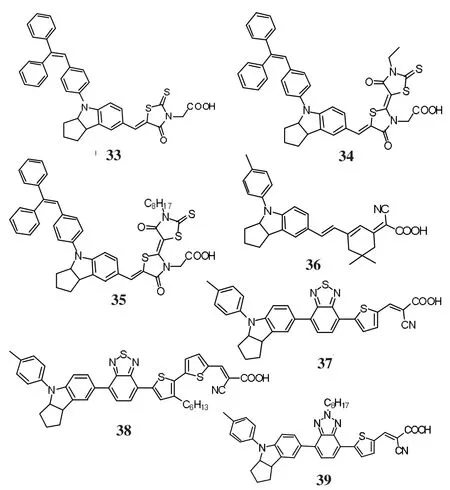
图9 吲哚类染料分子结构Fig.9 Molecular structures of indoline dye sensitizers
2003 年,T.Horiuchi等[62]首次报道了 N- 芳基吲哚啉的系列敏化染料33,在AM 1.5的光照条件下,光电转换效率达到6.1%.
2004 年,T.Horiuchi等[63]对(33)进行改进和优化,设计出另一种吲哚啉染料34,以34为染料的电池在350~650 nm范围内,其IPCE超过80%,在AM 1.5的光照条件下,光电转换效率达到8.0%(Jsc=18.5 mA/cm2,Voc=693 mV,FF=0.63).
2006 年,M.Grätzel等[64]通过优化 TiO2纳米薄膜厚度后,使得34染料制作的电池的光电转换效率达到9.0%.
2008 年,M.Grätzel等[65]将饶丹宁酸受体的乙基改为辛烷基,合成了染料35,分子中的长烷基链能有效地阻止TiO2中的电子和电解质的复合,从而提高开路电压,光电转换效率最高达到9.52%(Jsc=18.56 mA/cm2,Voc=717 mV,FF=0.72).35是目前光电转换性能可与Ru(II)多吡啶配合物相媲美的少数几个有机光敏染料之一.
2009 年,B.Liu 等[66]设计以吲哚啉为给体,异佛尔酮为π共轭桥,氰基乙酸作为吸电体,合成了染料36,基于36的电池在430~600 nm范围内,其IPCE超过80%,在AM 1.5的光照条件下,液体电解质中,光电转换效率达到7.4%(Jsc=18.6 mA/cm2,Voc=634 mV,FF=0.63).
2011年,W.H.Zhu等[67]将苯并噻二唑联苯和苯并噻二唑联噻吩作为π共轭桥,氰基乙酸作为吸电基团,合成了37.缺电基团单元苯并噻二唑的引入拓宽了染料的光谱吸收范围,37光电转换效率达到8.7%(Jsc=17.7 mA/cm2,Voc=650 mV,FF=0.76).
2012 年,Y.Z.Wu 等[68]在噻盼环上引入长烷基链,合成了染料38,分子中的长烷基链能有效地阻止染料在TiO2表面聚集,提高开路电压,其光电转换效率为9.04%.
2011年,Y.Cui等[69]把苯并三氮唑联噻吩引入分子中,合成了染料39,该分子中的长烷基链能有效地阻止TiO2中的电子和电解质的复合即暗电流的发生,从而提高开路电压,其光电转换效率高达8.02%(Jsc=13.18 mA/cm2,Voc=780 mV,FF=0.78).
此外,D.Kim等[70]以二甲基芴取代吲哚啉给电子体,以联噻吩作为π共轭桥,氰基乙酸作为电子受体,合成了系列吲哚啉染料JK-51,在AM 1.5标准太阳光下的光电转换效率为8.4%.吲哚啉给电子能力较强,但是结构修饰有限,且绕丹宁乙酸基吸电子基合成较难,稳定性较差.
2.2.5 咔唑类染料 咔唑类染料也是近年来研究较多的一种染料,如图10所示.
2006年,N.Koumura等[71]合成了以咔唑为电子供体,寡聚噻吩作为π共轭桥,氰基乙酸作为电子受体,合成了40等3种染料.通过在噻吩基团上引入长烷基链能有效地阻止TiO2中的电子和电解质的复合,提高电子寿命,同时,能有效地阻止染料在TiO2表面聚集.在AM 1.5的光照条件下,基于染料40的电池的总转换效率达到8.3%(Jsc=14.0 mA/cm2,Voc=740 mV,FF=0.74)[72].2009 年,N.Koumura等[73]在咔唑上引入供电基团烷氧基苯,合成了41,基于染料41的电池的总转换效率达到8.1%.
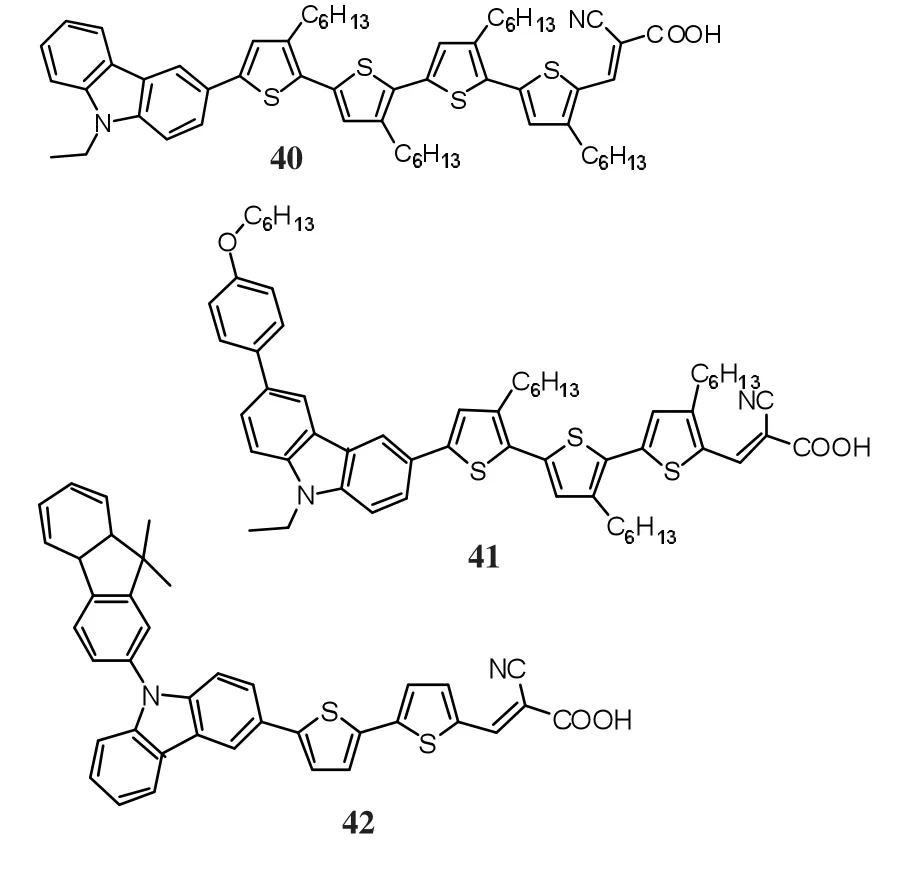
图10 吲哚类染料分子结构Fig.10 Molecular structures of carbazole dye sensitizers
D.Kim等[74]以二甲基芴取代咔唑为供电体,联噻吩作为π共轭桥,合成了42,电池的总转换效率达到 5.2%(Jsc=11.5 mA/cm2,Voc=680 mV,FF=0.66),咔唑染料能够有效抑制分子的聚集,具有光稳定性和热稳定性,能够得到较高的光电转换效率.
3 总结与展望
能源问题已成为社会经济发展的全球性问题,开发新型清洁、可持续能源已经成为能源研究的重要课题.太阳能作为最具发展潜力的再生能源,已成为当前开发新能源的热点.染料敏化太阳电池制备工艺简单,制造成本低廉,在生产过程中消耗少、污染低,受到了人们的广泛重视.
对染料敏化太阳能电池来说,目前,还存在着一些问题:
1)敏化剂的吸收谱带大都集中在400~650 nm,近红外乃至红外区域的太阳光利用率不高;
2)染料分子易于聚集,激发态的电子寿命较短,限制了电子的传输;
3)目前缺少高效率,高稳定性的电解质.展望未来的染料敏化太阳能电池发展,本文以为主要从以下几个方面获得突破:
(i)设计出既能在可见光,又能在近红外乃至红外区域的都具有良好吸收的宽吸收敏化剂,也就是吸收光谱红移的化合物,尽量充分利用吸收再500~700 nm的光能;
(ii)通过引入大的基团和支链设法破坏分子的平面性,使分子扭曲以克服分子的聚集;
(iii)由于电子在TiO2薄膜中的传输阻力大,影响电池转换效率的进一步提高,故寻找可以替代TiO2的其他半导体材料,比如导带和价带位置都与TiO2很接近的ZnO也被看好,它同时还具有电子迁移率高,扩散快等优点,是最有希望应用与DSSCs的材料;
(iv)由于液态电解质在封装上的技术困难,人们开发了无机半导体体系的固态电解质、有机空穴传输材料和高分子电解液体系等.与液态电解质相比,固态染料敏化太阳能电池敏化剂的氧化还原电位,可以和空穴导体的工作函数更好的匹配,所以固态染料敏化太阳能电池获得的开路电压(Voc)值很高,可以达到接近1 V.以固态电解质取代液态电解液应用于染料敏化太阳能电池,可以提高和改善电池的长期稳定性.
(v)敏化的纳米晶电极是染料敏化太阳能电池的关键部分,其性能直接关系到太阳能电池的总效率.在制备技术方面,基于传统的刮涂制膜技术和逐层沉积制备技术,由于操作的复杂性和技术掌握的难度,是光阳极制备的瓶颈问题.丝网印刷技术由于其大面积制备的可操作性,是实现未来工业化不错的手段.
综上所述,燃料敏化太阳能电池已成为太阳能开发的重要发展方向,虽然目前还存在一些问题,但是可以预见,随着科学技术的发展,这些问题必将得到很好地解决,燃料敏化太阳能电池技术将会走向成熟,满足人们的需求.
[1]O'Regan B,Grätzel M.A low-cost high-efficiency solar cell based on dye-sensitized colloidal TiO2[J].Nature,1991,353:737-739.
[2]Ooyama Y,Harima Y.Molecular designs and syntheses of organic dyes for dye-sensitized solar cells[J].Eur J Org Chem,2009:2903-2934.
[3]Hara K,Wang Z S,Sato T,et al.Oligothiophene-containing coumarin dyes for efficient dye-sensitized solar cells[J].J Phys Chem,2005,B109:15476-15482.
[4]Hwang S,Lee J H,Park C,et al.A highly efficient organic sensitizer for dye-sensitized solar cells[J].Chem Commun,2007,4887-4889.
[5]Wang Z S,Koumura N,Cui Y,et al.Hexylthiophene-funcationalized carbazole dyes for efficient molecular photovoltaics:tuning of solar-cell performance by structural modification[J].Chem Mater,2008,20:3993-4003.
[6]Nazeeruddin M K,Kay A,Rodicio I,et al.Conversion of light to electricity by cis-X2bis(2,2'-bipyridyl-4,4'-dicarboxylate)ruthenium(II)charge-transfer sensitizers(X=Cl-,Br-,I-,CN-,and SCN-)on nanocrystalline titanium dioxide electrodes[J].J Am Chem Soc,1993,115(14):6382-6390.
[7]Nazeeruddin M K,Pechy P,Grätzel M.Efficient panchromatic sensitization of nanocrystalline TiO2films by a black dye based on a trithiocyanato-ruthenium complex[J].Chem Commun,1997(18):1705-1706.
[8]Nazeeruddin M K,Pechy P,Renouard T,et al.Engineering of efficient panchromatic sensitizers for nanocrystalline TiO2-based solar cells[J].J Am Chem Soc,2001,123(8):1613-1624.
[9]Nazeeruddin M K,Splivallo R,Liska P,et al.A swift dye uptake procedure for dye-sensitizied solar cells[J].Chem Commun,2003,12:1456-1457.
[10]Nazeeruddin M K,Angelis F D,Fantacci S,et al.Combined experimental and DFT-TDDFT computational study of photoelectrochemical cell ruthenium sensitizers[J].J Am Chem Soc,2005,127:16835-16847.
[11]Wang P,Zakeeruddin S M,Moser J E,et al.A stable quasi-solid-state dye-sensitized solar cell with an amphiphilic ruthenium sensitizer and polymer gel electrolyte[J].Nat Mater,2003,2:402-407.
[12]Wang P,Zakeeruddin S M,Humphry-Baker R,et al.Molecular-scale interface engineering of TiO2nanocrystals:Im-prove the efficiency and stability of dye-sensitized solar cells[J].Adv Mater,2003,15:2101-2104.
[13]Klein C,Nazeeruddin M K,Liska P,et al.Engineering of a novel ruthenium sensitizer and its application in dye-sensitized solar cells for conversion of sunlight into electricity[J].Inorg Chem,2005,44(2):178-180.
[14]Wang P,Zakeeruddin S M,Moser J E,et al.Stable new sensitizer with improved light harvesting for nanocrystalline dye-sensitized solar cells[J].Adv Mater,2004,6(20):1806-1811.
[15]Wang P,Klein C,Humphry-Baker R,et al.A high molar extinction coefficient sensitizer for stable dye-sensitized solar cells[J].J Am Chem Soc,2005,127(3):808-809.
[16]Gao F F,Wang Y,Shi D,et al.Enhance the optical absorptivity of nanocrystalline TiO2film with high molar extinc-tion coefficient Ruthenium sensitizers for high performance dye-sensitized solar cells[J].J Am Chem Soc,2008,130(32):10720-10728.
[17]Shi D,Pootrakulchote N,Li R Z,et al.New efficiency records for stable dye-sensitized solar cells with low-volatility and ionic liquid electrolytes[J].J Phys Chem,2008,C112(44):17046-17050.
[18]Yu Q J,Wang Y H,Yi Z H,et al.High-efficiency dye-sensitized solar cells:the influence of lithium ions on exciton dissociation,charge recombination,and surface states[J].ACS Nano,2010,4(10):6032-6038.
[19]Gao F F,Wang Y,Zhang J,et al.A new heteroleptic ruthenium sensitizer enhances the absorptivity of mesoporous titania film for a high efficiency dye-sensitized solar cell[J].Chem Commun,2008,44(23):2635-2637.
[20]Lammi R K,Wagner R W,Ambroise A,et al.Mechanisms of excited-state energy-transfer gating in linear versus branched multiporphyrin arrays[J].J Phys Chem,2001,B105(22):5341-5352.
[21]Campbell W M,Burrell A K,Officer D L,et al.Porphyrins as light harvesters in the dye-sensitised TiO2solar cell[J].Coord Chem Rev,2004,248:1363-1379.
[22]Kay A,Grätzel M.Photosensitization of TiO2solar cells with chlorophyll derivatives and related natural porphyrins[J].J Phys Chem,1993,97(23):6272-6277.
[23]Cherian S,Wamser C C.Adsorption and photoactivity of tetra(4-carboxyphenyl)porphyrin(TCPP)on nanoparticulate TiO2[J].J Phys Chem,2000,B104(15):3624-3629.
[24]Nazeeruddin M K,Humphry-Baker R,Officer D L,et al.Application of metalloporphyrins in nanocrystalline dye-sensitized solar cells for conversion of sunlight into electricity[J].Langmuir,2004,20(15):6514-6517.
[25]Wang Q,Campbell W M,Bonfantani E E,et al.Efficient light harvesting by using green Zn-porphyrin sensitized nanocrystalline TiO2films[J].J Phys Chem,2005,B109:15397-15409.
[26]Campbell W,Jolley K,Wagner P,et al.Highly efficient porphyrin sensitizers for dye-sensitized solar cells[J].J Phys Chem,2007,C111(32):11760-11762.
[27]Lin Y J,Xiang N,Feng X M,et al.Thiophene-linked porphyrin derivatives for dye-sensitized solar cells[J].Chem Commun,2009,18:2499-2501.
[28]Imahori H,Matsubara Y,Iijima H,et al.Effects of meso-diarylamino group of porphyrins as sensitizers in dye-sensitized solar cells on optical,electrochemical,and photovoltaic properties[J].J Phys Chem,2010,C114(23):10656-10665.
[29]Chang Y C,Wang C L,Pan T Y,et al.A strategy to design highly efficient porphyrin sensitizers for dye-sensitized solar cells[J].Chem Commun,2011,47:8910-8912.
[30]Bessho T,Zakeeruddin S M,Yeh C Y,et al.Highly efficient mesoscopic dye-sensitized solar cells based on do-nor-acceptor-substituted porphyrins[J].Angew Chem Int Ed,2010,49(37):6646-6649.
[31]Yella A,Lee H W,Tsao H N,et al.Porphyrin-Sensitized Solar Cells with Cobalt(II/III)-Based Redox Electrolyte Exceed 12 Percent Efficiency[J].Science,2011,334:629-634.
[32]Reddy P Y,Giribabu L,Lyness C,et al.Efficient sensitization of nanocrystalline TiO2films by a near-IR absorbing unsymmetrical zinc phthalocyanine[J].Angew Chem Int Ed,2007,46:373-376.
[33]Cid J J,Yum J H,Jang S R,et al.Cosensitization for efficient panchromatic dye-sensitized solar cells[J].Angew Chem Int Ed,2007,46:8358-8362.
[34]Mori S,Nagata M,Nakahata Y,et al.Enhancement of incident photon-to-current conversion efficiency for phthalocyaninesensitized solar cells by 3D molecular structuralization[J].J Am Chem Soc,2010,132:4054-4055.
[35]Kim B G,Chung K,Kim J.Molecular sesign principle of all-organic dyes for dye-sensitized solar cells[J].Chem Eur J,2013,19:5220-5230.
[36]Hara K,Sayama K,Ohga Y,et al.A coumarin-derivative dye sensitized nanocrystalline TiO2solar cell having a high solarenergy conversion efficiency up to 5.6%[J].Chem Commun,2001,6:569-570.
[37]Hara K,Sato T,Katoh R,et al.Molecular design of coumarin dyes for efficient dye-sensitized solar cells[J].J Phys Chem,2003,B107(2):597-606.
[38]Hara K,Kurashige M,Dan-oh Y,et al.Design of new coumarin dyes having thiophene moieties for highly efficient organicdye-sensitized solar cells[J].New J Chem,2003,5:783-785.
[39]Hara K,Tachibana Y,Ohga Y,et al.Dye-sensitized nanocrystalline TiO2solar cells based on novel coumarin dyes[J].Energy Mater Sol Cells,2003,77(1):89-103.
[40]Wang Z S,Cui Y,Hara K,et al.A light-harvesting-efficiency coumarin dye for stable dye-sensitized solar cells[J].Adv Mater,2007,19:1138-1141.
[41]Wang Z S,Cui Y,Dan-oh Y,et al.Thiophene-functionalized coumarin dye for efficient dye-sensitized solar cells:electron lifetime improved by coadsorption of deoxycholic acid[J].J Phys Chem,2007,C111(19):7224-7230.
[42]Kitamura T,Ikeda M,Shigaki K,Phenyl-conjugated oligoene sensitizers for TiO2solar cells[J].Chem Mater,2004,16(9):1806-1812.
[43]Hagherg D P,Edvinsson T,Sun L,et al.A novel organic chromophore for dye-sensitized Nanostructured solar cells[J].Chem Commun,2006,21:2245-2247.
[44]Hwang S Y,Lee J H,Park C,et al.A highly efficient organic sensitizer for dye-sensitized solar cells[J].Chem Commun,2007,46:4887-4889.
[45]Hagherg D,Yum J,Lee H,et al.Molecular engineering of organic sensitzers for dye-sensitized solar cell applications[J].J AmChem Soc,2008,130(19):6259-6266.
[46]Zhang G,Bala H,Cheng Y,et al.High efficiency and stable dye-sensitized solar cells with an organic chromophore featuring a binary π -conjugated spacer[J].Chem Commun,2009,16:2198-2200.
[47]Zeng W,Cao Y,Bai Y,et al.Efficient dye-sensitized solar cells with an organic photosensitizer featuring orderly conjugated ethylenedioxythiophene and dithienosilole blocks[J].Chem Mater,2010,22(5):1915-1925.
[48]Chen B S,Chen D Y,Chen C L,et al.Donor-acceptor dyes with fluorine substituted phenylene spacer for dye-sensitized solarcells[J].J Mater Chem,2011,21:1937-1945.
[49]Zhou D F,Cai N,Long H J,et al.An energetic and kinetic view on cyclopentadithiophene dye-sensitized solar cells:The Influence of fluorine vs ethyl substituent[J].J Phys Chem,2011,C115:3163-3171.
[50]Bai Y,Zhang J,Zhou D,et al.Engineering of Organic Sensitizers for Iodine-Free Dye-Sensitized Solar Cells:a Red-Shifted Current Response Concomitant with an Attenuated Charge Recombination[J].J Am Chem Soc,2011,133(30):11442-11445.
[51]Lin J T,Chen P C,Yen Y S,et al.Organic dyes containing furan moiety for high-performance dye-sensitized solar cells[J].Org Lett,2009,11(1):97-100.
[52]Li R Z,Lv X J,Shi D,et al.Dye-sensitized solar cells based on organic sensitizers with different conjugated linkers:Furan,bifuran,thiophene,bithiophene,selenophene,and biselenophene[J].J Phys Chem,2009,C113(17):7469-7479.
[53]Kozma E,Concina I,Braga A,et al.Metal-free organic sensitizers with a sterically hindered thiophene unit for efficient dyesensitized solar cells[J].J Mater Chem,2011,21:13785-13788.
[54]Kim S,Lee J K,Kang S O,et al.Molecular engineering of organic sensitizers for solar cell application[J].J Am Chem Soc,2006,128:16701-16707.
[55]Choi H,Lee J K,Song K,et al.Novel organic dyes containing bis-dimethylfluorenyl amino benzo[β]thiophene for highly efficient dye-sensitized solar cell[J].Tetrahedron,2007,63:3115-3121.
[56]Choi H,Baik C,Kang S,et al.Highly efficient and thermally stable organic sensitizers for solvent-free dye-sensitized solar cells[J].Angew Chem Int Ed,2008,47(2):327-330.
[57]Choi H,Raabe I,Kim D,et al.High molar extinction coefficient organic sensitizers for efficient dye-sensitized solar cells[J].Chem Eur J,2010,16(4):1193-1201.
[58]Lim K,Kim C,Song J,et al.Enhancing the performance of organic dye-sensitized solar cells via a slight structure modification[J].J Phys Chem,2011,C115:22640-22646.
[59]Wang M K,Xu M F,Shi D,et al.High-performance liquid and solid dye-sensitized solar cells based on a novel metal-free organic[J].Adv Mater,2008,20(3):4460-4463.
[60]Qin H,Wenger S,Xu M,et al.An organic sensitizer with a fused dithienothiophene unit for efficient and stable dye-sensitized solar cells[J].J Am Chem Soc,2008,130(29):9202-9203.
[61]Xu M F,Wenger S,Bala H,et al.Tuning the energy level of organic sensitizers for high-performance dye-sensitized solar cells[J].J Phys Chem,2009,C113:2966-2973.
[62]Horiuchi T,Miura H,Uchida S.Highly-efficient metal-free organic dyes for dye-sensitized solar cells[J].Chem Commun,2003(24):3036-3037.
[63]Horiuchi T,Miura H,Sumioka K,et al.High efficiency of dye-sensitized solar cells based on metal-free indoline dyes[J].J Am Chem Soc,2004,126:12218-12219.
[64]Ito S,Zakeeruddin S,Humphry-Baker R,et al.High-efficiency organic-dye-sensitized solar cells controlled by nanocrystalline-TiO2electrode thickness[J].Adv Mater,2006,18:1202-1205.
[65]Ito S,Miura H,Uchida S,et al.High-conversion-efficiency organic dye-sensitized solar cells with a novel indoline dye[J].Chem Commun,2008(41):5194-5196.
[66]Liu B,Zhu W H,Zhang Q,et al.Conveniently synthesized isophorone dyes for high efficiency dye-sensitized solar cells:tuning photovoltaic performance by structural modification of donor group inDonor-7i-Acceptor system[J].Chem Commun,2009(13):1766-1769.
[67]Zhu W H,Wu Y Z,Wang S T,et al.Organic D-A-π -A solar cell sensitizers with improved stability and spectral response[J].Adv Funct Mater,2011,21:756-763.
[68]Wu Y Z,Marszalek M,Zakeeruddin S M,et al.High-conversion-efficiency organic dye-sensitized solar cells:mo-lecular engineering on D-A- π -A featured organic indoline dyes[J].Energy Environ Sci,2012,5:8261-8272.
[69]Cui Y,Wu Y Z,Lu X F,et al.Incorporating benzotriazole moiety to construct D-A-π-A organic sensitizers for solar cells:significant enhancement of open-circuit photovoltage with long alkyl group[J].Chem Mater,2011,23:4394-4401.
[70]Kim D,Song K,Kang M S,et al.Efficient organic sensitizers containing benzo[cd]indole:Effect of molecular isomerization for photovoltaic properties[J].J Photochem Photobiol,2009,A201(2/3):102-110.
[71]Koumura N,Wang Z S,Mori S,et al.Alkyl-functionalized organic dyes for efficient molecular photovoltaics[J].J Am Chem Soc,2006,128:14256-14257.
[72]Wang Z S,Koumura N,Cui Y,et al.Hexylthiophene-functionalized carbazole dyes for efficient molecular photovoltaics:tuning of solar-cell performance by structural modification[J].Chem Mater,2008,20(12):3993-4003.
[73]Koumura N,Wang Z S,Miyashita M,et al.Substituted carbazole dyes for efficient molecular photovoltaics:long electron lifetime and high open circuit voltage performance[J].J Mater Chem,2009,19(27):4829-4836.
[74]Kim D,Lee J K,Kang S O,et al.Molecular engineering of organic dyes containing N-aryl carbazole moiety for solar cell[J].Tetrahedron,2007,63(9):1913-1922.

