塔拉ISSR分子标记的遗传多样性1)
包松莲 李志国 张建云 郑书星
(中国林业科学研究院资源昆虫研究所,昆明,650224) (湖北钟祥市林业局)
塔拉(Caesalpinia spinosa Kuntze,Tara),属于苏木科(云实科)(Caesalpiniaceae),云实属(Caesalpinia L.)。常绿,具刺灌木或小乔木,原产南美洲,秘鲁的塔拉资源居世界各国之首,约占世界产量的80%[1]。我国无塔拉的自然分布,20世纪90年代初,中国林业科学研究院资源昆虫研究所从秘鲁引进,首先在云南易门县繁育成功,并推广至四川、贵州、广西、海南等省区。经过10 a多的探索发展,我国南方的干热、干暖河谷地区已有广泛栽培[2-3],所产塔拉豆荚的单宁含量在55%以上,多糖达 25%以上[4-5],能生产上百种广泛用于医药、化工、食品添加剂等的产品,和原产地所产质量不相上下,是一种珍贵的经济树种。由于其较高的经济价值和云南省的独特地理气候,塔拉在云南有较大的发展潜力,研究引种的塔拉资源的遗传多样性可以对其发展空间提供依据。
20世纪80年代以前,林木遗传育种多采用形态标记、细胞学标记、生化标记和同工酶标记等,这些标记都是基因表达型标记,不仅可利用的位点少,而且易受环境条件的影响。80年代开始,先后提出和使用了RFLP、RAPD、AFLP和SSR等DNA分子标记技术,这些技术都各有优缺点。而ISSR标记技术结合了RAPD标记技术和SSR标记技术的优点[6]。本研究采用ISSR分子标记技术研究塔拉遗传多样性,旨在探讨其DNA分子水平的变异和遗传多样性,从分子水平上为塔拉的种质资源收集和育种提供理论基础。
1 材料与方法
分别于昆明采集4个单株(KM1、KM2、KM3、KM4)、易门十街 7 个单株(M1、M2、M3、S1、S2、X1、X2)、易门占马田基地 18 个单株(ZZ1、ZZ2、ZZ4、ZZ5、ZL、Z5、Z7、Z8、Z9、Z10、Z11、Z12、Z15、Z21、Z22、Z24、Z26、Z1-20)、易门小绿汁 7 个单株(L1、L5、L6、L8、L9、L11、L14)、景东 30 个单株(J1、J2、J3、J4、J5、J6、J7、J8、J9、J10、J11、J12、J13、J14、J15、J16、J17、J18、J19、J20、J21、J22、J23、J24、J30、J32、J33、J38、JK1、JK2),采集入选单株的新鲜绿叶,带回实验室备用。采集地详细资料见表1。
仪器和试剂:GeneAmpⓇPCR system 9700型扩增仪(MJR公司,美国);GONGDS8000(UVP公司)凝胶成像系统;新型植物基因组DNA抽提试剂盒(UNIQ-10柱式)、引物(试剂盒和引物均为上海生工生物工程技术服务有限公司生产),DNA染料,PCR反应体系的各种试剂,琼脂,电泳仪。
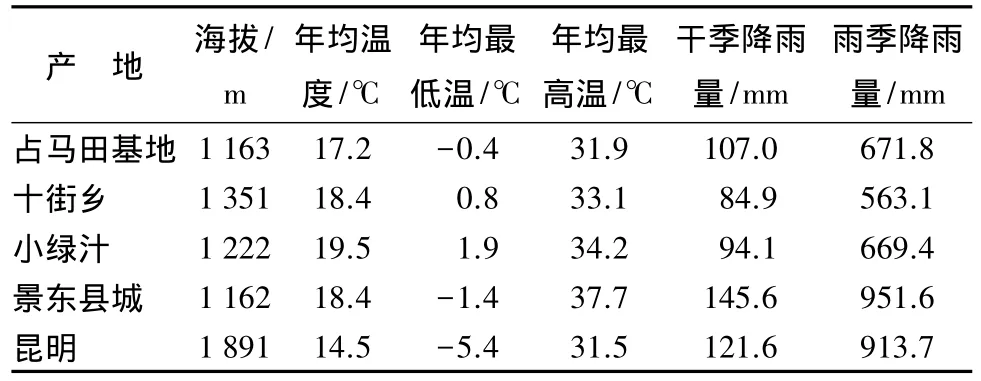
表1 采集地点的基本情况
DNA的提取:取适量新鲜叶片于液氮快速研磨,并应用新型植物基因组DNA抽提试剂盒(UNIQ-10柱式)提取基因组DNA备用。1.2%琼脂糖凝胶电泳检测所提取DNA质量。
ISSR-PCR扩增及检测:经预实验从104对引物中筛选出11对多态性明显、条带清晰、反应稳定的ISSR引物。
反应体系为 25 μL:基因组 DNA50 ng,PCR Buffer(10 mmol·L-1Tris-HCl(pH=8.3),2 mmol·L-1的 MgCl2,0.2 mmol·L-1dNTP,0.2 mmol·L-1反应引物,1 U Taq酶,用去离子水补足总体积。扩增程序设定为:94℃预变性5 min;35个循环(94℃变性 30 s,48.5~52.5 ℃退火 45 s,72 ℃延伸 105 s);72℃延伸10 min。扩增反应在GeneAmpⓇPCR system 9700型扩增仪上进行。扩增产物用1.2%琼脂糖胶(每100 mL加入8 μL GoldViewTM DNA 染料,或者电泳结束后用EB染色10 min)电泳分离,电泳缓冲液是1×TBE,电压120 V电泳50 min,电泳结束后用GONGDS8000(UVP公司)凝胶成像系统拍照记录。
数据分析:根据电泳图谱中DNA条带的有无,将ISSR扩增结果转化为二元数据(有带的计为1,无带的计为0)。应用POPGEN 32软件计算等位基因数(Na)、有效等位基因数(Ne)、Nei’s基因多样性指数(H)、Shannon多样性指数(I)等;并用UPGMA方法对样品进行聚类分析。
2 结果与分析
2.1 塔拉的ISSR多态性
从114个引物中,筛选出11个条带清晰、重复性好的引物(表2);图1为引物Y71扩增样品的电泳图。11条引物共扩增出74条带,位点范围在250~2 000 bp;平均每个引物扩增出6.73条谱带,其中5.55条为多态性条带,多态性百分率为82.65%。引物Y107扩增出10条谱带,引物Y30扩增出9条谱带,并且多态性达到 100%,其余 Y71、Y111、Y109,虽然扩增的条带不是很多,但多态性均达到了100%。引物Y11和Y9扩增的引物多态性最低,仅50%。
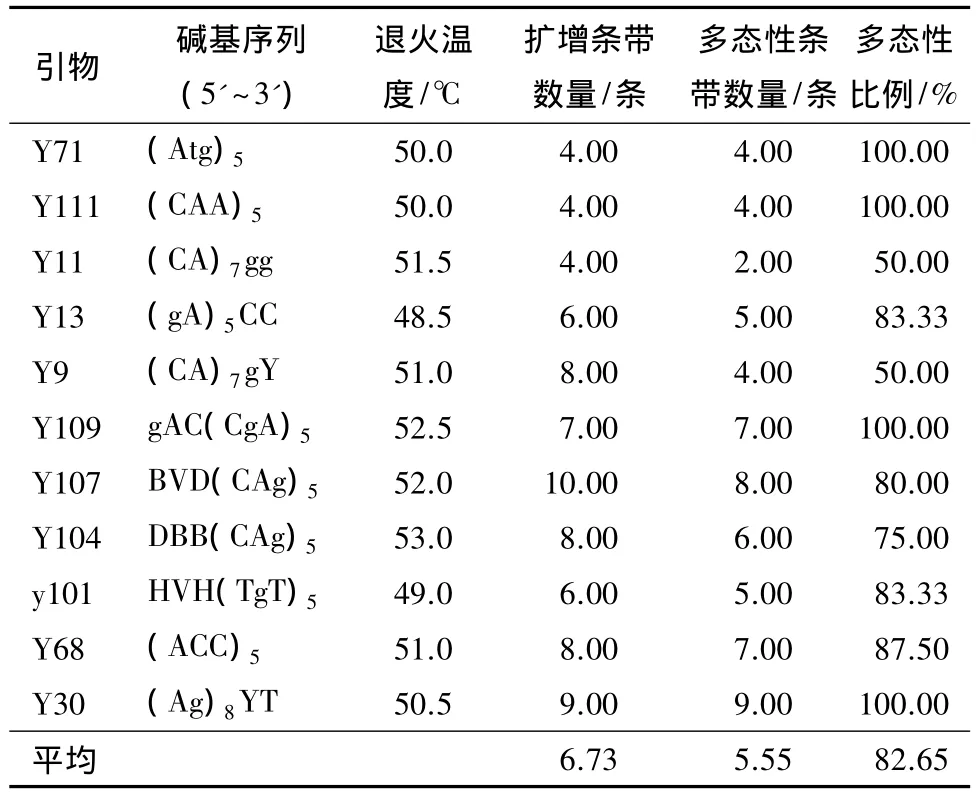
表2 筛选获得的引物及谱带数量
由筛选出的11个引物扩增结果分析,含(CgA)n、(Ag)n核苷酸重复序列的引物扩增重复性好、多态性高,可适用于塔拉的遗传多样性分析。
2.2 塔拉的遗传多样性分析
基于ISSR分子标记所揭示的多态性,经软件计算得到塔拉试验群体的遗传多样性情况(表3)。分析可知,66个塔拉材料的总位点数为74,有效位点数为65,多态位点百分数达到87.84%;其中,试验样本的平均等位基因数值为 1.878 4±0.329 1,平均有效位点数值为 1.426 3±0.342 0,Nei’s基因多样性指数值为 0.257 6±0.177 3,Shannon 多样性指数值为0.394 7±0.241 6。表明所采集的塔拉群体的遗传多样性较高,存在较丰富的遗传变异,这与对塔拉的表型性状多样性分析取得相类似的结果[7]。
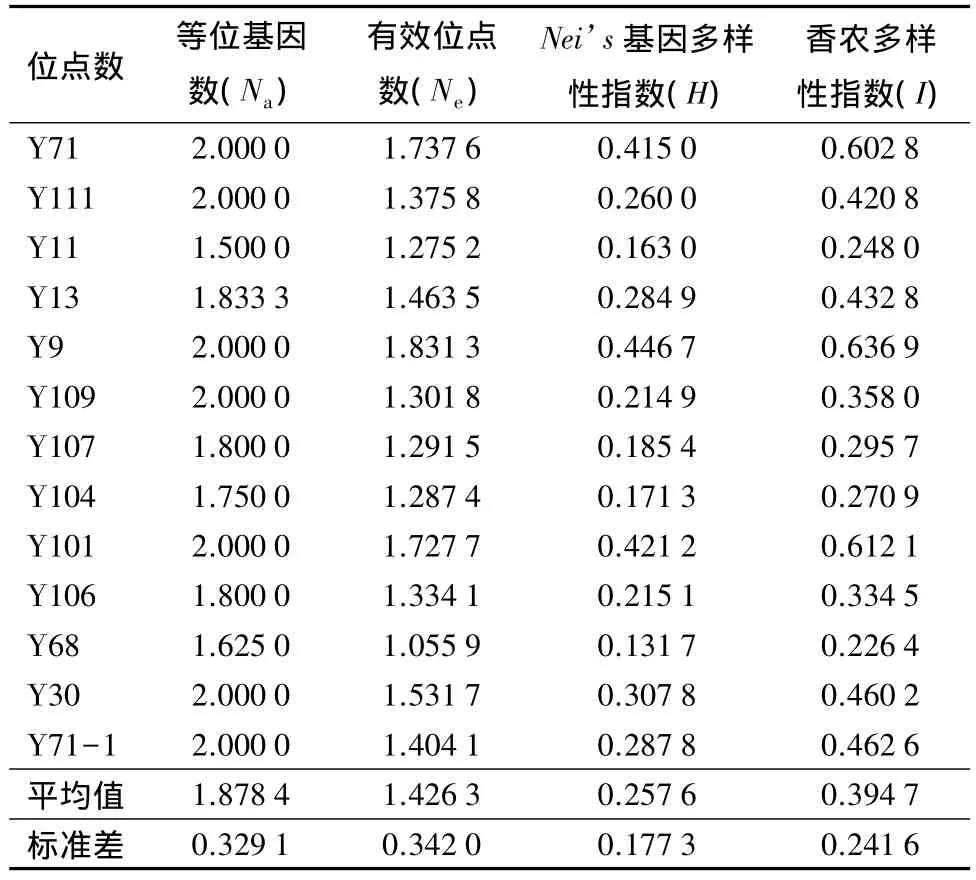
表3 塔拉各多态位点的遗传多样性指数

图1 引物Y71扩增图谱

图2 基于ISSR分子标记的塔拉样本UPGMA聚类图
2.3 塔拉的遗传距离和聚类分析
根据ISSR引物扩增结果,计算出66个试验样本的遗传相似系数和遗传距离。供试材料间的遗传相似系数为 0.46~0.99,平均值为 0.78,遗传距离为0.01~0.64,平均值 0.22。J33 和 J38、L11 和 L14、Z9和Z11、L8和Z15、Z7和Z24之间的遗传距离最小,亲缘关系最近;KM1和X2之间的遗传距离最大,亲缘关系最远。
基于样本间的遗传相似系数用UPGMA方法进行聚类分析(图2)。从图2可以看出,在0.749的遗传距离上将66份材料分为6大类:Ⅰ类,KM1、KM2、KM3、KM4 和 M2;Ⅱ类,S2、J12、J3、J13、J14、M3、ZL、Z7、Z24、Z26、L5、Z10、Z1-20、ZZ1、Z9、Z11、J30、S1、J33、J38、J1、J10、J2、J15、J6、J7、J8、J9、J11、J16、J18、J20、L8、Z15、L11、L14、Z12、ZZ4、Z5、ZZ2、ZZ5、J21、J22、J23、JK1、X1、JK2、Z22、J5;Ⅲ类,J4、J32;Ⅳ类,M1、J17、J24、J19、Z8、Z21;Ⅴ类,X2;Ⅵ类,L1、L9、L6。
从聚类结果来看,昆明种植的单株处于北亚热带区域,是对相对寒冷地带适应的一种类型,所采集的4个样本均处于这个类型;小绿汁的L1、L9和L6单独成为一类,这和引进渠道有很大的关系,小绿汁所采集单株和其他地方采集的单株是不同的引种批次;其余4类中,Ⅱ类占据了大部分的单株,除小绿汁的4个单株外,这些采集单株均为同一批次引进;Ⅲ类、Ⅳ类和Ⅴ类是在同一批次引种的塔拉种质中经过多年的引种驯化和地理适应而分离出来的不同类型。
3 结论与讨论
ISSR在对遗传多样性进行分析时具有多态性高、试验稳定性好、引物设计简单等优点,本文首次将该分子标记在塔拉上应用,对塔拉群体的遗传变异情况进行分析,揭示该群体具有较高的遗传多样性。但作为一种显性标记,ISSR也有一些难以克服的不足,如它不能鉴别显性杂合与显性纯合。因此,在条件允许的情况下,应积极开发共显性标记,同时结合多态性高的ISSR标记,多种分子标记联合使用,将在植物遗传多样性分析上发挥更大的作用。
中国所引进的塔拉,前后总计两批次,第1次由中国林业科学研究院资源昆虫研究所引进种子共培育出26棵塔拉苗,云南省所推广的塔拉全部由这26棵单株所产种子繁育而来;第2次由易门县林业局引进种子培育的塔拉苗仅仅繁育了小绿汁2.33 hm2左右的面积。因此,云南引种塔拉的遗传基础较窄;但经过10 a多的引种驯化、各地区农民的推广种植以及云南各地小气候类型多变,致使适应不同自然条件的地理变异类型出现并保存。这就丰富了塔拉的遗传基础,为进一步品种选育提供理论与实践基础。
从多态性位点百分率和香农指数两个指标来看,塔拉的遗传多样性和珙桐[8]、灰毡毛忍冬[9]等物种的遗传多样性相近,均具有丰富的遗传多样性,有很大的选育空间。由于塔拉的经济价值较高,塔拉在云南的分布范围很广,从北亚热带的昆明到南亚热带的景东,海拔1 160~1 890 m,不同的生长环境使塔拉产生了很多的适应性变异,可以从这些分布地区选择特定目标的单株,进行有性或者无性繁殖,定向培育出符合目标的家系或无性系;同时可考虑从国外引种,进一步增加塔拉的种质资源和应用基础。
[1] 江苏科技考察团.秘鲁刺云实资源及其利用考察报告[J].林产化工通讯,1992(3):31-34.
[2] 包松莲,夏定久,李志国.塔拉的生态适应性及其在云南适生区域的划分[J].云南林业科技,2001(4):45-49.
[3] 袁素蓉,期俊光,普凤仙.易门县干热河谷地区塔拉引种试验[J].云南林业科技,2001(2):41-44.
[4] 夏定久,李志国.塔拉的工业用途与丰产栽培[M].昆明:云南科技出版社,2005:35-36.
[5] 蒋建新,朱莉伟,张卫明,等.塔拉多糖胶的研究[J].西南林学院学报,2003,23(4):12-16.
[6] 周延清.DNA分子标记技术在植物研究中的应用[M].北京:化学工业出版社,2005.
[7] 包松莲,李志国,张建云,等.云南塔拉林表型多样性研究[J].氨基酸和生物资源,2009,31(4):45-49.
[8] 李雪萍,郑雪,朱文琰,等.濒危植物珙桐遗传多样性与遗传结构的 ISSR 分析[J].广东农业科学,2012(6):121-123.
[9] 王珊,周日宝,潘清平,等.利用ISSR和RAPD标记技术分析灰毡毛忍冬种质资源的遗传多样性[J].中医药导报,2011,17(11):65-67.

