不同发育时期三七体胚多糖质量分数及体胚提取物抗氧化活性比较1)
赵 越 韩东洺 尹绍鹏 孙凤阳 胡 颖 卢 宏 由香玲
(东北林业大学,哈尔滨,150040)
三七(Panax notoginseng(Burk.)FH.Chen)为五加科人参属植物,是我国传统名贵中药材,含有皂苷类物质、黄酮、多糖类等多种活性成分。其中人参皂苷类抗氧化活性的特点已被应用到缓解衰老以及衰老性疾病防治方面的食品和化妆品等领域,因为活性氧自由基可直接或间接损伤DNA,导致DNA链断裂和染色体断裂,诱导很多疾病的发生[1-3]。很多研究显示,三七多糖也具有增强免疫的功能[4-6]。
近年来,应用植物细胞培养技术生产有用次级代谢产物日益引人注目,紫草细胞、人参细胞、红豆杉细胞等已实现了产业化生产[7]。三七由于自然生长及栽培地区非常狭窄,产量很有限。利用植物细胞培养技术对其进行规模化培养生产有效成分,具有非常重要的经济价值。三七细胞培养处于实验室研究阶段,Zhong等初步研究了高密度培养细胞生产人参皂苷及三七多糖的技术[8-9],但是有关培养材料中三七皂苷类物质清除自由基活性方面及多糖的累积量如何,目前未查到相关报道。笔者在研究体细胞胚发生的基础上,考查不同发育时期体细胞胚中三七皂苷清除DPPH自由基活性及多糖累积量,进一步大规模培养筛选合适的外植体及培养方法。
1 材料与方法
1.1 三七不同发育时期体细胞胚的获得
在前期试验中已成功建立了三七体胚发生再生体系[10],并且获得了大量的胚性愈伤组织(见图1a)。将胚性愈伤移入体细胞胚发生培养基上诱导体胚发生,4周后愈伤组织上生长出大量前期体胚(球形胚和心形胚,见图1b);然后进行继代,体细胞胚继续萌发,4周后大部分发育到后期体细胞胚(鱼雷胚和子叶体胚,见图1c);子叶胚继续萌发生长8周后,该胚苗根部隆起变粗(见图1d)。收集上述各时期的样品于烘箱中60℃烘干,对其多糖质量分数及抗氧化活性进行分析。
为了能更清楚地说明不同发育时期体细胞胚中的多糖质量分数及抗氧化活性状况,同时分析了栽培3 a的三七根中多糖质量分数。
1.2 不同发育时期三七体细胞胚中的多糖质量分数测定
收集的材料中多糖质量分数的测定采用蒽酮比色法进行。糖类遇浓硫酸发生脱水,形成糠醛及其衍生物,该衍生物可与蒽酮发生反应,呈蓝绿色。该方法快速简便,具体步骤参考姜曼花的方法[11]。
1.2.1 样品中多糖的提取
三七的胚性愈伤组织、前期体胚、后期体胚、体胚苗以及栽培根粉末各1.0 g,置于10 mL离心管中,分别加入4 mL蒸馏水,在100℃水浴中提取4 h,7 000 r/mim离心10 min,收集上清液。在上清液中缓慢加入体积为上清液3倍的95%乙醇,边加边搅动,于4℃条件下静置12~24 h后取出,9 000 r/mim离心10 min,将上清液弃去,收集沉淀,乙醇挥干后即为所提多糖。提取所得的多糖加10 mL蒸馏水溶解,即得供试样品溶液。
1.2.2 最大吸收波长的确定
以葡萄糖为标准品,配置质量浓度为200 mg/L的葡萄糖母液。取2个10 mL离心管,一个不加母液,加入蒸馏水1.0 mL;另一个加入母液、蒸馏水各0.5 mL。2试管中再分别加入8.0 mL蒽酮试剂,摇匀。沸水浴中加热10 min后取出迅速放在冰水中冷却至室温,摇匀。在500~700 nm波长范围内扫描(以空白管作对照),确定最大吸收波长为630 nm。
1.2.3 标准曲线的绘制
以葡萄糖溶液为标准品绘制标准曲线,得到回归方程为:y=0.030 0+0.005 0x,相关系数 r=0.996 2,线性范围为 0~0.2 mg。
1.2.4 样品中多糖质量分数测定
吸取各样品供试溶液1.0 mL于10 mL离心管中,按标准曲线制备的方法测定吸光度,根据标准曲线计算样品中多糖质量分数。平行操作3次,结果取平均值。
1.3 不同发育时期三七体细胞胚中的抗氧化活性分析
抗氧化活性以清除DPPH自由基能力的大小表示,清除率越大,抗氧化活性就越强,该方法被广泛应用于清除自由基物质活性研究。DPPH自由基含有单电子,在517 nm波长处有一强吸收,其乙醇溶液呈深紫色。
1.3.1 样品溶液的制备
精密称取(60±1)℃干燥至恒质量的实验室组织培养的三七胚性愈伤组织、前期体胚、后期体胚、体胚苗以及栽培三七根粉末各0.5 g,以5 mL 75%乙醇浸泡过夜,次日以75%乙醇室温超声提取3次,5 mL/次,每次提取 30 min,合并提取液,以 0.45 μm 微孔滤膜滤过,75%乙醇定容至25.0 mL。80℃水浴减压蒸干溶剂后,以75%乙醇复溶,并定容至8.0 mL。栽培三七根提取物定容至 2.0 mL,摇匀,以0.45 μm微孔滤膜滤过,即得供试样品溶液。
1.3.2 标准对照品
以维生素C(Vc)为标准对照品。精密称取0.001 0 g Vc粉末,以75%乙醇溶解并且定容至10 mL,配成质量浓度为0.1 g/L的Vc溶液,作为标准对照液。
1.3.3 皂苷粗提物对DPPH自由基的清除测定
抗氧化活性的分析用文献[12]的方法。
清除率=((Ab-Aa)/Ab)×100%。
式中:Aa为待测样品,即100 μL Vc或样品供试液与1 mL DPPH自由基溶液和1.4 mL 75%乙醇溶液混合的吸光度;Ab为空白对照,即1 mL DPPH自由基溶液和1.4 mL 75%乙醇溶液混合的吸光度。
1.4 数据统计分析方法
采用 Excel、SPSS(version 17.0)软件处理数据,运用ANOVA分析法中的邓肯多重比较法(P<0.05)对同一批取样后的数据进行多重比较分析。
2 结果与分析
2.1 三七体细胞胚发生
按照已建立的三七体细胞胚发生及其植株再生体系,获得的实验材料见图1。
2.2 不同发育时期三七体细胞胚中的多糖质量分数
测定不同发育时期三七体胚中多糖质量分数,并对其进行统计分析,结果见表1。不同发育时期的体胚中多糖质量分数差异显著,从大到小依次为后期体胚、前期体胚、体胚苗、胚性愈伤组织;最高的是后期体胚,为16.44 mg/g;最低的为胚性愈伤组织,为12.24 mg/g。该实验也对栽培3 a三七根中的多糖质量分数进行了分析,结果为58.74 mg/g。后期体胚中多糖的质量分数占总栽培的27.99%,其培养时间较短,说明后期体细胞胚中多糖的含量相当可观。

表1 三七不同发育时期体胚中多糖质量分数

图1 不同发育时期的体细胞胚及栽培三七根
2.3 不同发育时期三七体细胞胚皂苷粗提物对DPPH自由基的清除作用
不同发育时期三七体细胞胚中的皂苷粗提物对DPPH自由基清除作用、数据分析统计见图2。可以看出:Vc和各时期体细胞胚中的皂苷对DPPH自由基的清除作用趋势一致,都是在一定范围内随着质量浓度的增大清除能力增加,达到一定的质量浓度后,清除作用趋于平稳。但Vc清除自由基的速率更快,而三七体胚材料皂苷粗提物的清除速率很慢,在较长时间内清除作用才能达到平稳。王晶等认为:此特性在联合用药中有利于人参皂苷抗自由基作用的缓慢释放[13]。
常用清除率为50%对应的样品质量浓度,即称为此样品的半数抑制质量浓度(IC50),用来表示样品清除DPPH自由基的能力大小。IC50值越低,表明其抗氧化、清除自由基的能力越强。将上述Vc和各不同三七材料粗提物对DPPH自由基清除作用用IC50方法进行统计分析(见表2)。可见,与Vc相比,栽培三七皂苷粗提物和培养的各不同发育时期材料皂苷粗提物对自由基的清除能力都较弱。这与许多研究人参、西洋参、三七皂苷对DPPH自由基清除作用的结论相同:人参皂苷对DPPH自由基具有一定的清除能力,是一种较弱的自由基清除剂[1-2,13]。
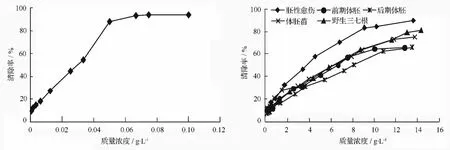
图2 Vc及三七不同发育时期体胚对DPPH自由基的清除作用
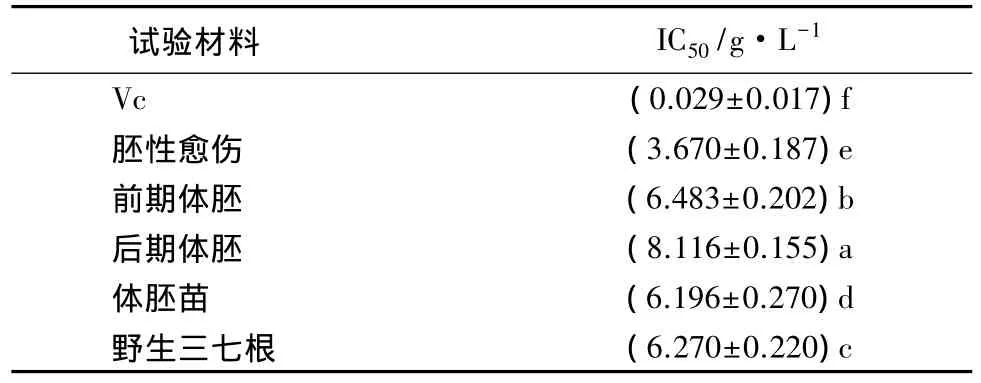
表2 三七不同发育时期体胚及栽培三七根皂苷粗提物与Vc的IC50
不同发育时期体细胞胚皂苷粗提物对DPPH自由基的清除作用有较显著差异,从强到弱顺序为:胚性愈伤组织、体胚苗、栽培三七根、前期体胚、后期体胚。胚性愈伤组织皂苷粗提物的清除能力最强,IC50值为3.670 g·L-1;最弱的为后期体胚皂苷粗提物,IC50值达 8.116 g·L-1。栽培三七皂苷粗提物对DPPH自由基的清除作用与体细胞胚苗的接近,低于胚性愈伤组织皂苷粗提物。因此,三七体胚的培养材料在抗氧化活性方面要优于栽培三七。
3 结论与讨论
不同发育时期的体胚中多糖质量分数的差异可能与胚性细胞的生长和发育相关,胚性细胞在后期体胚阶段生长更旺盛,需要大量糖类来维持旺盛的代谢;而到体细胞胚苗阶段,生长较缓慢,糖类合成降低;也可能与培养条件有关。本研究获得了多糖质量分数最高的后期体细胞胚材料,需进一步对其生长速率进行研究,以期短时间内获得更多三七多糖。
不同发育时期体胚的皂苷粗提物对DPPH自由基的清除作用与栽培三七根的相似,都较Vc弱且作用缓慢,有利于皂苷药效的缓释作用。三七不同发育时期体细胞材料中,胚性愈伤组织皂苷的粗提物对DPPH自由基的清除作用最强,强于栽培三七根皂苷粗提物的作用。而在前期的研究中,三七不同发育时期体细胞材料胚性愈伤组织中皂苷的质量分数最低。可能的原因是,本研究所用的皂苷粗提物采用五加科植物皂苷提取的方法,用75%乙醇为溶剂,该粗提物中可能同时含有很多其他活性物质,如黄酮类、酚类等,它们对自由基的清除作用相比皂苷类要强很多,因此,出现皂苷质量分数与自由基清除作用不一致的结果。4~6年生刺老芽根提取物对DPPH自由基清除能力的研究也显示,4 a的清除能力高于6 a的,而与皂苷的累积量不一致[14]。丁克祥等认为:一般植物提取物中的抗氧化物有黄酮类、酚类、皂苷类、多糖类等,其含量和组成决定了抗氧化性的大小[15]。幼嫩组织清除自由基的能力一般高于老的部分,例如黄素梅等在研究几种香蕉废弃物清除DPPH自由基过程中发现:各种材料清除DPPH自由基的能力最强的是最幼嫩部分,即嫩苞片[16]。
综上所述,与大田栽培3 a的三七根相比,三七体胚培养材料中的多糖质量分数在生长时间上很可观。体胚培养材料与大田栽培3 a的三七根皂苷粗提物在抗氧化活性——清除DPPH自由基方面,有相似的缓慢特性,且前者材料中胚性愈伤组织对DPPH自由基的清除作用要优于后者。因此,三七体胚培养材料是进行规模化培养生产有效成分的很好材料。
[1] 王雪梅,戴云,张建胜,等.分光光度法测定三七皂苷清除活性氧自由基的研究[J].云南中医中药杂志,2006,27(6):41-42.
[2] 刘满红,杨明惠,刘晓芳,等.紫外辐射诱发自由基体系及抗氧化活性的研究[J].化学世界,2008,14(1):14-16.
[3] Salem Y H,Du lchavsky S A,Dutta S.Effect of inhibition of Lipid peroxidation on myocardial oxidant damage[J].The Journal Surgical Reserch,1994,56(6):606-610.
[4] Gao H,Wang F,Lien E,et al.Immunostimulating polysaccharides from Panax notoginseng[J].Pharmaceutical Reserch,1996,13(8):1996-1200.
[5] 陈新霞,顾呈华,杨明晶,等.三七多糖对小鼠免疫功能调节的研究[J].江苏预防医学,2007,18(3):10-12.
[6] 崔秀明,徐珞珊,王强,等.三七糖类成分的含量及其变化[J].现代中药研究与实践,2003(7):21-24.
[7] 高文远,贾伟,段宏泉,等.药用植物发酵培养的工业化探讨[J].中国中药杂志,2003,28(5):385-390.
[8] Zhong J J,Yu J T,Yoshida T.Recent advances in plant cell cultures in bioreactors[J].World Journal Microbiology Biotechnology,1995,11(4):461-467.
[9] Zhong J J,Yoshida T.High density cultivation of Perilla frutescens cell suspensions for anthocyanin production:effects of sucrose concentration and inoculumsize[J].Enzyme Microbial Technology,1995,17(12):1073-1079.
[10] You X L,Tan X,Dai J L,et al.Large-scale somatic embryogenesis and regeneration of Panax Notoginseng[J].Plant Cell,Tissue and Organ Culture,2012,108(2):333-338.
[11] 姜曼花,邱细敏,刘胜姿,等.白背三七多糖的提取纯化及含量测定[J].时珍国医国药,2008,19(9):2147-2149.
[12] Zhao H F,Chen W F,Lu J,et al.Phenolic profiles and antioxidant activities of commercial beers[J].Food Chemistry,2010,119(3):1150-1158.
[13] 王晶,刘春明,白鹤龙,等.中药中皂苷类化合物的抗氧化活性评价研究[J].时珍国医国药,2010,21(6):1485-1487.
[14] 庞永,白雪梅,姜成哲,等.刺老芽根提取物对DPPH自由基的清除能力及抑菌作用[J].安徽农业科学,2010,38(11):5844-5845.
[15] 丁克祥,刘卫国.抗衰老实验与基础研究[M].北京:原子能出版社,1995.
[16] 黄素梅,韦绍龙,韦弟,等.几种香蕉废弃物清除DPPH自由基的作用[J].北方园艺,2012(15):5-8.

