超声辅助提取强抗氧化性的紫苏叶工艺条件研究
陈 慧,许妍姬,崔承弼,崔香淑
(1.延边大学基础医学院,吉林延吉 133002;2.延边大学农学院,吉林延吉 133002;3.延边大学护理学院,吉林延吉 133002)
超声辅助提取强抗氧化性的紫苏叶工艺条件研究
陈 慧1,许妍姬1,崔承弼2,崔香淑3*
(1.延边大学基础医学院,吉林延吉 133002;2.延边大学农学院,吉林延吉 133002;3.延边大学护理学院,吉林延吉 133002)
[目的]研究超声波辅助提取紫苏叶抗氧化性的最佳工艺条件。[方法]采用乙醇浓度分别为60%、70%、80%、90%;提取料液比分别为1∶10、1∶20、1∶30、1∶40 g/ml;超声时间分别为10、20、30、40 min;超声功率分别为200、250、300、350 W的单因素试验和正交试验L9(34)优选超声波辅助提取紫苏叶抗氧化性的工艺条件。[结果]单因素试验的最佳结果为:乙醇浓度70%,料液比1∶30 g/ml,超声时间20 min,超声功率350 W;超声波辅助提取紫苏叶抗氧化性物质的最佳工艺条件为:料液比1∶30 g/ml,乙醇浓度80%,超声功率200 W,超声时间20 min;在此条件下,紫苏叶对DPPH自由基的清除率高达84.56%。[结论]在合适的提取条件下,紫苏叶的抗氧化活性较高。
紫苏叶;超声波;提取;抗氧化性
紫苏(PerillafrutescensL.)又被称为红苏、赤苏、香苏,系唇形科紫苏属一年生草本植物[1],不仅位列我国前卫生部颁布的首批食药同源的物品,另外德国也为拟定绿色和紫色皱叶紫苏可作为新型蔬菜做了前期的紫苏酮毒理学评价[2]。紫苏的营养物质较为丰富, 其中迷迭酸[3]、金圣草黄素、木犀草素[4-5]、芹黄素[6]和咖啡酸[7]含量较为突出。研究表明,紫苏具有多种生物功效如紫苏中芹黄素有降低血清总胆固醇和低密度脂蛋白作用、咖啡酸和迷迭酸可以抑制t-BHP引起的肝脏损害、激活抗氧化反应元件通路(野生紫苏)作用[8-12]。抗氧化其作用原理是这些化合物激活细胞中抗氧化酶效应,阻断了自由基的链式反应[13],减缓机体的衰老。超声波辅助提取技术作为一种新型分离技术,具有搅拌作用、较强的共振效应和高加速度而产生的空化效应等,并且加强了传质过程,致使有效成分进入溶剂加快,提高提取效率,值得一提的是它没有较高温度减弱有机成分的活性[14-15]。笔者考察超声波辅助提取紫苏叶抗氧化性的最佳工艺条件,以期为紫苏叶的进一步开发利用提供依据。
1 材料与方法
1.1 材料
1.1.1 研究对象。紫苏叶,于2013年10月采购自延吉市西市场后于冰箱冷藏贮存。
1.1.2 主要仪器。FA1104分析天平,购自上海精科天平公司;TDL-5000B型离心机,购自上海安亭科学仪器厂;U-3900紫外可见分光光度计,购自日立公司;KQ-500D型医用数控超声波清洗器,购自昆山市超声仪器有限公司。
1.1.3 主要试剂。1,1-二苯基苦基苯肼(DPPH),购自Sigma公司;乙醇,购自天津市科密欧化学试剂有限公司。
1.2 方法
1.2.1 紫苏叶抗氧化性物质的提取方法。将紫苏叶清洗、挑梗、烘干后剪碎称取2.000 g,按一定料液提取法是植物有效成分提取的传统方法,存在耗时长、提取效率低、热敏性成分易分解等缺点。而试验采用新型的分离提取技术,利用超声波清洗器中振荡提取,该方法的优点是提取效率高、溶解均匀、提取溶剂消耗少等。
1.2.2 超声波辅助提取紫苏叶抗氧化物质单因素试验。单因素试验选择了紫苏叶超声提取的乙醇浓度、料液比、提取时间、超声功率等因素,用比色法来衡量试验结果。
1.2.2.1 乙醇浓度的影响。用分析天平上准确称量紫苏叶2.000 g并剪碎叶片,分别溶于60 ml的60%、70%、80%、90%的乙醇中,将超声波清洗器加热至50 ℃,超声功率调至300 W在超声频率40 kHz下超声浸提20 min后,再采用1 000 r/min离心5 min,取上清液用分光光度计比色法测定自由基清除率。
1.2.2.2 料液比的影响。用分析天平准确称量紫苏叶2.000 g并剪碎其叶片,分别溶于20、40、60、80 ml的浓度70%乙醇中,将超声波清洗器加热至50 ℃水浴,在超声频率40 kHz下超声功率调至300 W浸提20 min,1 000 r/min离心提取液 5 min后取上清液用分光光度计比色法测定自由基清除率。
1.2.2.3 超声处理时间的影响。用分析天平准确称量紫苏叶2.000 g并剪碎后溶于60 ml的浓度70%乙醇中,将超声波清洗器加热至50 ℃,在超声频率40 kHz下分别以超声功率300 W浸提10、20、30、40 min,之后1 000 r/min将提取液离心5 min,最后取上清液用分光光度计比色法测定自由基清除率。
1.2.2.4 超声功率的影响。用分析天平准确称量紫苏叶2.000 g,剪碎后溶于60 ml的浓度70%乙醇中,将超声波清洗器加热至50 ℃,在超声频率40 kHz下超声功率分别调至200、250、300、350 W浸提20 min,之后采用1 000 r/min下提取液离心5 min,最后用分光光度计比色法测定自由基清除率。
1.2.3 正交试验设计。综合考虑影响因素对影响紫苏叶抗氧化物提取效果的作用,为了确定最佳抗氧化性的提取方案,本实验将料液比(A)、乙醇浓度(B)、超声功率(C)、超声时间(D)4个因素纳入L9(34)正交试验的设计范畴,正交设计如表1所示。
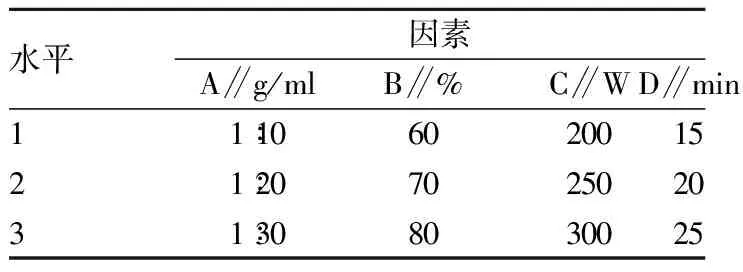
表1 正交试验因素水平设计
1.2.4 DPPH自由基清除率。参考并采用了DPPH自由基分光光度法[16-17]。按表2 DPPH自由基测定体系混匀充分后准确加样品,等待30 min体系稳定后将分光光度计波长调至517 nm测定其吸光值,最后按照下列公式计算清除率:
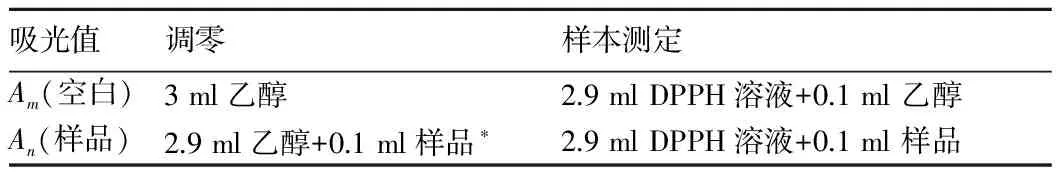
表2 DPPH自由基分光光度法的测定方法
*注:样品调零,避免紫苏叶色素对吸光度的影响。
2 结果与分析
2.1 乙醇浓度对紫苏叶抗氧化物质的影响 图1表明,浓度60%~70%乙醇提取液对DPPH自由基清除率稍微有所上升,并且70%浓度乙醇达到清除率峰值77.38%,原因可能是提取溶液极性达到了一定高度,从而导致抗氧化物质更容易溶出[18];乙醇浓度在70%~90%区间内,大量杂质也可能由于溶剂极性过大而溶出,降低了紫苏的抗氧化能力,反而导致DPPH自由基清除率急剧下降。因此,选择70%的乙醇浓度为最佳的超声波辅助提取浓度。

图1 不同乙醇浓度提取物对DPPH自由基清除效果的影响
2.2 料液比对紫苏叶抗氧化物质的影响 图2表明,料液比1∶30 g/ml的清除率明显最高,为75.53%,这是因为所用的乙醇溶剂的比例扩大,溶剂体系的浓度差也随之增大,这样抗氧化物质溶出更加充分,提取液的抗氧化活性也相应提高;而料液比超过1∶30 g/ml后,可能是果胶类和叶绿素等杂质因浓度差过高而大量溶出引起提取液的抗氧化能力下降。因而最佳超声波辅助提取的料液比为1∶30 g/ml。
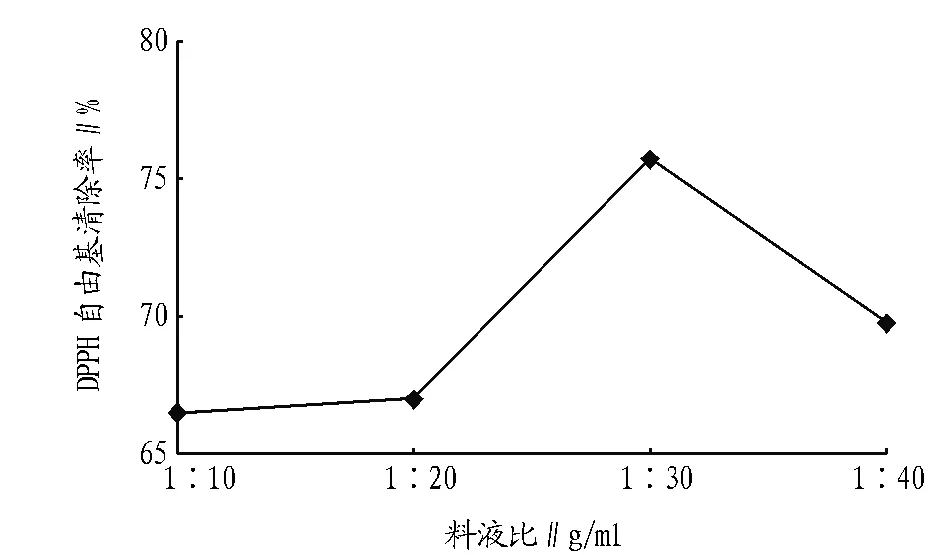
图2 不同料液比提取物对DPPH自由基清除效果的影响
2.3 超声时间对紫苏叶抗氧化物质的影响 图3表明,超声时间20 min时自由基的清除率升到最高后逐渐平稳。原因可能是处理的时间太长长致使抗氧化活性的有效成分发生降解[19];另外提取物中杂质也会不断溶出,所以抗氧化有效成分所占比例降低。因此,选择20 min为最佳提取时间,清除率为78.82%。
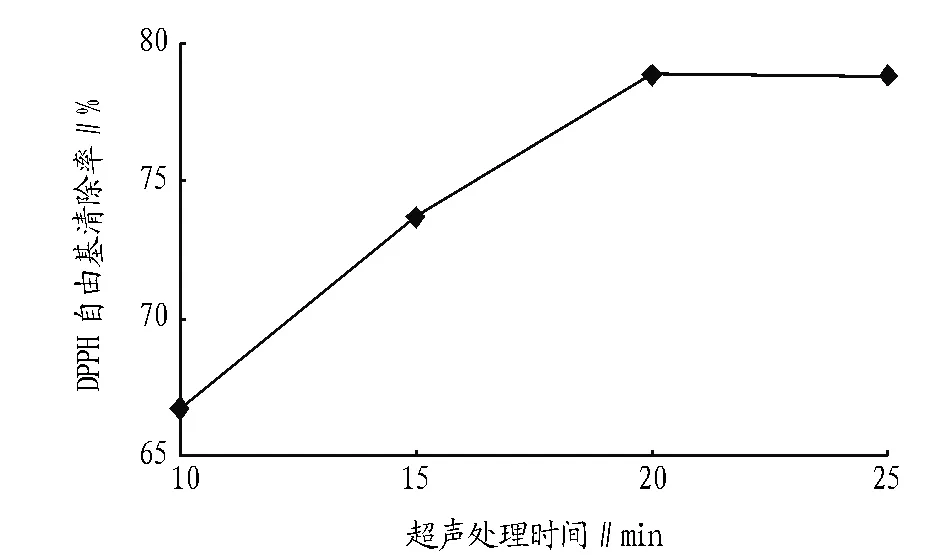
图3 不同超声处理时间提取物对DPPH自由基清除效果的影响
2.4 超声功率对紫苏叶抗氧化物质的影响 图4表明,超声功率对提取效果的影响较大[20],DPPH自由基清除率不断升高。因为超声功率越大植物细胞破碎越完全,溶出的抗氧化物质越多。因此,试验选取350 W为超声波辅助提取的最佳功率。
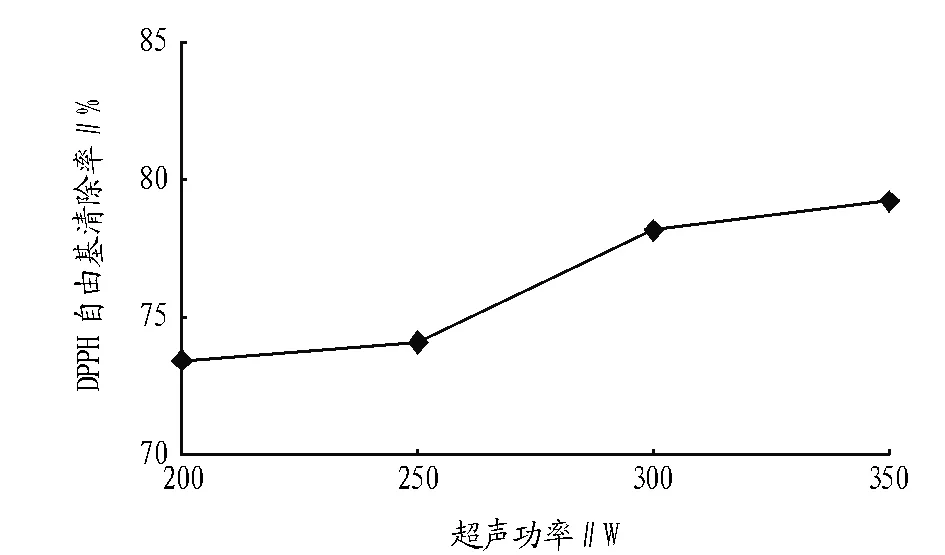
图4 不同超声功率提取物对DPPH自由基清除效果的影响
2.5 DPPH自由基清除率的的正交试验结果 由于各因素间的相互作用较为复杂,采用L9(34)正交试验设计考察以上因素对紫苏叶提取物抗氧化活性的影响。由表3可知,4个超声波辅助提取因素影响为:A(料液比)>C(超声功率)>D(提取时间)>B(乙醇浓度)。综合极差和方差分析,确定最佳提取工艺为:A3B3C1D2,即料液比1∶30 g/ml,乙醇浓度80%,超声功率200 W,超声时间20 min。经验证试验后,在此工艺条件下紫苏叶提取物的DPPH自由基的清除率高达84.56%。
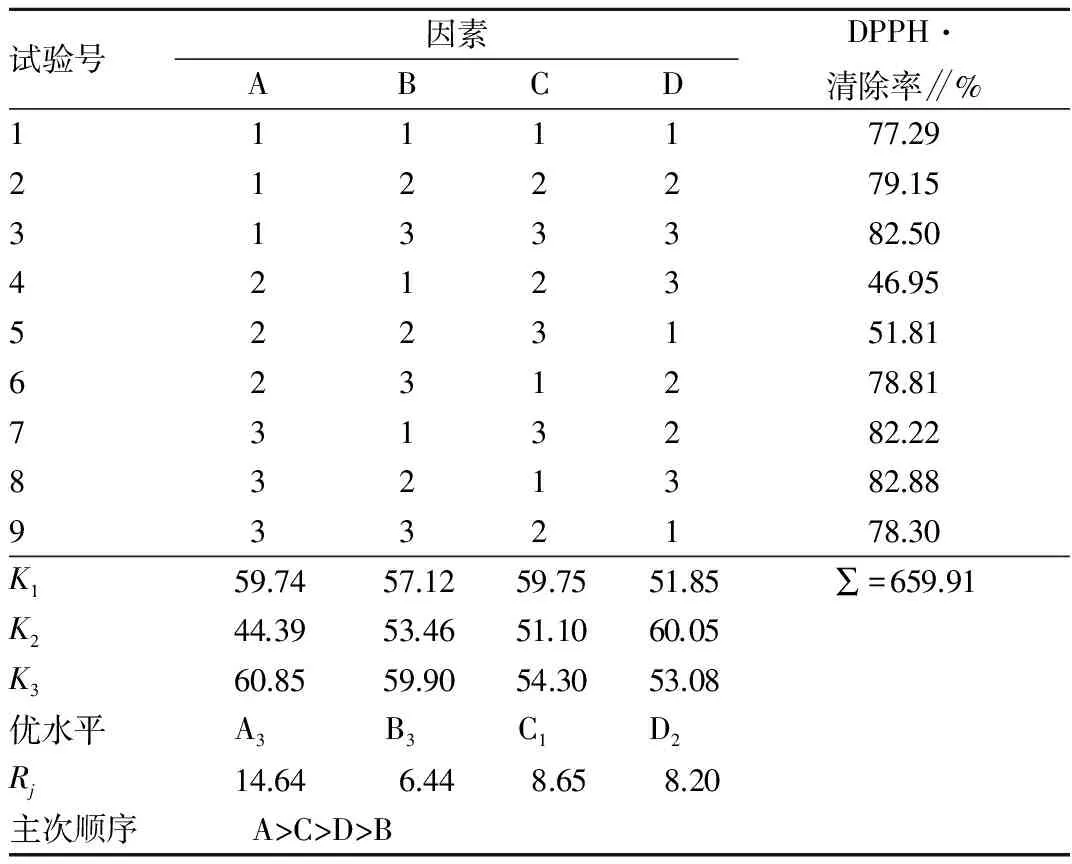
表3 正交试验设计及试验结果
3 结论
在紫苏叶的抗氧化性物质的提取单因素试验表明,不同的料液比、乙醇浓度、超声功率、超声时间提取紫苏叶活性物质的抗氧化性不同,最佳的料液比是1∶30 g/ml,乙醇浓度是70%,超声功率是300 W,超声时间是20 min。紫苏叶的抗氧化性物质正交试验结果显示,超声波提取紫苏叶中抗氧化物的最佳工艺为:料液比1∶30 g/ml,乙醇浓度80%,超声功率200 W,超声时间20 min;在 此 优 化 条件下得 到 的提取物对DPPH自由基的清除率达到84.56%。鉴于紫苏叶如此高的抗氧化能力,其研发产品应具有广泛的发展潜力[20]。
[1] 耿榕徽,杨宇杰,胡春兰,等.紫苏叶中紫苏醛的提取与含量测定[J].中国当代医药,2014,21(7):4-7.
[2] MULLER-WALDECK F,SITZMANN J,SCHNITZLER W H.Determination of toxic perilla ketone, secondary plant metabolites and antioxidative capacity in fivePerillafrutescensL.Varieties[J].Food and Chemical Toxicology,2010,48(1):264-270.
[3] 董彦莉,刘祺凤,赵超.纤维素酶辅助提取紫苏中迷迭香酸工艺优化[J].湖北农业科学,2013, 52(12):2888-2890.
[4] 滕杨,侯丽然,侯巍,等.木犀草素-Cr(Ⅲ)配合物的合成及其清除DPPH自由基活性的研究[J].中国药房,2012,24(39):3666-3669.
[5] 王继双,何焱,张文静,等.木犀草素的药理作用研究进展[J].生命科学,2013,25(6):560-565.
[6] GU L H,WUA T,WANG Z T.TLC bioautography-guided isolation of antioxidants from fruit ofPerillafrutescensvar.Acuta[J].LWT- Food Science and Technology,2009, 42(1):131-136.
[7] YANG S Y,HONG C O,LEE G P.The hepatoprotection of caffeic acid and rosmarinic acid, major compounds ofPerillafrutescens, against t-BHP-induced oxidative liver damage[J].Food and Chemical Toxicology,2013,55:92-99.
[8] FENG L J,YU C H,YING K J.Hypolipidemic and antioxidant effects of total flavonoids ofPerillafrutescensleaves in hyperlipidemia rats induced by high-fat diet[J].Food Research International,2011,44(1):404-409.
[9] IZUMI Y,MATSUMURA A,WAKITA S.Isolation, identification,and biological evaluation of Nrf2-ARE activator from the leaves of green perilla(Perillafrutescensvar.crispa.fviridis)[J].Free Radical Biology and Medicine,2012,53(4):669-679.
[10] VERSPOHL E J,FUJII H,HOMMA K.Testing ofPerillafrutescensextract and Vicenin 2 for their antispasmodic effect[J].Phytomedicine,2013,20(5):427-431.
[11] 张洪,黄建韶,王云.紫苏啤酒的研制[J].食品工业,2006(2):42-44.
[12] KANGA N S,LEE J H.Characterisation of phenolic phytochemicals and quality changes related to the harvest times from the leaves of Korean purple perilla (Perillfrutescens)[J].Food Chemistry,2011,124(15):556-562.
[13] 范青生.保健食品研制与开发技术[M].北京:化学工业出版社,2006:82-83.
[14] 李鹏婧,柳旭光,龙海荣,等.超声波辅助提取菱角壳总黄酮及抗氧化性研究[J].食品科技,2011(1):167-171.
[15] LI J W,CURTIS L W.Recent advances in extraction of nutraceu-ticals from plants[J].Trends in Food Science and Technology,2006,17(6):300-312.
[16] 蒋厚阳,杨吉霞,赵培君.食品抗氧化评价体系及其选择使用[J].食品工业科技,2012,33(24):414-422.
[17] DAWIDOWICZ A L,WIANOWSKA D,OLSZOWY M.On practical problems in estimation of antioxidant activity of compounds by DPPH method[J].Food Chemistry,2012,13(13): 1037-1043.
[18] JUNA H I,KIMB B T,SONG G S.Structural characterization of phenolic antioxidants from purple perilla (Perillafrutescensvar.acuta) leaves[J].Food Chemistry,2014,148(1):367-372.
[19] 王涛,段娇敏.超声波提取苦荞麦总黄酮的工艺探索[J].食品工程,2012(4):27-30.
[20] 雷孝义,温小利.女贞子多糖的超声波提取研究[J].中国当代医药,2010,17(32):135-143.
[21] 蔡伟,熊耀康,余陈欢.3种紫苏属植物挥发油化学成分的GC-MS分析[J].云南中医中药杂志,2010,31(8):63-64.
Ultrasonic-assisted Extraction and Antioxidation of Perilla Leaves
CHEN Hui, CUI Xiang-shu et al
(School of Medical Science, Yanbian University, Yanji, Jilin 133002)
[Objective] To evaluate the antioxidant activity forPerillafrutescensL., which is assisted by ultrasonic extraction. [Methods] The extraction of the antioxidants was assisted by ultrasonic vibration from Perilla leaves, which was through the effects from alcohol concentration 60%, 70%, 80%, and 90%; ratio of material and liquid 1∶10 g/ml, 1∶20 g/ml, 1∶30 g/ml, 1∶40 g/ml; ultrasonic time 10 min, 20 min, 30 min, and 40 min; ultrasonic power 200 W, 250 W, 300 W, and 350 W and through the L9(34) orthogonal test. [Results] The best results of the single factor method are 70% alcohol concentration, 1∶30 g/ml, 20 min, 350 W respectively. And then through the L9(34) orthogonal test, it got the best extraction condition: ratio of material and liquid (1∶30), alcohol concentration (80%), ultrasonic power (200 W), and ultrasonic time (20 min). In this condition, the elimination ratio of DPPH· is up to 84.56%. [Conclusion] Under the condition of suitable extraction above, thePerillafrutescensL has exceptional antioxidant activity.
PerillafrutescensL.; Ultrasonic; Extraction; Antioxidant activity
陈慧(1989-),男,吉林珲春人,硕士研究生,研究方向:卫生毒学。*通讯作者,教授,从事卫生毒理学研究。
2014-04-21
S 567
A
0517-6611(2014)15-04618-03

