不同剂量阿托伐他汀钙对实验性自身免疫性脑脊髓炎大鼠脊髓内NF-κB表达及血清炎性因子的影响
石秋艳,张瑞彪,田广平
论著·基础
不同剂量阿托伐他汀钙对实验性自身免疫性脑脊髓炎大鼠脊髓内NF-κB表达及血清炎性因子的影响
石秋艳,张瑞彪,田广平
目的探讨不同剂量阿托伐他汀钙对实验性自身免疫性脑脊髓炎(EAE)大鼠脊髓内NF-κB表达及血清炎性因子的影响。方法82只Wistar大鼠随机抽取10只为健康对照组,余72只以50%豚鼠全脊髓匀浆诱发建立EAE 模型,而后随机分为EAE模型组、大剂量阿托伐他汀组(大剂量组)、小剂量阿托伐他汀组(小剂量组)各24只,采用量化评分法,比较造模后14d、21d不同剂量阿托伐他汀钙对 EAE大鼠血清白介素-2(IL-2)、同型半胱氨酸(Hcy)及脊髓内核转录因子-κB (NF-κB)水平的影响,同时对其发病率及潜伏期进行比较。结果造模后高剂量组发病率及病死率明显低于低剂量组及EAE模型组,14d及21d时神经功能评分均低于低剂量组及EAE模型组(P<0.05),而低剂量组与EAE模型组比较差异无统计学意义(P>0.05)。造模后14d及21d,EAE模型组血清IL-2、Hcy水平及脊髓NF-kB阳性表达水平均较健康对照组升高(P<0.05),高剂量组低于低剂量组与EAE模型组(P<0.05),而低剂量组与EAE模型组差异无统计学意义(P>0.05)。21d时,高剂量组、低剂量组、EAE模型组上述各项指标均较14d时下降,差异有统计学意义(P<0.05)。结论高剂量阿托伐他汀钙能降低大鼠EAE的发病率及病情严重程度,可能与其抗炎及免疫调节机制有关。
脑脊髓炎,自身免疫性,实验性;NF-κB;炎性因子;阿托伐他汀钙;大鼠
多发性硬化(multiple sclerosis,MS)于1868 年由法国医生 Charcot首次提出,至今仍是整个医学界未解的难题之一。MS 的主要病理特征为自身免疫炎性反应所致的髓鞘脱失和轴突损伤等,特别是在发病早期发生的轴突变性及神经元损伤是 MS 患者神经功能障碍的重要原因。现就阿托伐他汀钙对MS的经典动物模型——实验性自身免疫性脑脊髓炎大鼠(experimental autoimmune encephalomyelitis,EAE) 脊髓内NF-κB表达及血清炎性因子水平影响的观测,探讨 MS 的发病机制,寻求针对 MS 有效的治疗方案。
1 材料与方法
1.1 材料 健康雌性Wistar大鼠82只, 7~8周龄,体质量160~200g,清洁级,由北京维通利华实验动物技术有限公司提供。豚鼠10只,雌雄各半,24~36周龄,体质量360~380g,清洁级,由温州医学院实验动物中心提供。试剂:白介素-2(IL-2)、同型半胱氨酸(Hcy)试剂盒购自上海天呈生物技术有限公司。兔抗大鼠NF-κB 抗体及二步免疫组化检测试剂盒购于北京博奥森生物技术公司。完全福氏佐剂购于美国 Sigma 公司;卡介苗购于北京生物制品研究所;阿托伐他汀钙由大连辉瑞制药有限公司提供。
1.2 实验方法 豚鼠全脊髓匀浆参照文献[1]方法制备,经10%水合氯醛3~5 ml腹腔注射麻醉处死后,冰上迅速剥除脊膜,取出脊髓,按1∶1比例加入等量0.9%氯化钠用超声细胞粉碎仪在冰槽中制成50%的全脊髓匀浆,与等量含0.4g/100ml卡介苗的完全福氏佐剂混合充分至油包水乳剂;随机抽取10只大鼠作为健康对照组,其余大鼠经上述试剂乳化后按0.8 ml/只4h内注射于大鼠双后足垫内皮下诱导建立EAE模型,并随机分成3组,即EAE模型组、低剂量阿托伐他汀组(低剂量组)、高剂量阿托伐他汀组(高剂量组),每组24只,免疫后当日高剂量组予阿托伐他汀钙8 mg/kg 灌胃治疗,低剂量组予阿托伐他汀钙3mg/kg 灌胃治疗,EAE模型组及健康对照组给予生理盐水灌胃,每日1次持续至动物处死。5分评分法评分≥1分为造模成功。大鼠于造模成功后第14、21天以10%水合氯醛3~5 ml腹腔麻醉后每组各取12只断头处死,取脊髓,常规石蜡封片包埋,每25 μm间断性连续切片,同时予以常规HE染色;同时心脏采血2 ml,离心后获取血清,-70℃冰箱保存。
1.3 观测指标
1.3.1 动物行为学观察和神经症状评分:观察大鼠临床表现及行为。模型评分采用5分评分法:1分:动物尾部无力下垂或无力挺立;2分:后肢无力;3分:后肢瘫痪;4分:四肢瘫痪;5分:濒死状态或死亡。
1.3.2 血清炎性因子水平及NF-κB阳性表达情况:血清IL-2、Hcy测定采用双抗夹心酶联免疫吸附法。试剂盒购自上海天呈生物技术有限公司,严格按照试剂盒说明进行测定。NF-κB阳性细胞采用免疫组化法检测,严格按照试剂盒说明操作,同时设阴性对照。取大鼠腰髓切片在显微镜下计数每张片内随机5个高倍视野(×400) NF-κB阳性细胞数,NF-κB的表达以该片阳性细胞数总和/5表示,取10片平均值。

2 结 果
2.1 动物发病情况及神经症状评分 健康对照组大鼠无发病,活动度正常。其余3组8~15 d发病,发病后3~8 d可有缓解,部分症状持续进展,少数缓解后复发,部分大鼠死亡。各组比较,高剂量组发病率及病死率明显低于低剂量组及EAE模型组(P均<0.05),同日神经功能评分明显低于低剂量组及EAE模型组(P均<0.05),而发病率、病死率及神经功能评分低剂量组与EAE模型组比较差异无统计学意义(P﹥0.05)。见表1。
2.2 血清炎性因子水平及NF-κB阳性表达情况比较 免疫大鼠发病后14~21d血清IL-2及Hcy均高于健康对照组(P<0.05),发病21d后上述炎性因子较14d时有所降低(P均<0.05),其中2个时间段高剂量组均低于低剂量组及EAE模型组(P均<0.05)。大鼠于免疫14d后NF-κB 阳性细胞明显增多,呈弥漫性分布,多见于白质、灰白质交界处及血管“袖套”处,随着病程的延长,到21d阳性细胞数又逐渐减少(P<0.05)(图1、2见封3)。高剂量组大鼠在免疫后14d和21d,NF-κB 细胞数明显低于EAE模型组及低剂量组(P均<0.05)。而低剂量组与EAE模型组差异均无统计学意义(P>0.05)。见表2。
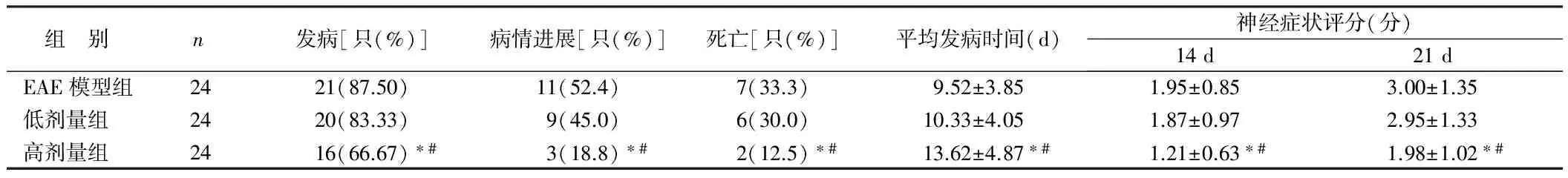
表1 各组Wistar大鼠 EAE发病情况及其神经症状评分
注:与EAE模型组比较,*P<0.05;与低剂量组比较,#P<0.05

表2 各组Wistar大鼠不同时间段血清炎性因子水平及NF-κB表达情况
注:与健康对照组比较,*P<0.05;与EAE模型组比较,#P<0.05;与低剂量组比较,△P<0.05;与14d比较,☆P<0.05
3 讨 论
MS是一类主要由T细胞介导的自身免疫性疾病,T细胞针对中枢神经髓鞘成分的抗原抗体反应在MS的发病过程中起到了关键的作用。其主要发病机制是某种外部因素作用下激活的T细胞透过血脑屏障进入到脑组织,结合中枢的抗原形成细胞抗原,再刺激T细胞分泌出大量的炎性细胞因子,促使B细胞和巨噬细胞的活化,进一步使外周血中的T淋巴细胞、单核细胞以及B淋巴细胞等进入到炎性反应部位,从而导致中枢神经轴索的损害以及神经组织的炎性脱髓鞘反应[2]。在这些炎性细胞因子中,比较有代表性的是白介素(IL)、肿瘤坏死因子(TNF)及同型半胱氨酸(Hcy)等,目前研究证实 Hcy作为炎性细胞因子,不但与动脉硬化密切相关,而且严重影响着患者的认知功能[3,4]。意大利精神病学家对一个大样本健康老年人的研究发现,随着Hcy水平的升高,简易精神状况检查评分逐渐降低,Hcy成为认知功能损害的独立危险因素[5],而IL-2是T细胞介导的炎性反应中重要一环,由Th1类细胞分泌,在炎性反应启动过程中有着至关重要作用,因此,我们从中挑选IL-2及Hcy作为其中代表性的因子,探讨这些炎性因子在多发性硬化发病过程中的水平变化。同时探讨阿托伐他汀钙对神经细胞的保护作用及对血清炎性因子水平的影响。
凌振芬等[6]研究证明,抗氧化药物α硫辛酸能显著改善EAE大鼠的神经功能,其机制可能与抗炎及免疫调节有关。历芳等[7]研究表明,阿米洛利能够减缓小鼠EAE病情,其机制可能与下调中枢神经系统IL-17和IFN的表达,上调IL-10的表达有关。近年来关于他汀类药物抗炎及抗氧化的作用日益受到医学界的重视[8],同时,其对于多发性硬化的干预作用时见报道[9~11]。阿托伐他汀作为他汀类药物中最有效的调脂药物之一,能有效地控制动脉硬化斑块的形成及进展,并能使不稳定斑块转变为稳定性斑块。近年来发现它具有抗炎及双向免疫调节作用,他汀类药物的抗炎作用可能是通过抑制 HMG-CoA还原酶,阻断类异戊二烯中间代谢产物的生成,进而阻断Ras、Rho、Rac 等蛋白的异戊二烯化,调节 Thl /Th2平衡,影响细胞的增殖、分化和迁移作用[12]。Neuhaus 等[13]研究证实,他汀类药物可剂量依赖性地抑制活化 T 细胞的增殖,减少 T细胞上黏附分子的表达,有效下调 B 细胞、T 细胞上趋化因子受体。本结果发现高剂量组与低剂量组及 EAE模型组相比MS发病日期后延,神经系统评分有明显下降,病理检查所示病灶数也显著减少,同时血清炎性因子水平明显降低,显示高剂量阿托伐他汀具有干预治疗大鼠 EAE 的作用。造模成功大鼠于14d后脊髓内 NF-κB阳性细胞大量活化,而高剂量组NF-κB 阳性细胞明显减少,其临床症状也较 EAE模型组及低剂量组减轻,这说明了阿托伐他汀可能抑制了 NF-κB 阳性细胞增殖活化,从而减轻了炎性反应。NF-κB 作为一个核转录因子,具有多种功能,其在炎性反应中起重要作用。他汀类药物通过抑制Th0细胞向 Thl 细胞分化,减少 Thl 类细胞因子(IL-2、IFN-γ等) 的分泌,同时增加Th2类因子(IL-4、IL5、IL10等)的分泌,双向调节免疫反应[14],因此利于疾病的恢复。有研究证明[15],阿托伐他汀促进星形胶质细胞的增殖,进而产生多种抗炎性细胞因子,通过这些抗炎因子的保护作用,能有效减低神经髓鞘的损伤,从而减轻临床症状,有利于 EAE 的恢复。因此,笔者认为阿托伐他汀减轻 EAE 的临床症状和病理改变,可能与其对于血清炎性因子水平的影响,即抗炎作用有关。
总之,阿托伐他汀可降低大鼠脊髓内 NF-κB 阳性细胞数及血清IL-2、Hcy等炎性因子水平,提示抗炎治疗在EAE治疗中的重要作用,为寻求更有效治疗多发性硬化的药物开辟了新的路径。
1 徐玉,刘瑞春,王颖,等.Wistar大鼠实验性自身免疫性脑脊髓炎模型的建立 [J].脑与神经疾病杂志,2007,15(6):415-418.
2 吴彦青,高颖,朱陵群.实验性自身免疫性脑脊髓炎小鼠中枢神经组织中ZO-1mRNA的变化及益肾达络饮对其的影响[J].中国中医急症,2012,21(12):1936-1938.
3 Kittner SJ,Giles WH,Macko RF,et al.Homocysteine andrisk of cerebral infarction in a biralial population:the stroke prevention in young women study[J].Stroke,1999,30(8):1554-1560.
4 石秋艳,张瑞彪,张启增,等,血清幽门螺杆菌IgG及同型半胱氨酸水平与老年血管性痴呆及脑梗死的关系[J].第二军医大学学报,2008,29(2):230-231.
5 Ravaglia G,Forti P,Maioli F,et al.Homocysteine andcognitive function in healthy elderly community dwellers in Italy[J].Am J Clin Nutr, 2003,77(3):668-673.
6 凌振芬,赵永波,徐新蕾,α-硫辛酸对实验性自身免疫性脑脊髓炎大鼠模型干预的初步研究[J].上海医学,2010,33(1):78-80.
7 厉芳,郑荣远,张正学.阿米洛利对实验性自身免疫性脑脊髓炎小鼠中枢神经系统中细胞因子表达的影响[J].中国临床神经科学,2012,20(2):121-125.
8 陈曦,郑毅.他汀类药抗炎和免疫调节作用的研究进展[J].中华风湿病学杂志,2007,11(8):499-502.
9 邓艳,张旭.他汀类药物在多发性硬化治疗中的研究进展[J].中国神经免疫学和神经病学杂志,2008,15(2):112-115.
10 田广平,石秋艳,王淑歌.阿托伐他汀对EAE大鼠脊髓ICAM-1和TGF-β1表达的影响[J].中华神经医学杂志,2011,10(10):979-983.
11 林述凯,石秋艳,王淑歌,等.阿托伐他汀对实验性自身免疫性脑脊髓炎大鼠脊髓内NF-κB表达的影响[J].吉林大学学报:医学版,2011,37(4):607-611.
12 Beutler B. Inferences,questions andpossibilities in Toll-like recep-tor signaling[J]. Nature,2004,430(6996): 257-263.
13 Neuhaus O, Strasser-Fuchs S, Fazekas F, et al. Statins as immunomodulators : comparison with interferon-beta 1b in MS[J].Neurology, 2002, 59:990-997.
14 邓艳,张旭.他汀类药物在多发性硬化治疗中的研究进展[J].中国神经免疫学和神经病学杂志,2008,15(2):112-115.
15 王淑歌,林述凯,石秋艳,等. 阿托伐他汀对实验性自身免疫性脑脊髓炎大鼠的影响[J].安徽医科大学学报,2011,46(10):997-1000.
InfluenceofatorvastatincalciumontheexpressionofspinalcordNF-κBandseruminflammatoryfactorsinexperimentalautoimmuneencephalomyelitisrats
SHIQiuyan*,ZHANGRuibiao,TIANGuangping.
*DepartmentofSevereNeurology,AffiliatedHospitaltoHebeiUnionUniversity,Tangshan063000,China
ObjectiveTo detect the influence of different doses of atorvastatin calcium on spinal cordnuclear factor kappa B (NF-κB) expression andserum inflammatory factors levels in experimental autoimmune encephalomyelitis (EAE) rats.MethodsTen of 82 Wistar rats were sampledas healthy control group,the other 72 rats were inducedEAE model by 50% guinea pig spinal cordhomogenate, then dividedinto EAE model group,high-dose atorvastatin group(high-dose group),low-dose atorvastatin group(low-dose group),with 24rats in each group, using quantitative evaluation methodcompareddifferent doses of atorvastatin calcium on serum inflammatory factors in rats with EAE,including interleukin -2(IL-2), homocysteine(Hcy) andNF-κB level of the spinal cord, andcomparedthe incidence andincubation period.ResultsAfter EAE model was established,the incidence andmortality rate of high-dose group was obviously lower than low-dose group andEAE group,andthe neural function score was lower than low-dose group andEAE group at 14dand21d(P<0.05),but there was no difference between low-dose group andEAE group (P>0.05). 14dand21dafter modeling,the serum IL-2,Hcy andspinal cordNF-κB expression level in EAE group were elevatedthan healty control group(P<0.05),high-dose group was lower than low-dose group andEAE group(P<0.05), but there was no difference between low-dose group andEAE group(P>0.05).Comparedwith 14d,all above indexes in high-dose group,low-dose group andEAE group in 21dwere obviously declined(P<0.05).ConclusionHigh-dose atorvastatin calcium can reduce the incidence andseverity of EAE rats,it may be relatedto anti-inflammatory andimmune regulation mechanism.
Encephalomyelitis,autoimmune,experimental;Nuclear factor kappa B;Inflammatory factors;Atorvastatin calcium;Rats
河北省医学科学研究重点项目计划(No.20100473)
063000 唐山,河北联合大学附属医院重症神经科(石秋艳);063200 唐山市曹妃甸区医院神经内分泌科(张瑞彪); 066600 昌黎,秦皇岛市第二人民医院神经内科(田广平)
10.3969 / j.issn.1671-6450.2014.01.025
2013-09-10)

