内质网应激预处理对丙烯腈氧化性损伤的保护作用
方云涛,张盼盼,赵文君,王苏华,邢光伟,马静,陆荣柱
(江苏大学医学院卫生检验系,江苏镇江212013)
内质网应激预处理对丙烯腈氧化性损伤的保护作用
方云涛,张盼盼,赵文君,王苏华,邢光伟,马静,陆荣柱
(江苏大学医学院卫生检验系,江苏镇江212013)
目的:利用内质网应激诱导剂2-脱氧葡萄糖(2-deoxy-D-glucose,2-DG)预处理探究内质网应激对丙烯腈氧化性损伤的保护效应及其作用机制。方法:将36只SD雄性大鼠随机分为6组,即空白组、2-DG组、50 mg/kg丙烯腈组、75 mg/kg丙烯腈组、2-DG+50 mg/kg丙烯腈组、2-DG+75 mg/kg丙烯腈组。采取腹腔注射的方式给予2-DG预处理和急性丙烯腈染毒,空白组注射生理盐水。2-DG预处理为100 mg/kg每天定时腹腔注射1次,持续1周,随后丙烯腈染毒;丙烯腈组腹腔注射丙烯腈(质量浓度为50、75 mg/kg)1 h后麻醉大鼠并断头处死,迅速在冰上分离脑和肝,利用蛋白印迹法检测葡萄糖调节蛋白78(glucose-regulated protein,Grp78)的表达,同时测定肝脏和大脑中丙二醛、还原性谷胱甘肽(GSH)含量和SOD活性。结果:与空白组比较,2-DG对大鼠肝脏和大脑中Grp78的表达具有明显的诱导作用(P<0.05),丙烯腈染毒明显增加大鼠肝脏和大脑中丙二醛含量(P<0.05),但却明显降低GSH含量和SOD活性(P<0.05)。经2-DG预处理后丙烯腈染毒大鼠肝、脑中的丙二醛含量增加幅度减小,且GSH含量和SOD活性的降低也有所缓解。结论:内质网应激诱导能拮抗丙烯腈诱导的氧化性损伤。
内质网应激;2-脱氧葡萄糖;丙烯腈;葡萄糖调节蛋白78
丙烯腈是一种重要的有机化工原料,是生产腈纶纤维、塑料和树脂等化工产品的重要原料[1]。但是丙烯腈也具有毒性,作用类似于氢氰酸,属于高毒腈类有机化合物,会损害神经系统、消化系统与呼吸循环系统,并且具有致癌性[2-3]。内质网应激(endoplasmic reticulum stress)是指细胞内蛋白质加工运输或钙稳态失衡,生理功能紊乱的病理过程。当细胞稳态被破坏时,发生错误折叠的蛋白质在内质网中积累,钙离子外流,蛋白质糖基化被抑制,蛋白质转运被阻断,诱发内质网应激[4]。适度的内质网应激是细胞为适应环境压力而进行自我保护的重要手段。已有研究发现,适度上调内质网应激蛋白的表达能够保护外源性化学物所致的神经、肝脏以及肾脏的损伤,因而诱导内质网应激可能成为保护内源性细胞的重要手段[5]。为此,在前期研究的基础上,本研究采用2-脱氧葡萄糖(2-deoxy-D-glucose,2-DG)诱导内质网应激,并观察这种预诱导对丙烯腈急性氧化性毒性的拮抗效应,为丙烯腈中毒的治疗与预防提供理论依据。
1 材料与方法
1.1 主要仪器和试剂
Bio-Rad垂直电泳系统、台式冷冻离心机(美国Beckman公司);722可见分光光度计(上海新茂仪器有限公司);丙二醛试剂盒、还原性谷胱甘肽(GSH)试剂盒以及超氧化物歧化酶(SOD)试剂盒均购于南京建成生物工程研究所;总蛋白抽提试剂盒购于上海康成生物工程有限公司;2-DG(美国Sigma公司),兔抗大鼠葡萄糖调节蛋白78(glucoseregulated protein,Grp78)抗体(美国Cell Signaling Technology公司),HRP标记羊抗兔二抗(美国Santa Cruz公司)。
1.2 实验分组及处理
36只雄性SD大鼠,购自江苏大学实验动物中心,体质量180~220 g,分为空白组、2-DG组、50 mg/kg丙烯腈组,75 mg/kg丙烯腈组、2-DG+50 mg/kg丙烯腈组,2-DG+75 mg/kg丙烯腈组。
空白组:腹腔注射生理盐水。2-DG组:按体质量腹腔注射2-DG(100 mg/kg),每24 h 1次,持续1周;最后一次给药8 h后麻醉断头处死大鼠,迅速在冰上分离脑和肝储存备用。丙烯腈组腹腔注射丙烯腈(质量浓度为50、75 mg/kg)并在1 h后麻醉断头处死,迅速在冰上分离脑和肝,储存待用。2-DG+丙烯腈组:每天腹腔注射2-DG 1次,持续给药1周,最后一次给药8 h后予丙烯腈染毒1 h。后续步骤同其他组。
1.3 内质网应激标志性蛋白Grp78的检测
称取-80℃保存的肝、脑组织各100 mg,加入预冷组织蛋白裂解液(每1 mL蛋白质裂解液中加入5μL蛋白酶抑制剂,5μL PMSF和5μL磷酸酶),在组织匀浆器中研磨,匀浆均匀后转移至1.5 mL离心管中,4℃,12 000×g离心15 min,取上清,转移至新的离心管中,每管约200μL,取少量利用BCA试剂盒进行蛋白定量,随后加入蛋白质电泳上样缓冲液,煮沸10 min,储存于-80℃备用。采用蛋白质印迹法检测肝、脑组织中Grp78的表达情况。
1.4 大鼠大脑和肝脏中丙二醛含量的检测
采用硫代巴比妥酸(TBA)法,取0.2 mL组织匀浆上清液,按照丙二醛测试盒说明书要求,加入试剂,快速混匀器混匀,95℃水浴60 min,流水冷却,3 500 r/min离心10 min,取上清液,波长532 nm处,1 cm光径,蒸馏水调零,测定各管光密度值,通过标准计算公式求出TBA反应产物(TBARS)的含量。结果以组织匀浆液每mg蛋白中TBARS的nmol数表示。
1.5 大鼠大脑和肝脏中GSH含量的检测
采用5-硫代2-硝基苯甲酸比色法(DTNB)检测大鼠脑组织和肝组织GSH含量。在10%组织匀浆中,加入5%三氯乙酸,2 000 r/min离心20 min,取上清液。按照GSH试剂盒要求,加入试剂,快速混匀器混匀,在波长420 nm,1 cm光径下,蒸馏水调零,测定各管光密度值,结果以每mg蛋白中GSH的nmol数表示。
1.6 检测大鼠大脑和肝脏中的SOD活性
黄嘌呤及黄嘌呤氧化酶反应系统产生的超氧阴离子自由基(O2-)可氧化羟胺形成亚硝酸盐,后者在显色剂作用下生成紫红色的产物,样品中含有的SOD对O2-有专一的抑制作用,从而使亚硝酸盐的形成减少,通过测定样品管与对照管的光密度值,计算被测样品的SOD活性。在波长500 nm,1 cm光径下检测光密度值,结果以每mg蛋白的SOD活性为单位表示。实验试剂及配制,操作步骤,以及实验数据的处理方法参见南京建成科技有限公司生产的试剂盒说明书。
1.7 统计学分析
采用SPSS 14.0软件进行统计分析,所有数据均采用均数±标准差表示,进行单因素方差分析及两两比较的q检验。P<0.05为差异有统计学意义。
2 结果
2.1 2-DG诱导大鼠肝脏Grp78表达
蛋白质印迹结果显示,2-DG诱导了大鼠体内内质网应激反应的发生(图1,图2)。在100 mg/kg 2-DG预处理时,大鼠肝脏区域Grp78的表达明显上升(P<0.05)。而大脑中Grp78的表达亦显示上升趋势,但与对照组比较,差异并无统计学意义(P>0.05)。
2.2 2-DG对丙烯腈染毒大鼠肝、脑组织丙二醛含量的影响
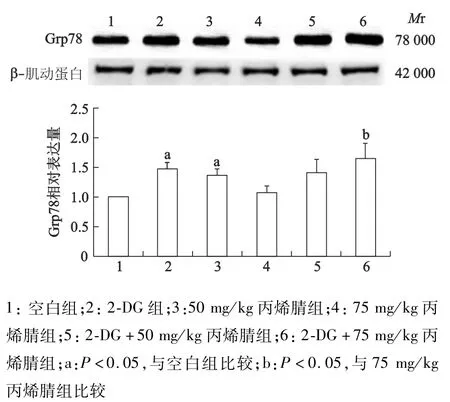
图1 2-DG及不同剂量丙烯腈对大鼠肝脏Grp78表达的影响
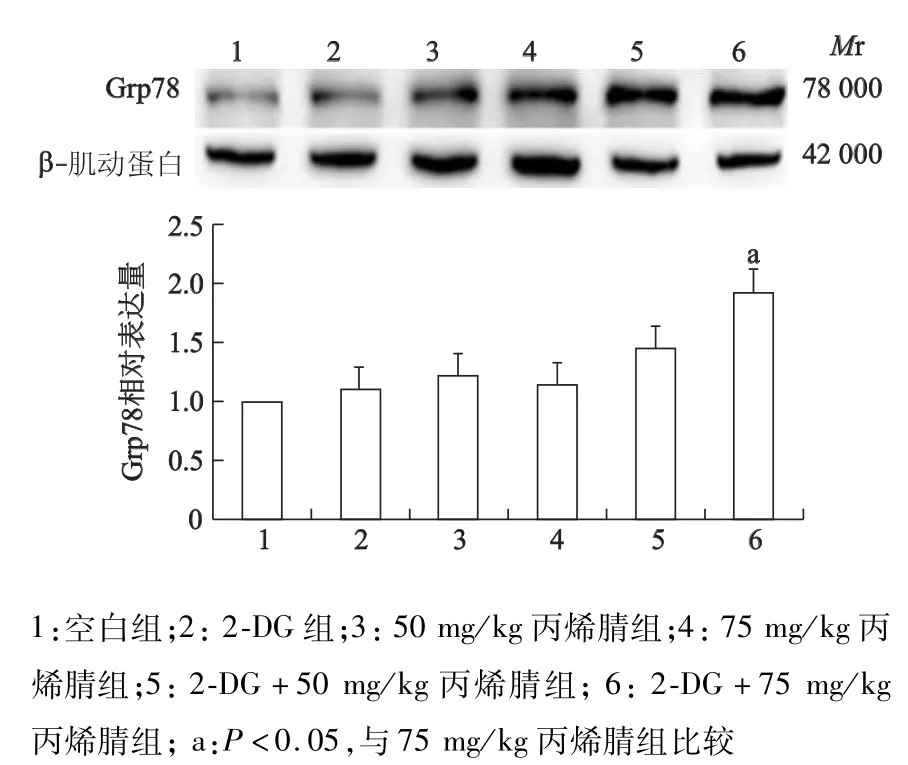
图2 2-DG及不同剂量丙烯腈对大鼠脑组织Grp78表达的影响
与空白组比较,丙烯腈染毒导致脑组织和肝组织中脂质过氧化产物丙二醛含量明显升高(P<0.05),以脑组织中增加更明显(P<0.05),并且随着丙烯腈浓度的增大丙二醛含量也随之增加。与相应的丙烯腈组比较,2-DG+丙烯腈组的丙二醛含量均有所下降,但只有2-DG+50mg/kg丙烯腈组差异有统计学意义(P<0.05)。见图3。

图3 2-DG预处理对丙烯腈染毒大鼠脑和肝脏丙二醛含量的影响
2.3 2-DG预处理对丙烯腈染毒大鼠肝、脑组织GSH含量的影响
单独2-DG处理肝和脑组织对GSH含量基本没有影响,丙烯腈处理组肝组织和脑组织中GSH含量较空白组明显下降(P<0.05),且肝脏GSH下降较脑组织更明显。2-DG+50 mg/kg丙烯腈和2-DG+75 mg/kg丙烯腈组脑组织中GSH含量较丙烯腈组明显增加(P<0.05),而肝组织中2-DG+75 mg/kg丙烯腈组GSH含量的增加具有统计学意义(P<0.05)。见图4。
2.4 2-DG对丙烯腈染毒大鼠肝、脑中SOD活性的影响
与对照组比较,丙烯腈染毒组脑组织和肝组织中SOD活性有所下降。其中,75 mg/kg丙烯腈组SOD活性下降具有统计学意义(P<0.05),50 mg/kg组的差异无统计学意义。与对应的丙烯腈组比较,2-DG+50 mg/kg丙烯腈处理组和2-DG+75 mg/kg丙烯腈处理组的SOD活性均明显升高,差异有统计学意义(P<0.05)。见图5。
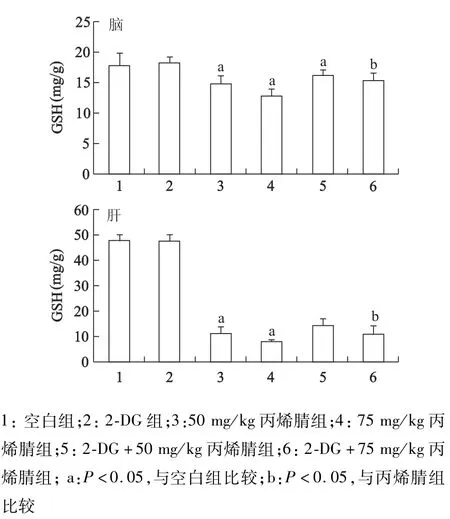
图4 2-DG预处理对丙烯腈染毒大鼠脑和肝脏中GSH含量的影响
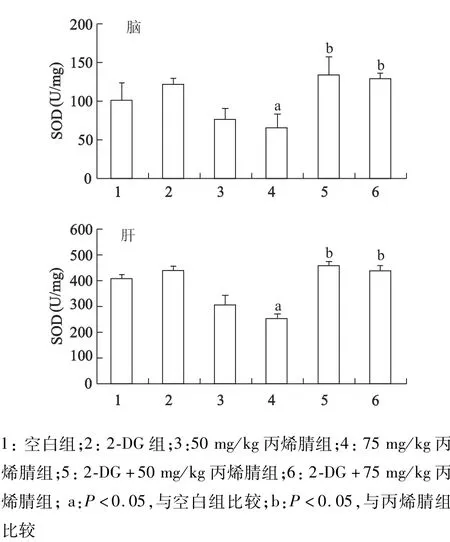
图5 2-DG预处理对丙烯腈染毒大鼠脑和肝脏中SOD活性的影响
3 讨论
丙烯腈的毒性主要与其在体内代谢产生的CN-有关,中毒症状与无机氰化物类似,主要作用于细胞线粒体呼吸链,CN-抑制细胞色素C氧化酶,中断呼吸链中电子的传递,使生物氧化过程完全中止,诱发细胞内窒息导致细胞死亡[6-7]。
慢性丙烯腈中毒可出现头痛,头晕,乏力,失眠多梦等症状,还具有一定的致癌性[3]。长期的致癌实验结果显示,通过饮水、灌胃、吸入等方式进行染毒,均会诱导大鼠发生不同类型的肿瘤,神经胶质瘤与丙烯腈的相关性更为明显[8-9]。作为一种剧毒性有机氰,丙烯腈的主要靶器官为中枢神经系统,急性丙烯腈中毒时,中枢神经系统最早出现症状,且症状最为突出。大鼠急性染毒主要表现为流涎、多汗等胆碱能神经兴奋症状,随后出现抽搐、呼吸衰竭,最终死亡[10]。丙烯腈急性中毒后也会引起人体肌力及肌张力减弱、感觉障碍、原始反射减退等周围神经损害症状,还会导致消化系统和呼吸循环系统异常[11]。对职业人群进行的流行病学调查也证实丙烯腈可引起疲劳、记忆力减退等精神神经症状[12]。虽然对丙烯腈的毒性机制已经研究得越来越深入,但其确切机制仍未明了。有研究提示,缺氧、低糖、化学毒物等应激信号可使内质网内错误折叠蛋白增多,诱发未折叠蛋白反应(unfolded protein response,UPR)[13]。最近相继有研究提示,激发细胞的内质网应激是提高细胞适应能力和进行细胞保护的重要手段,诱导内质网应激蛋白的表达能够保护外源性化学物质所致的神经、肝脏以及肾脏的损伤[13]。这些结果提示内质网应激诱导可提高细胞活力,拮抗体内外有害因素的损害。
Grp78也称为重链结合蛋白,是内质网功能的中心调节者。由于其在蛋白质折叠、聚集、促进非折叠蛋白降解、内质网Ca2+调节和控制内质网跨膜感受器的激活等过程中具有重要作用,因此Grp78的诱导被广泛用作内质网应激和UPR启动的生物标记[12]。本研究结果显示,大鼠腹腔注射2-DG可诱导脑、肝脏细胞的内质网应激,Grp78表达明显增强可启动UPR;UPR既是细胞抵抗应激保护自身,也是应激损伤细胞恢复自身功能的重要机制。本实验通过动物模型进行2-DG预诱导来探讨激活内质网应激通路对丙烯腈毒性的作用,结果证实内质网应激诱导剂2-DG诱导了大鼠肝脏和脑中内质网应激的发生,从而保护了丙烯腈诱导的氧化性损伤。
GSH是一种由谷氨酸、半胱氨酸及甘氨酸组成的三肽,参与体内三羧酸循环及糖代谢,使人体获得高能量[13]。作为细胞内一种重要的代谢调节物质,GSH能激活多种酶,从而促进糖类、脂肪及蛋白质代谢,并能影响细胞的代谢过程。GSH还能参与体内氧化还原过程,与过氧化物及自由基结合以对抗氧化剂对巯基的破坏,保护细胞膜中含巯基的蛋白质和含巯基酶不被破坏。因此,GSH也是机体内一种重要的非酶类抗氧化剂[14]。本实验发现丙烯腈处理组脑组织GSH含量明显下降,可能由于线粒体遭破坏,生成的GSH减少,或者是由于丙烯腈诱导产生过多的自由基导致GSH耗竭。本实验结果显示大鼠经丙烯腈急性染毒后,肝脏和脑组织中SOD活性明显降低,丙二醛生成明显增多,说明在本实验条件下丙烯腈(50,75 mg/kg)会诱发神经细胞氧化应激损伤的产生。2-DG预处理上调内质网应激后可明显抑制丙烯腈诱导的丙二醛含量的生成、GSH的消耗和SOD活性的降低,提示内质网应激具有拮抗丙烯腈氧化毒性的作用。无论在大鼠脑组织还是肝组织,2-DG都能减轻丙烯腈诱导的氧化性损伤,证实氧化应激是丙烯腈神经毒性的一个重要机制。本研究利用2-DG预处理证明其可通过诱导内质网应激反应减轻丙烯腈毒性,为丙烯腈中毒的防治提供了新的线索和救治途径。
[1]AN Group.About acrylonitrile[EB/OL].http://www.angroup.org/about/index.cfm
[2]Al-Abbasi FA.Acrylonitrile-induced gastric toxicity in rats:the role of xanthine oxidase[J].Med Sci Monit,2012,18(6):BR208-214.
[3]Whysner J,Steward RE 3rd,Chen D,et al.Formation of 8-oxodeoxyguanosine in brain DNA of rats exposed to acrylonitrile[J].Arch Toxicol,1998,72(7):429-438.
[4]Cao SS,Kaufman RJ.Endoplasmic reticulum stress and oxidative stress in cell fate decision and human disease[J].Antioxid Redox Signal,2014.[Epub ahead of print]
[5]Mei Y,Thompson MD,Cohen RA,etal.Endoplasmic reticulum stress and related pathological processes[J].J Pharmacol Biomed Anal,2013,1(2):1000107.
[6]陆荣柱,金复生,陈自强.丙烯腈的神经毒性研究概况[J].中华劳动卫生职业病杂志,2002,20(1):73-75.
[7]Caito SW,Yu Y,Aschner M.Differential inflammatory response to acrylonitrile in rat primary astrocytes andmicroglia[J].Neurotoxicology,2014,42:1-7.
[8]Tong Z,Huailan Z,Hongjun J.Chronic toxicity ofacrylonitrile and acetonitrile to Daphnia magna in 14-d and 21-d toxicity tests[J].Bull Environ Contam Toxicol,1996,57(4):655-659.
[9]Johannsen FR,Levinskas GJ.Chronic toxicity and oncogenic dose response effects of lifetime oral acrylonitrile exposure to Fischer 344 rats[J].Toxicol Lett,2002,132(3):221-247.
[10]Ghanayem BI,Farooqui MY,Elshabrawy O,et al.Assessment of the acute acrylonitrile-induced neurotoxicity in rats[J].Neurotoxicol Teratol,1991,13(5):499-502.
[11]Blair A,Stewart PA,Zaebst DD,et al.Mortality of industrial workers exposed to acrylonitrile[J].Scand J Work Environ Health,1998,24(Suppl2):25-41.
[12]Schönthal AH.Endoplasmic reticulum stress:its role in disease and novel prospects for therapy[J].Scientifica(Cairo),2012,2012:857516.
[13]Kitamura M.The unfolded protein response triggered by environmental factors[J].Semin Immunopathol,2013,35(3):259-275.
[14]Yu ZF,Luo H,Fu W,et al.The endoplasmic reticulum stress-responsive protein GRP78 protects neurons againstexcitotoxicity and apoptosis:suppression of oxidative stress and stabilization of calcium homeostasis[J].Exp Neurol,1999,155(2):302-314.
Effects of endoplasm ic reticulum stress pretreatment on oxidative toxicity of acrylonitrile in rats
FANGYun-tao,ZHANGPan-pan,ZHAOWen-jun,WANGSu-hua,XINGGuang-wei,MA Jing,LU Rong-zhu
(Department of Public Health Laboratory Sciences,School of Medicine,Jiangsu University,Zhenjiang Jiangsu 212013,China)
Objective:To explore the effects of pretreatment of endoplasmic reticulum stress on oxidative toxicity of acrylonitrile in rats.M ethods:Thirty-six SD rats were randomly divided into six groups as follows:blank control group,2-DG alone treated group,two acrylonitrile treated groups,2-DG pretreated and acrylonitrile treated groups.The animalswere intraperitoneally injected daily with 2-DG at the dosage of100 mg/kg for1 week,then ratswere intraperitoneally injected with acrylonitrile(50,75 mg/kg),and they were decapitated 1 h after the lastadministration of acrylonitrile or normal saline.The brain and liver tissueswere immediately dissected out and weighted on ice.The expression of glucose-regulated protein-78(Grp78)was determined by Western blotting.Oxidative toxicity of acrylonitrile was assessed by the reduced glutathione levels(GSH),products of lipid peroxidation(MDA),and superoxide dismutase(SOD)activity in the brain and liver.Results:Levels of protein expression of Grp78 increased after pretreatmentwith 2-DG compared with thatof control group(P<0.05).A significant increase in levels ofMDA was observed in the acrylonitrile-treated group both in the brain and liver compared with the control group(P<0.05).These increaseswere accompanied by a significant decrease in GSH contentand a significant reduction in SOD activity in the same tissues(P<0.05).However,when rats were pretreated with 2-DG,increase of MDA and decrease of GSH contents and SOD activity was significantly attenuated both in liver and brain,compared with acrylonitrile administration alone.Conclusion:Pretreatment with 2-DG reversed the acrylonitrile-induced effects by reducing the levels of MDA and enhancing SOD activity and increasing GSH content bothin the brain and liver.
endoplasmic reticulum stress;2-dexoxy-D-glucose;acrylonitrile;glucose-regulated protein 78
TQ086.5
A
1671-7783(2014)04-0302-05
10.13312/j.issn.1671-7783.y140112
国家自然科学基金资助项目(30872139;81273124)
方云涛(1988—),男,硕士研究生;陆荣柱(通讯作者),博士,教授,硕士生导师,E-mail:lurz@mail.ujs.edu.cn
2014-04-29 [编辑]陈海林

