壬基酚对大鼠5-羟色胺分解代谢通路的影响
赖玉婷,欧阳俊彦,郭佑廷,杨童旺,林 媛,吕宝怡,柳春红,2*(.华南农业大学食品学院,广东 广州50642;2.广东省食品质量安全重点实验室,广东 广州 50642)
壬基酚对大鼠5-羟色胺分解代谢通路的影响
赖玉婷1,欧阳俊彦1,郭佑廷1,杨童旺1,林 媛1,吕宝怡1,柳春红1,2*(1.华南农业大学食品学院,广东 广州510642;2.广东省食品质量安全重点实验室,广东 广州 510642)
为探讨壬基酚对5-羟色胺(5-HT)代谢网络分解代谢通路的毒性作用机制,将24只SD雄性大鼠分为阴性对照组和壬基酚低、中、高剂量组[30,90,270mg/(kg·bw)],隔日玉米油灌胃染毒28d后检测大鼠血浆及肝匀浆中单胺氧化酶(MAO)活性和血浆中5-HT含量,并称量肝、肾和睾丸重量.结果显示,壬基酚暴露高剂量组大鼠体质量增量极显著低于对照组(P<0.01);染毒至第 3周起,各组大鼠平均食物利用率有统计学意义(P<0.05);与对照组相比,高剂量组肝脏、肾脏脏器系数均有统计学意义(P<0.01),中、高剂量组睾丸脏器系数均有统计学意义(P<0.05);中、高剂量组血浆MAO酶活性极显著低于对照组(P<0.01),中、高剂量组肝匀浆MAO酶活性显著低于对照组(P<0.05);中、高剂量组血浆5-HT含量极显著高于对照组(P<0.01).壬基酚暴露剂量与大鼠体内MAO酶活性及5-HT水平均呈剂量-效应关系,壬基酚可通过分解代谢通路影响5-HT的代谢网络.
壬基酚;单胺氧化酶;5-羟色胺;毒性作用
壬基酚(NP)是烷基酚类化合物中最有代表性的环境雌激素,现已列入联合国环境保护署优先控制的27种持久性有毒污染物[1-3],NP广泛用于化学工业,制备合成洗涤剂、增湿剂、润滑油添加剂、增塑剂等[4],通过生活和工业污水排放到环境中,对生物体产生危害.目前研究显示,NP 可对生物体产生广泛的不良作用:包括影响内分泌、生殖和发育、心血管系统及神经系统、影响免疫及促癌作用等[5-9].对NP的尿液代谢组学及代谢轮廓研究发现,5-羟色胺(5-HT)可能是 NP暴露的尿液生物标志物之一[10-11];基于此,本课题组又通过动物NP染毒试验、尿液5-HT检测及剂量-效应关系研究鉴定了5-HT作为NP暴露的尿液生物标志物的有效性[12].5-HT 由Ersparmer和Vialli于1937年首次分离,其在机体内的代谢网络已有清晰的研究[13].但目前关于NP对于5-HT代谢网络的毒性作用途径及其机制尚未见报道.本研究通过观察NP对大鼠体内单胺氧化酶(MAO)活性及5-HT水平的影响,初步探讨NP对5-HT代谢网络分解代谢通路的毒性作用机制,为合理、准确应用5-HT这一尿液生物标志物以监测 NP暴露情况提供基础研究依据.
1 材料与方法
1.1 主要试剂与仪器
NP(纯度>99.9%),美国 Sigma公司(CAS: 84852-15-3);大鼠 MAO ELISA试剂盒、大鼠5-HT ELISA试剂盒,上海江莱生物科技有限公司;考马斯亮蓝试剂盒,南京建成生物工程研究所;手动匀浆器,广州精科化玻仪器公司;5417R冷冻高速离心机,德国Eppendorf公司;Multiskan Mk3型酶标仪,美国Thermo Fisher公司;U3010紫外分光光度仪,日本日立公司;EL204-IC电子天平,瑞士METTLER TOLEDO公司;DK-600电热恒温水浴箱,上海精宏实验设备有限公司.
1.2 实验方法
1.2.1 实验动物分组及染毒 SPF级SD雄性大鼠24只[许可证编号:SCXK(粤)2008-0002],体质量170~210g.动物及其饲料均购自广东省医学实验动物中心.放置于动物房代谢笼中适应性饲养1周后,按体重采用随机区组设计分组法分为 4组:阴性对照组和壬基酚低、中、高剂量组,每组6只.低剂量组(NPL):30mg/(kg·d);中剂量组(NPM):90mg/(kg·d);高 剂 量 组 (NPH):270mg/ (kg·d);阴性对照组(C):等体积玉米油.于上午09:00灌胃,隔日灌胃染毒 28d,期间大鼠自由饮水、摄食,光/暗周期为 12h/12h,室内温度为(22± 0.5)℃,湿度为45%~55%.每周于同一时间点称量大鼠体质量及饲料消耗量,每日观察大鼠的精神状态、活动情况、被毛润泽度等.
1.2.2 MAO酶活性及5-HT水平的测定 28d染毒完毕后,各组大鼠采用眼眶取血法取血,断颈椎处死,处死前大鼠禁食 12h,处死后解剖取肝脏、肾脏及睾丸,并称重.用预冷的PBS溶液冲洗肝脏去除血迹,滤纸拭干,取适量肝脏用PBS溶液在冰浴中制成 10%的肝匀浆,在 2000r/min、4℃下离心 20min,取上清液待测.用加入 EDTA-K2抗凝剂的采血管采血,在 3600r/min、4℃下离心10min,取上清液待测.MAO酶活性的检测采用大鼠MAO ELISA试剂盒,5-HT水平的检测采用大鼠5-HT ELISA试剂盒,肝匀浆的蛋白浓度采用考马斯亮蓝法.
1.3 观察指标
1.3.1 毒性指标 中毒症状:食欲、活动、被毛、分泌物、精神状态等;大鼠体质量:每周称量大鼠体质量,于上午同一时间称量;食物利用率:大鼠每食入100g饲料所增加的体质量克数;脏器系数:某脏器湿重在每100g体质量中所在的质量,观察肝脏、肾脏及睾丸系数.
1.4 统计学分析
采用SPSS17.0软件进行统计学分析.多组间比较采用单因素方差分析.进一步进行组间两两比较,若方差齐时,采用LSD检验;若方差不齐,采用Tamhane’s检验,差异显著水平为P<0.05,极显著水平为P<0.01.
2 结果与讨论
2.1 大鼠外观
对照组大鼠在染毒期间未见异常表现.染毒组大鼠则活动减少,眼睛分泌物增多,出现不同程度的脱毛,被毛不顺滑、黯哑无光泽,饮食量减少,体型相对偏小;染毒初期,染毒组大鼠普遍表现出亢奋、焦躁,灌胃后期表现出精神萎靡,对声音反应迟钝.
2.2 体质量变化
各组大鼠NP暴露前后平均体质量及其增量结果见表 1.各组大鼠体质量在染毒结束后均有增长,对照组大鼠体质量增量较各染毒组高;随染毒剂量增加,大鼠体质量增量减少,NP暴露高剂量组大鼠的体质量增量极显著低于对照组(P<0.01).
表1 NP对大鼠体质量的影响(±s)Table 1 Body weight changes of rats by exposure to different doses of NP(±s)

表1 NP对大鼠体质量的影响(±s)Table 1 Body weight changes of rats by exposure to different doses of NP(±s)
注:与对照组相比,**P<0.01
?
体质量是毒理学安全性评价和实验动物生长评价重要的且易于判断的指标[14].实验动物的体质量受到多种因素影响,如药物作用、粮食适口性、能量消耗变化等.本研究各组大鼠所处环境相同,均自由饮食,而对照组大鼠体质量增量较染毒组高,随染毒剂量增加,大鼠体质量增量减少,这与以往关于NP对实验动物体质量影响的研究结果一致[15].
2.3 食物利用率变化
由表 2可见,各染毒组大鼠食物利用率随染毒时间增长而降低;同一时期内,随染毒剂量增加,大鼠食物利用率降低.染毒至第 3周起,NP暴露低剂量组大鼠平均食物利用率显著低于对照组(P<0.05),且随暴露量增加,食物利用率降低(P<0.05).
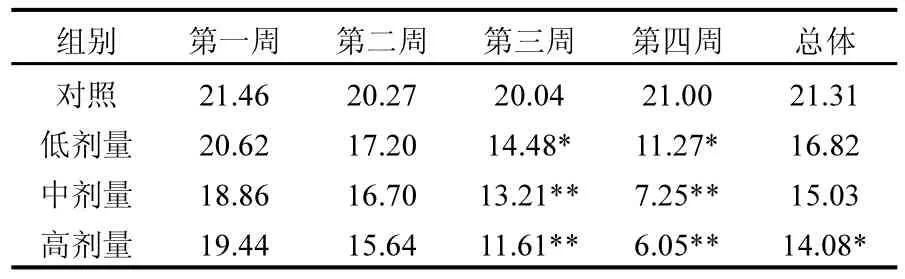
表2 NP对大鼠食物利用率的影响(%)Table 2 Food utilization rate changes of rats by exposure to different doses of NP(%)
食物利用率也是动物毒理学评价的重要指标之一,食物利用率的变化受多种因素影响.本研究各组大鼠所处环境相同,均自由饮食,而各染毒组大鼠食物利用率有递减的剂量-效应关系及时间-效应关系,说明这是由NP引起的毒效应作用体现,与以往的研究结果相符[15].
2.4 脏器系数
由表3可见,随染毒剂量增加,大鼠肝脏及肾脏脏器系数均呈现递增的剂量-效应趋势,睾丸脏器系数呈现递减的剂量-效应趋势.与对照组相比,NP暴露高剂量组大鼠肝脏及肾脏脏器系数均有极显著性差异(P<0.01),中、高剂量组大鼠睾丸脏器系数均有显著性差异(P<0.05).
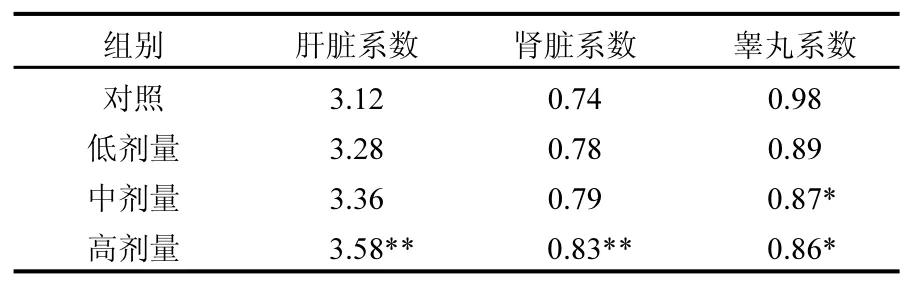
表3 NP对大鼠脏器系数的影响 (%)Table 3 Organ coefficient changes of rats after exposure to different doses of NP (%)
若受试物使某个脏器受到损害,如增生、充血、水肿、萎缩等,则脏/体比值会发生改变,可增大或减小,因此,脏器系数是一个判别动物脏器受损的有效指标[16].本研究结果显示,随染毒剂量增加,大鼠肝脏及肾脏脏器系数均呈现递增的剂量-效应趋势,睾丸脏器系数呈现递减的剂量-效应趋势,且其变化有统计学意义,表明NP短期重复染毒对大鼠的肝脏、肾脏和睾丸均产生亚慢性毒性损伤作用,与以往研究结果一致[17-18].
2.5 MAO酶活性及5-HT含量变化
表4 NP对大鼠MAO酶活性的影响(±s)Table 4 MAO activity changes of rats by exposure to different doses of NP(±s)

表4 NP对大鼠MAO酶活性的影响(±s)Table 4 MAO activity changes of rats by exposure to different doses of NP(±s)
注:与对照组相比,*P<0.05,**P<0.01
?
由表4可见,随染毒剂量增加,大鼠血浆及肝匀浆MAO酶活性均下降,与对照组相比,NP暴露中、高剂量组大鼠血浆及肝匀浆MAO酶活性均有显著性差异(P<0.05).由表 5可见,随染毒剂量增加,大鼠血浆5-HT水平呈现递增的剂量-效应趋势,NP暴露中、高剂量组大鼠血浆5-HT水平均极显著高于对照组(P<0.01).
表5 NP对大鼠血浆5-HT水平的影响(±s)Table 5 5-HT level changes of rats by exposure to different doses of NP(±s)

表5 NP对大鼠血浆5-HT水平的影响(±s)Table 5 5-HT level changes of rats by exposure to different doses of NP(±s)
注:与对照组相比,**P<0.01
组别 5 -H T水平( p g / m L )对照 1 3 . 0 5 5 ± 1 . 2 5低剂量 1 4 . 2 4 2 ± 0 . 5 5中剂量 1 5 . 7 5 8 ± 1 . 0 1 * *高剂量 1 6 . 7 2 7 ± 0 . 9 0 * *
5-HT又称血清素(Serotonin),是人体重要的活性物质,也是神经递质的重要组成部分,广泛存在于哺乳动物组织中[19].5-HT 以色氨酸(Tryptophan,Trp)为原料,在色氨酸羟化酶(Tryptophan hydroxylase, TPH)及5-羟色胺酸脱羧 酶 (5-Hydrotryptophen decarboxylase, 5-HTPDC)的作用下被合成,之后经单胺氧化酶MAO催化成 5-羟吲哚乙酸(5-Hydroxyindole acetic acid,5-HIAA)而随尿液排出体外[20]. MAO是一种能够催化单胺类物质氧化脱氨反应的酶,于1928年由Hare在肝细胞中发现,在人体内分布极广,MAO的酶活性极大地影响着单胺系统(多巴胺,去甲肾上腺素和 5-HT)的代谢,MAO功能障碍被认为与神经系统疾病有关[21].调查研究表明,NP化学结构与 17β-雌二醇(17β-estradiol, E2)相似,可竞争性抑制 E2与靶器官的雌激素受体(Estrogen receptor,ER)结合,形成配体-受体复合物与DNA结合区的DNA反应元件结合,诱导或抑制靶基因的转录,启动一系列雌激素依赖性生理生化过程,因此,NP在机体内常模拟E2对多种系统发挥作用[22].国内外有研究显示,E2可通过激活TPH酶活性及抑制MAO酶活性从而提高神经系统的5-HT水平,且抑制MAO酶活性的作用大于对TPH酶活性的激活[23];以 E2干预大鼠3周,下丘脑MAO活性较对照组下降28%,E2干预恒河猴 28d,外侧丘脑、丘脑室旁核、丘脑腹内侧核的MAO活性显著下降,证明在不同种属动物中,雌激素可以抑制MAO的酶活性[24-25].但 Gagné等[26]给淡水贻贝分别一次性注射 E2和 NP,观察 48h后发现两者对淡水贻贝的神经节和性腺的MAO酶水平并无显著影响,原因可能是E2及NP的注射剂量相对其他研究的染毒剂量较低,且为一次性注射,并无重复染毒,相对染毒作用时间较短,未能观测出E2和NP对机体MAO酶活性的抑制作用.本研究显示,随NP染毒剂量增加,大鼠血浆 MAO酶活性及肝匀浆MAO酶活性均下降,而 5-HT含量则出现递增的剂量-效应关系,表明 NP可通过抑制机体内MAO酶活性,从而使机体内5-HT水平升高,提示NP可通过作用于分解代谢通路而影响5-HT的代谢网络,其机制可能是NP作为一种环境雌激素,在大鼠体内模拟 E2发挥作用,抑制 MAO酶活性,使得 5-HT分解代谢受阻,在体内积累,导致5-HT水平升高,从而对5-HT在机体内的代谢网络产生毒性作用,但其更为深入的机制还需作进一步的研究.
3 结论
3.1 NP对大鼠有一定毒性作用,使大鼠日常活动表现异常,精神萎靡;随NP暴露剂量增加,大鼠体质量增量及食物利用率均下降,呈现出剂量-效应关系及时间-效应关系;经过NP暴露,大鼠肝脏及肾脏脏器系数均呈现递增的剂量-效应趋势,睾丸脏器系数呈现递减的剂量-效应趋势,NP短期重复染毒可对大鼠的肝脏、肾脏和睾丸产生亚慢性毒性损伤作用.
3.2 NP可通过作用于分解代谢通路而影响5-HT的代谢网络.随NP暴露剂量增加,大鼠血浆及肝脏MAO酶活性均下降,而5-HT水平则出现递增的剂量-效应关系. NP可通过抑制机体内MAO酶活性,使5-HT分解代谢受阻,在体内积累,导致5-HT水平升高,从而对5-HT在机体内的代谢网络产生毒性作用.由此可见,从毒效应机制来看,尿液中5-HT作为反映NP暴露情况的生物标志物是可行的.
参考文献:
[1]柳春红,王伟华,褚 玥,等.深圳居民膳食壬基酚和辛基酚暴露的风险评估 [J]. 中国环境科学, 2013,33(7):1316-1322.
[2]吴海珍,梁世中,韦朝海.壬基酚的环境行为及生物降解研究进展 [J]. 化工环保, 2006,26(1):31-34.
[3]马 强,白 桦,王 超,等.液相色谱-串联质谱法同时测定纺织品和食品包装材料中的壬基酚、辛基酚和双酚A [J]. 分析化学, 2010,38(2):197-201.
[4]闫 鹏,郑 剑,杨元斌,等.壬基酚与辛基酚致小鼠睾丸细胞DNA损伤联合作用 [J]. 中国预防医学杂志, 2009,10(7):632-634.
[5]Soares A, Guieysse B, Jefferson B, et al. Nonylphenol in the environment: A critical review on occurrence, fate, toxicity and treatment in wastewaters [J]. Environ. Int., 2008,34(7):1033-1049.
[6]David A, Fenet H, Gomez E. Alkylphenols in marine environments: distribution monitoring strategies and detection considerations [J]. Mar. Pollut. Bull., 2009,58(7):953-960.
[7]李正炎,傅明珠,卫 东.胶州湾及其邻近河流中壬基酚等有机污染物的分布特征 [J]. 海洋与湖沼, 2008,39(6):599-603.
[8]Chandrasekar G, Arner A, Kitambi S S, et al. Developmental toxicity of the environmental pollutant 4-nonylphenol in zebrafish [J]. Neurotoxicol. Teratol., 2011,33(6):752-764.
[9]Gong Y, Jiang W, Huang Y F, et al. Nonylphenol induces apoptosis in rat testicular Sertoli cells via endoplasmic reticulum stress [J]. Toxicol. Lett., 2009,186:84-95.
[10]王伟华,柳春红,孙远明,等.大鼠尿液中壬基酚的代谢轮廓 [J].高等学校化学学报, 2011,32(10):2280-2285.
[11]柳春红,王伟华,孙远明,等.壬基酚和辛基酚联合染毒的尿液代谢组学研究 [J]. 分析化学, 2012,40(1):113-118.
[12]褚 玥,欧阳俊彦,赖玉婷,等.壬基酚和辛基酚暴露的生物标志物——尿液5-HT [J]. 环境科学学报, 2013,33(6):1780-1786.
[13]王 强,唐爱国.5-羟色胺的检测及临床意义 [J]. 国外医学临床生物化学与检验学分册, 2004,25(2):149-151.
[14]林 健,黄宗锈,张荣标,等.大鼠进食量、食物利用率趋势及其与体重相关的分析 [J]. 海峡预防医学杂志, 2005,12(6):33-34.
[15]夏海玲,田海林,王爱清,等.壬基酚对雌性SD大鼠脾脏及脾淋巴细胞损伤作用的研究 [J]. 环境与健康杂志, 2011,28(12):1078-1081.
[16]梁 添,欧阳俊彦,羿利华,等.邻苯二甲酸二(2-乙基)己酯短期重复暴露对大鼠行为的影响 [J]. 南方医科大学学报, 2013, 33(3):401-405.
[17]Xiao D H, Zhi G T, Yi G, et al. The toxic effects of nonylphenol on the reproductive system of male rats [J]. Reprod. Toxicol., 2004,19:215-221.
[18]许 洁,范奇元,周远忠,等.壬基酚对雄性仔鼠生殖毒性的研究[J]. 毒理学杂志, 2008,22(1):23-25.
[19]李陕区,杨 博,许昌泰.神经递质 5-羟色胺研究现状 [J]. 临床医学工程, 2010,17(5):145-147.
[20]钟静瑜,黄俊山.5-羟色胺与睡眠的研究进展 [J]. 医学综述, 2010,16(10):1471-1473.
[21]李 影,穆 萨,唐爱国.5-羟吲哚乙酸的研究进展 [J]. 实用预防医学, 2010,17(1):2131-2134.
[22]夏茵茵,詹 平.壬基酚对机体影响的研究进展 [J]. 国外医学卫生学分册, 2004,31(3):135-139.
[23]Kun H, Ping G, Shi Q S, et al. Mechanism-based pharmacokinetic-pharmacodynamic modeling of the estrogenlike effect of ginsenoside Rb1on neural 5-HTin ovariectomized mice [J]. Eur. J. Pharm. Sci., 2011,44:117-126.
[24]Holsehneider D P, Kumazawa T, Chen K, et al. Tissue-specific effects of estrogen on monoamine oxidase A and B in the rat [J]. Life Sci., 1998,63(3):155-160.
[25]Gundlah C, Lu N Z, Bethea C L. Ovarian steroid regulation of monoamine oxidase-A and -B mRNAs in the macaque dorsal raphe and hypothalamic nuclei [J]. Psychopharmacology, 2002, 160(3):271-82.
[26]Gagné F, Blaise C. Effects of municipal effluents on serotonin and dopamine levels in the freshwater mussel Elliptio complanata [J]. Comp. Biochem. Phys. C, 2003,136:117-125.
5-Hydroxytryptamine catabolic changes of rats by short-term exposure to nonylphenol
LAI Yu-ting1, OUYANG Jun-yan1, GUO You-ting1, YANG Tong-wang1, LIN Yuan1, LÜ Bao-yi1, LIU Chun-hong1,2*(1.Food College, South China Agricultural University, Guangzhou 510624, China;2.Guangdong Provincial Key Laboratory of Food Quality and Safety, Guangzhou 510642, China). China Environmental Science, 2014,34(9):2408~2412
Effects of nonylphenol (NP) on monoamine oxidase (MAO) activity and 5-hydroxytryptamine (5-HT) level of rats were investigated. The toxic mechanisms of NP on catabolism of 5-HT were also analyzed. 24 male SD rats were randomly divided into 4groups, namely NP low-dose group 30mg/(kg·bw), NP medium-dose group 90mg/(kg·bw), NP high-dose group 270mg/(kg·bw) and control group (equal volume of the solvent). NP in corn oil was administrated orally to rats once every other day for 28days, and rats in control group was only given corn oil. The increment of rat body weight in NP high-dose group was lower than that of control group (P<0.01). From the third week of exposure, significant differences were found for the food utilization rates, the liver, kidney and testis coefficients between treatment groups and control group (P<0.05, P<0.01, P<0.01, P<0.05). Compared with control group, significantly lower MAO activities of plasma and liver homogenate and higher 5-HT levels were observed in treatment groups (P<0.01, P<0.05, P<0.01). NP exposure has a dose-dependent effect on MAO activity and 5-HT level of rats, suggesting that NP may affect the metabolic network of 5-HT by inhibiting its catabolism.
nonylphenol;monoamine oxidase;5-hydroxytryptamine;toxic effect
X171.5
A
1000-6923(2014)09-2408-05
赖玉婷(1988-),女,广东韶关人,华南农业大学食品学院硕士研究生,主要从事营养与食品安全研究.
2014-01-20
广东省自然科学基金项目(S2011010001045);广东省科技计划项目(2012B090600005,2012B091400001)
* 责任作者, 教授, liuch@scau.edu.cn

