脱硫混合菌系构建及其脱除H2S的性能研究
胡慧欣,冯丹丹,赵丹,郝亚杰,高超,孙士男,翟贺玲,晏磊
(黑龙江八一农垦大学生命科学技术学院,大庆 163319)
A.ferrooxidans 和A.thiooxidans 均为化能自养细菌,在环境中普遍存在,但其必须生长在pH 较低的条件下,二者都能对还原态的硫化物进行氧化。因此,在气体的生物脱硫研究中日益受到重视[1]。H2S(hydrogen sulfide),分子式为H2S,有臭蛋味,能溶于水,是一种具有刺激性和窒息性的无色剧毒气体[2],在沼气天然气等燃气中往往含有大量的H2S,在煤气造气冶金等工业中也有H2S 产生[2-3]。H2S 不仅极大地威胁到人类健康,还能够腐蚀作业管道。为此,我国环保标准中规定,气体中H2S 的含量不得超过20 mg·m-3,国家环境卫生标准规定,H2S 气体含量在居民区的空气中不得超过0.000 01 mg·L-1;在工厂车间不得超过0.01 mg·L-1;在城市煤气中不得超过0.02 mg·L-1。因此,在生产作业等各场所中必须对H2S 进行脱硫处理。传统的脱除H2S 的方法很多,有醇胺法碳酸盐法砜胺法Claus 法和常温氧化铁法等[3-4]。生物脱硫是近些年发展起来的H2S 处理新技术,采用微生物将H2S 转化为硫酸或单质硫。A.ferrooxidans 以氧化二价铁以及还原态硫的化合物等来获得能量[5],A.thiooxidans 则以氧化元素硫及还原态硫的化合物来获得能量。因此,这两种嗜酸微生物在生物浸矿重金属污染的治理以及烟气H2S 的脱除等领域有着广泛的应用前景。
研究了A.ferrooxidans 和A.thiooxidans 混合菌系构建及其脱除H2S 的性能,在此基础上获得脱除H2S 的最佳条件,以期为工业脱除H2S 提供理论参考。
1 材料与方法
1.1 材料
1.1.1 菌株
Acidithiobacillus ferrooxidans ATCC23270 和Acidithiobacillus thiooxidans ATCC19377,均购买自美国典型培养物保藏中心,实验室活化保藏。
1.1.2 培养基
0K 培养基:(NH4)2SO43 g,K2HPO40.5 g,MgSO4·7H2O 0.5 g,KCl 0.1 g,Ca(NO3)20.01 g,蒸馏水1 L,用20%的硫酸调节溶液所需pH。
A.ferrooxidans 培养基(9K 培养基)[6]:向0K 培养基中加入FeSO4·7H2O,使其浓度达到44.3 g·L-1。
A.thiooxidans 培养基[7]:向0K 培养基中加入Na2S2O3·5H2O,使其浓度达到5 g·L-1。
混菌培养及H2S 脱除用培养基:0K 培养基中加入FeSO4·7H2O 和Na2S2O3·5H2O,使二者浓度分别达44.3 g·L-1和5 g·L-1。
1.2 混合菌系构建
将培养至对数期的A.ferrooxidans 和A.thiooxidans 通过定性滤纸过滤后于4 ℃条件下10 000 rpm 离心15 min,收集菌体,并将其悬浮于pH 2.0 的0K 培养液中,显微镜进行计数。将两种菌按不同的比例进行混合,考察其对混菌培养基中Fe2+和S2O32-的氧化及对H2S 的脱除效果。A.ferrooxidans和A.thiooxidans 的数量比设计为4 组,分别Ⅰ(1∶1)、Ⅱ(1∶2)、Ⅲ(1∶3)、Ⅳ(2∶1)。混菌培养实验在摇床上进行,各组比例混菌悬液接种至混菌培养基中,接种量为10%,培养100 h 后取样测定。
1.3 混合菌系脱除H2S
H2S 脱除实验采用自制反应器,取在摇床上培养至对数期的混菌培养液,加至反应器中,以40 mL·min-1的通气量通入初始H2S 浓度为8 g·m3-1的气体,反应器运行温度为28 ℃,时间为3 h。
1.4 分析方法
亚铁离子测定采用重铬酸钾滴定法分析[8],细菌消耗的二价铁与二价铁总量的比值表示其氧化百分数;S2O32-的氧化能力通过体系pH 来表征;通过H2S检测仪测定H2S 浓度,按下式计算脱硫率:脱硫率=[(M1-M2÷M1)]×100%,其中M1为气体进入反应器时H2S 的质量,M2为反应器排气口气体中H2S 的质量。
2 结果与分析
2.1 A.ferrooxidans 和A.thiooxidans 的混合比例对Fe2+和S2O32-氧化的影响
培养基中含有Fe2+和S2O32-两种底物,A.ferrooxidans 能利用Fe2+和S2O32-,而A.thiooxidans 只能利用S2O32-,且前者的最佳生长pH 为2.0~2.5,后者为2.0~2.8,因此,两种菌数的不同配伍必将对底物利用及体系pH 产生影响。图1 为不同混合比例的细菌对培养基中Fe2+氧化的影响,由图可知,经过100 h的摇床培养后,Ⅱ组混菌Fe2+氧化率可达99.6%,Fe2+氧化率越高体系中Fe3+浓度越高,而Fe3+是强氧化剂,可以氧化H2S 等还原态硫化物。尽管A.ferrooxidans 在Fe2+和S2O32-双底物存在时会优先利用Fe2+,但从实验并未发现随着A.ferrooxidans 比例的增加,Fe2+的氧化率增加。原因可能是,溶液中Fe2+量一定,并且有可溶性的S2O32-存在,当A.ferrooxidans 数量增加时,有限的Fe2+不能完全满足大量A.ferrooxidans 的需求,使得A.ferrooxidans 只能利用S2O32-维持生长。在从图2 可以看出,体系pH 均从2.0 下降到了1.5 以下,说明各比例组合的细菌能有效的氧化S2O32-为S2O42-,从而引起体系pH 下降。由图2 还可以看出,混合菌pH 下降幅度随A.thiooxidans 比例增加而增大,说明在S2O32-转化为S2O42-过程中,A.thiooxidans 起着主要作用。虽然Ⅲ组pH 最低,但对于混菌而言,过低的pH 会影响A.ferrooxidans 和A.thiooxidans 的生长和活力,从而会影响到混合菌的脱硫效果,结合Fe2+氧化情况,我们选择Ⅱ组为最佳的混合比例。

图1 细菌混合比例对亚铁氧化率的影响Fig.1 Effects of bacterial mixture ratio on the oxidation of ferrous iron
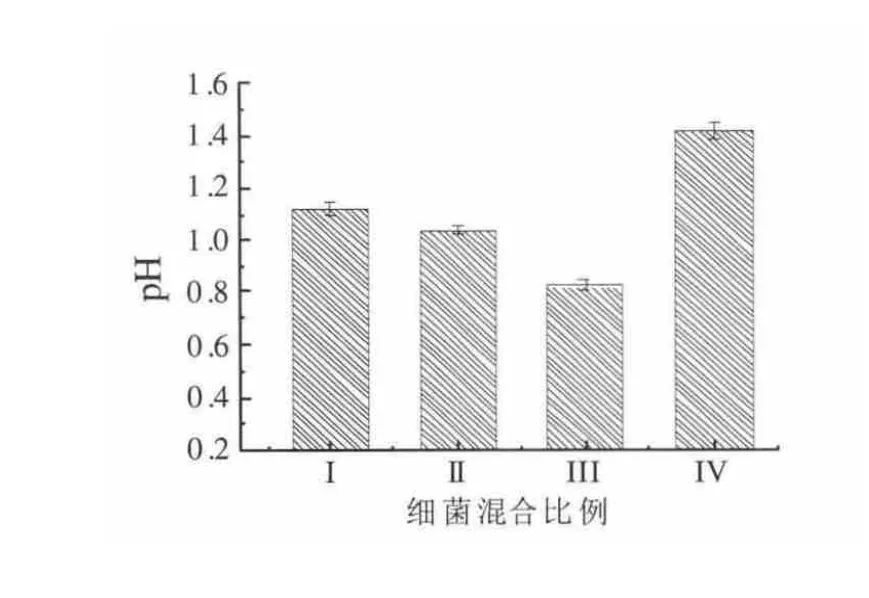
图2 细菌混合比例对硫代硫酸钠氧化的影响Fig.2 Effects of bacterial mixture ratio on the oxidation of sodium thiosulfate
2.2 A.ferrooxidans 和A.thiooxidans 的混合比例对H2S 脱除率的影响
图3 为不同比例混合菌脱除H2S 的时间动态,从图中可以看出,各种组合混合菌的H2S 脱除率随反应器运行时间的增加而增加,Ⅰ、Ⅲ及Ⅳ组混菌对H2S 脱除率增加较为平缓,且增加幅度较小,而Ⅱ组混菌H2S 脱除率在60 min 时为24.96%,经过30 min后,迅速上升至63.68%,到180 min 时,H2S 几乎被完全脱除。从图中还可以得知,H2S 脱除率升高并不依赖于混菌中某一菌数量的加,而是两种菌需达到最佳的协作状态,即A.ferrooxidans 必须及时有效的将体系中Fe2+氧化为Fe3+,使其能及时的参与到H2S 的脱除反应中,而A.thiooxidans 也必须迅速将溶液中H2S 作为底物进行氧化,以便维持体系pH 在2.0 左右,防止由于Fe2+氧化为Fe3+造成的体系pH 上升进而产生沉淀,影响H2S 脱除效率。由此我们选择Ⅱ组为H2S 脱除的混合菌,其在反应器中H2S 的脱除率能达99.2%。

图3 细菌混合比例对H2S 脱除的影响Fig.3 Effects of bacterial mixture ratio on the removal of H2S
3 讨论
A.ferrooxidans 和A.thiooxidans 均为化能自养菌,虽然在环境中普遍存在,但其必须生长在pH 较低的环境中,且培养过程中菌体得率不高,但二者都能对还原态的硫化物进行氧化[9]。因此,在气体的生物脱硫研究中日益受到重视。当A.ferrooxidans 和A.thiooxidans 生长在同一个体系中时,二者必然会竞争利用底物。因此,我们采用Fe2+和S2O32-双底物培养基用于构建和培养混合菌系。实验结果表明,A.ferrooxidans 和A.thiooxidans 在双底物培养基中生长时,二者菌体数量的不同会引起体系中Fe2+和S2O32-氧化情况的差异,只有当二者比例达到一个合适值时,两者才能协作利用培养基中的底物,一方面使体系中Fe2+迅速氧化,另一方面利用S2O32-,使细菌获得能量生长,同时维持体系pH。
通过比较不同比例组合的混合菌对H2S 脱除的影响,结果显示,A.ferrooxidans 和A.thiooxidans 比例为1∶2 的混合细菌对H2S 的脱除率最高,其次为1∶1 和1∶3 的组合,而比例为2∶1 的脱除效果最差。采用混合菌脱除H2S,是为了充分利用A.ferrooxidans 和A.thiooxidans 的生理生化共性及特性,两者都能在同一pH 下生长和发挥效能[10]。在研究中,底物中适量的Fe2+可快速激发A.ferrooxidans 的活性,而获得的Fe3+又可迅速同H2S 反应,提高H2S 的处理效率;底物中S2O32-在移入反应器前几乎全被转化为SO42-,从而能有力的维持H2S 处理液的酸度,而进入对数期的A.thiooxidans 即可快速利用溶入培养液中的H2S[11]。在A.ferrooxidans 和A.thiooxidans 的共同作用下,体系中H2S 得以处理,并且A.ferrooxidans还可以循环利用体系中再生的Fe2+,降低处理投入。
[1]刘正辉.东江氨氮污染河段的微生物群落特征[D].广州:华南理工大学,2011.
[2]TangK,BaskaranV,NematiM.Bacteriaofthesulphurcycle:Anover-viewofmicrobiology,biokineticsandtheirrolein petroleum and mining industries [J].Biochemical EngineeringJournal,2009,44(1):73-94.
[3]SyedM,SoreanuG,FallettaP,etal.Removalofhydrogen sulfidefrom gasstreamsusingbiologicalprocesses[J].CanadianBiosystemsEngineering,2006,48:21-24.
[4]黄新,朱道平.H2S脱除方法评述[J].化学工业与工程技术,2004,25(5):47-49.
[5]苑璞,苑琳,邵静,等.氧化亚铁硫杆菌的分离及其培养条件优化[J].生物技术,2010,20(2):47-50.
[6]ArocaG,UrrutiaH,NúezD,etal.Comparisononthe removalofhydrogensulfideinbiotricklingfiltersinoculated withThiobacillus thioparus and Acidithiobacillus thiooxidans[J].Electronic JournalofBiotechnology,2007,10(4):514-520.
[7]晏磊,刘权,张爽,等.响应面法对Acidithiobacillus ferrooxidans 发酵液脱除H2S的优化研究[J].生物技术,2012,22(6):86-88.
[8]YanL,YinHH,ShuangZ,etal.Organoarsenicresistance and bioremoval of Acidithiobacillus ferrooxidans [J].BioresourceTechnology,2010,101(16):6572-6575.
[9]张静,王清,李晓茹,等.利用硫氧化细菌改良盐碱土[J].吉林大学学报:地球科学版,2009,39(1):147-151.
[10]AlexeyBU,AntonMK.Bioleachingoflowgradeuranium ore containing pyrite using A.ferrooxidans and A.thiooxidans [J].JournalofRadioanalyticalandNuclear Chemistry,2013,295(1):151-156.
[11]晏磊,刘权,张爽,等.氧化硫硫杆菌脱除硫化氢的研究[J].黑龙江八一农垦大学学报,2014,26(1):14-17.

