干酪乳杆菌表面展示IBDV VP2蛋白
林红丽,王嵩,王宇鹏,栾云艳,余丽芸,侯喜林
(1.黑龙江八一农垦大学动物科技学院,大庆 163319;2.黑龙江八一农垦大学生命科学技术学院)
鸡传染性法氏囊病(Infection Bursal Disease,IBD)是由传染性法氏囊病毒(IBDV)引起鸡的一种急性、高度接触性传染病,主要发生于3~6 周龄雏鸡。不仅引起大批死亡还可导致免疫抑制[1]。目前市场上用于预防IBDV 的商品疫苗多为中等毒力疫苗。然而此类疫苗免疫时间往往不易掌握,免疫时期不对,就会对鸡法氏囊造成损伤,造成机体免疫抑制[2-4]。鉴于此,研制一种安全有效的抗IBDV 疫苗已经迫在眉睫。预防鸡传染性法氏囊病的基因工程亚单位疫苗以其安全、方便等优点已经成为目前国内外研究的热点。
近十几年,乳酸菌表达系统得到充足的发展。乳酸菌除了可以调节机体胃肠道微生态平衡,抑制病菌之外[5],它还可以作为外源基因表达递送的载体。此外,干酪乳杆菌表达系统不需要诱导剂的诱导,即可成功表达外源蛋白,这样既减少了诱导剂对菌体的侵害,又便于操作,是未来潜在的疫苗表达载体。而VP2 蛋白是IBDV 主要结构蛋白和保护性抗原成分,与病毒中和性抗体的诱导和识别等生物学功能有关,它与另一主要结构蛋白(VP3)一起构成IBDV核衣壳的骨架。有研究证实VP2 蛋白主要暴露在核衣壳的外面,携带病毒主要的中和性抗原表位[6]。本研究将应用pHCE1LB-pgsA(pLA)载体构建干酪乳杆菌表达系统表达IBDV VP2 蛋白,为鸡传染性法氏囊病的基因工程亚单位疫苗的研制奠定基础。
1 材料与方法
1.1 材料
1.1.1 病毒、细菌和表达载体
传染性法氏囊病毒B87 株疫苗株购自哈尔滨维科生物技术有限公司;干酪乳杆菌CICC6105(Lactobacillus casei CICC6105)购自中国工业微生物菌种保藏中心;大肠杆菌DH5α 菌株由实验室保存;干酪乳杆菌表达载体pHCE1LB-pgsA(pLA)由实验室保存;pMD18-T 载体购自宝生物工程(大连)有限公司。
1.1.2 主要试剂
LA Taq DNA 聚合酶(125 U·μL-1)、限制性核酸内切酶BamHⅠ、SalⅠ、T4DNA 连接酶购自宝生物工程(大连)有限公司,鸡源的抗IBDV 多抗血清由黑龙江八一农垦大学预防兽医学实验室赠送,兔源抗pgsA 多抗血清由黑龙江八一农垦大学基因工程实验室赠送;辣根过氧化物酶(HRP)标记的羊抗兔IgG 抗体、辣根过氧化物酶(HRP)标记的羊抗鸡IgG 抗体、FITC 标记的羊抗鸡IgG 二抗、FITC 标记的羊抗兔IgG 购自北京博奥森生物技术有限公司,预染蛋白质Marker 购自Fermentas 公司。
1.2 方法
1.2.1 重组质粒的构建
根据GeneBank 中发表的B87 株VP2 蛋白基因序列(序列号为DQ906921.1),应用Blast 和Oligo 6.0设计一对带有酶切位点的特异性引物(表1),在基因保守区上游和下游引物5′端设计保护性碱基,并加入BamHⅠ和SalⅠ酶切位点(黑色加粗碱基),预计扩增片段为1 345 bp。将目的片段克隆在T 载体上,构建pMD-VP2,在大肠杆菌中增殖。然后将外源基因VP2 构建在pLA 载体上,构建重组质粒pLA-VP2,电转到干酪乳杆菌中,鉴定正确的命名为pLA-VP2。
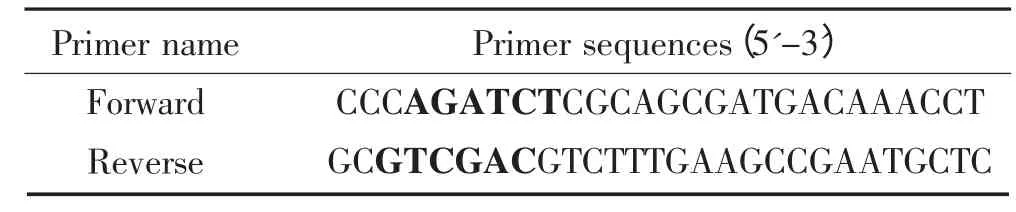
表1 引物序列Table 1 Primer sequences
1.2.2 外源蛋白的表达及反应原性的鉴定
取重组菌pLA-VP2,按2%接种于MRS 液体培养基中,37 ℃过夜静置培养。次日,按2%接种于含34 μgmL-1氯霉素的10 mL MRS 培养基中。取表达6 h 的菌液1 mL,进行SDS-PAGE 检测目的蛋白(5%的浓缩胶,12%的分离胶)。
应用半干式转移电泳槽进行Western blot 检测。取表达6 h 的重组菌和空载体菌的蛋白处理样品进行12%的SDS-PAGE,剪一个尼龙膜和6 个3 mm 厚的滤纸,保持其大小与待转凝胶大小相同。剪好的滤纸与尼龙膜以及待转凝胶一起放入转膜缓冲液中浸润15 min。然后依次在转印槽的阳极板上从下到上放置3 张滤纸,然后是尼龙膜和凝胶,再放置3 张滤纸,最后盖上阴极盖,通电75 min。通电结束后凝胶中的蛋白质就将转移至尼龙膜上。将转移好的膜浸入5%脱脂乳中,在水平摇床上4 ℃条件下缓慢摇动,过夜封闭。次日,将封闭好的膜浸入PBST 中,在水平摇床缓慢摇动3 次,每次10 min;然后将膜浸入以1∶500 稀释的抗IBDV 多抗血清中,室温缓慢振摇2 h;用PBST 溶液洗膜3 次,每次10 min;然后将膜浸入以1∶5 000 稀释的辣根过氧化物酶(HRP)标记的羊抗鸡IgG 抗体中,室温缓慢振摇1 h;PBST 洗涤膜3 次,最后用DAB 显色试剂盒显色,观察结果。pgsA 多克隆抗体检测重组蛋白方法同上。
1.2.3 流式细胞检测表达效率
作为确定检测样品为阳性的阈值标准,应用对照组曲线同实验组曲线交叉法,即以交叉点为界,分别计算出阳性组曲线覆盖面积及对照组延伸到阳性组下的面积,以前者减去后者获得的数据,即为阳性组所占比例。为了使免疫荧光的定量概念更加完整,在阳性百分比基础上加入荧光强度(FI)指标。此值除了以对照组及实验组的曲线峰值的常规方法确定外,更准确的是拟合曲线法估计荧光强度的平均值和标准差。
取MRS 培养基中培养6 h 的重组干酪乳杆菌pLA-VP2 和干酪乳杆菌pLA 各1 mL,经300 目筛网过滤后,6 000 r·min-1离心5 min,收集菌体沉淀。用PBS 吹洗三次,调整细胞浓度为5×106个·mL-1,离心收集菌体,加入PBS(含5% BSA),4 ℃封闭过夜。6 000 r·min-1离心5 min,用PBS 再次吹洗三次,加鸡源的IBDV 多抗血清和兔源的pgsA 多抗血清,4 ℃作用4 h。6 000 r·min-1离心5 min,用PBS吹洗三次,加入FITC 标记羊抗鸡的IgG 荧光二抗(1∶100 稀释)和FITC 标记羊抗兔的IgG 荧光二抗(1∶100 稀释),4 ℃避光作用5 h。6 000 r·min-1离心5 min,用PBS 洗涤三次。取105个细胞,流式细胞仪检测,根据正态曲线计算阳性率。
2 结果
2.1 IBDV VP2 基因扩增及克隆
以反转录的cDNA 为模板,通过设计的特异性引物进行PCR 扩增。扩增产物经1.2%琼脂糖凝胶电泳分析,可见一条约1 345 bp 的特异性条带(图1),与预期DNA 片段大小一致。

图1 RT-PCR 产物的琼脂糖凝胶电泳Fig.1 Agarose gel electrophoresis of RT-PCR product
重组pMD-VP2 质粒经BamHⅠ/SalⅠ双酶切,结果切出大小约为2 692 bp 和1 345 bp,与预期结果相符(图2)。重组质粒pMD-VP2 测序后,应用DNAStar 软件将IBDVB87 株VP2 基因与GenBank中发表的序列号为DQ906921.1 的基因进行比对,其同源性达到99.4%。
2.2 pLA-VP2 重组质粒PCR 鉴定结果
电转后的干酪乳杆菌经增殖后提取质粒进行PCR 鉴定(图3)。以干酪乳杆菌转化子为模板,通过设计的IBDV VP2 基因特异性引物进行PCR 扩增,扩增产物经1.2%琼脂糖凝胶电泳分析,可见约1 345 bp 的特异性条带,与预期结果相符。
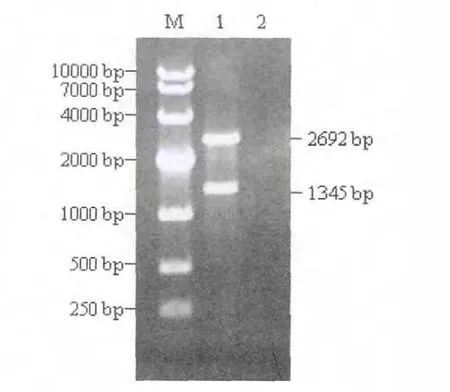
图2 重组质粒pMD-VP2 的酶切鉴定Fig.2 Identification of pMD-VP2 by enzyme digestion

图3 重组干酪乳杆菌转化子pLA-VP2 PCR 鉴定结果Fig.3 Identification of recombinant plasmid by PCR
2.3 重组蛋白的Western blot 检测结果
取经表达6 h 的重组菌经SDS-PAGE 后,切胶,经尼龙膜转印后,分别与鸡源抗IBDV 多抗血清(图4 A),DAB 显色试剂显色后,在预期位置出现明显的条带(约90 kDa),与预计大小一致,而含空质粒pLA对照未见条带;再经兔源的pgsA 多抗血清(图4 B)作用,DAB 显色试剂盒显色后,在预位置出现约90 kDa 的明显条带,与预计大小一致,而含空质粒pLA 对照出现约41 kDa 的明显条带;说明pgsA 标签蛋白成功表达并可被兔源抗pgsA 血清识别,鸡源抗IBDV 血清可以特异性识别重组蛋白。

图4 重组蛋白Western blot 检测结果Fig.4 Western blot analysis of the recombinant protein
2.4 重组干酪乳杆菌流式细胞检测结果
携带pLA-VP2 重组质粒的干酪乳杆菌与只携带pLA 的干酪乳杆菌共同利用流式细胞仪检测,以鸡源抗IBDV 多抗血清作为一抗,以羊抗鸡IgG/FITC作为二抗,利用流式细胞仪检测荧光信号,绘制成直方图(图5)。结果:pLA 电转的干酪乳杆菌表明的荧光信号显著低于干酪乳杆菌表达pLA-VP2 的试验组,表明干酪乳杆菌成功表达外源蛋白VP2。为确定检测样品阳性的百分比,应用对照组曲线同试验组曲线交叉法,即以交叉点为界,分别应用正态分布函数计算出阳性组曲线覆盖面积及对照组延伸到阳性组下的面积,以前者减去后者获得的数据,即为阳性组所占比例。计算结果为阳性所占比例为80%,即重组干酪乳杆菌表达IBDV VP2 蛋白表达率为80%。
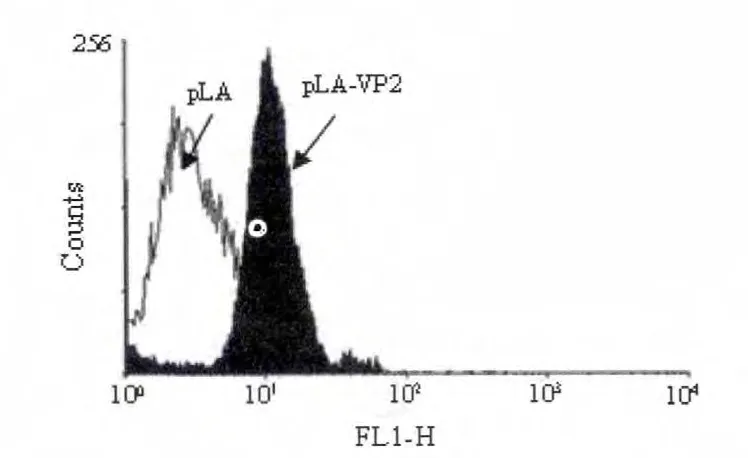
图5 重组干酪乳杆菌的流式细胞检测结果Fig.5 Fluorescence-activated cell sorter analysis of the recombinant protein
3 讨论
IBDV 的基因工程亚单位疫苗是目前国内外研究的热点。在过去的30年里,已经报道了多种重组的表达体系表达VP2 蛋白,IBDV 的衣壳蛋白VP2蛋白携带有病毒主要的中和性抗原表位[7]。目前已经有多种不同的表达系统获得应用,如大肠杆菌、酵母菌、禽痘病毒、杆状病毒、塞姆利基森林病毒等[8],甚至是植物表达系统[9]。在一些研究中应用重组的VP2蛋白进行免疫,一些甚至可以提供100%的保护。迄今为止,已有三种基于重组VP2 蛋白的表达系统制备亚单位疫苗在一些国家已经投放市场,分别为杆状病毒、大肠杆菌和毕赤酵母菌[10]。这些都充分证明了利用IBDV 的VP2 蛋白制备亚单位疫苗的可行性。
该研究构建了pLA-VP2 重组质粒,应用干酪乳杆菌(Lactobacillus casei,LAB)表达鸡传染性法氏囊病毒B87 株VP2 蛋白,将VP2 蛋白展示在干酪乳杆菌表面。质粒pLA 是一种穿梭质粒,它既可以在大肠杆菌中复制,又可以在乳酸菌中复制。在位于HCE启动子下游,第238~251 序列编码一种名叫pgsA 的锚钉蛋白,它具有将外源基因锚钉在细胞表面的作用。pgsA 穿插在乳酸菌的细胞壁上,外源蛋白通过N端与pgsA 相连,从而锚钉在菌体表面。在研究中构建的pLA-VP2 重组质粒,就是利用干酪乳杆菌表达系统表达pgsA-VP2 融合蛋白,外源蛋白VP2 被pgsA 锚钉在菌体上,使得VP2 蛋白成功展示在菌体表面。
Western Blot 检测重组蛋白VP2,结果显示重组干酪乳杆菌表达的VP2 蛋白可以与IBDV 多抗血清发生特异性免疫反应,证明构建的重组干酪乳杆菌表达的VP2 蛋白结构与天然抗原结构相似,具有较好的反应原性。乳酸菌表达外源蛋白分两种情况:分别为菌内表达和菌体表面表达。蛋白如果在菌体内部表达,抗体无法进入菌体内部与蛋白结合,荧光无法标记在蛋白上,经过流式细胞仪时,荧光无法被检测器捕捉;蛋白在菌体表面表达,经荧光(FITC)标记二抗处理过的干酪乳杆菌表面就会带有荧光,即被流式细胞仪的散射光检测器捕捉,产生荧光信号;此外pLA-VP2 重组菌荧光强度高于pLA 菌对照组,这些都充分证明了VP2 已成功展示在干酪乳杆菌表面。研究为IBDV 基因工程亚单位疫苗的研制又提供了一个可行性的表达系统。
[1]McFerranJB,McNultyMS,McKillopER,etal.Isolation andSerologicalstudieswithinfectionsbursaldiseaseviruses from fowl,turkeysandducks:demonstrationofasecond serotype[J].AvianPathology,1980(9):395-404.
[2]AllanW H,FaragherJT,CullenGA.Immunosuppression bytheinfectiousbursalagentinchickensimmunizedagainst Newcastledisease[J].VeterinaryRecord,1972,90:511-512.
[3]RosalesAG,VillegasP,LukertPD,etal.Immunosuppressive potentialandpathogenicityofarecentisolateofinfectious bursaldiseasevirusincommercialbroilerchickens[J].AvianDiseases,1989,33:724-728.
[4]DavisonF,KaspersB,SchatKA,etal.Avianimmunology[M].London:Academicpress,2008.
[5]谭君,侯喜林,余丽芸.重组干酪乳杆菌代谢产物抑菌效果的研究[J].黑龙江八一农垦大学学报,2012,24(4):29-32.
[6]BechtHH,MullerHK.Comparativestudiesonstructural andantigenicpropertiesoftwoserotypesofinfectiousbursal diseasevirus[J].JournalofGeneralVirology,1988,69:631-640.
[7]LeeJS,PooH,HanDP,etal.Mucosalimmunizationwith surface-displayed severe acute respiratory syndrome coronavirusspikeproteinonLactobacillus casei induces neutralizingantibodiesinmice[J].Journalofvirology,2006,80(8):4079-4087.
[8]PhenixKV,WarkK,LukeCJ,etal.RecombinantSemliki Forestvirusvectorexhibitspotentialforavianvirusvaccine development[J].Vaccine,2001,19:3116-3123.
[9]WuH,SinghN K,LocyR D,etal.Immunizationof chickenswithVP2proteinofinfectiousbursaldiseasevirus expressedinArabidopsisthaliana[J].AvianDiseases,2004,48:663-668.
[10]PitcovskiJ,GutterB,GalliliG,etal.Developmentand large-scale use ofrecombinantVP2 vaccine for the preventionofinfectiousbursaldiseaseofchickens[J].Vaccine,2003,21:4736-4743.

