快速检测肺炎链球菌recA、ply及16S rRNA基因的多重降落PCR方法建立及应用
侯艳娇,罗欲承,邵晨,倪颖,邵世和
(1.江苏大学基础医学与医学技术学院,江苏镇江212013;2.兴化市人民医院检验科,江苏泰州225700)
快速检测肺炎链球菌recA、ply及16S rRNA基因的多重降落PCR方法建立及应用
侯艳娇1,罗欲承2,邵晨1,倪颖1,邵世和1
(1.江苏大学基础医学与医学技术学院,江苏镇江212013;2.兴化市人民医院检验科,江苏泰州225700)
目的:建立快速检测肺炎链球菌recA、ply及16S rRNA基因的多重降落PCR方法并应用。方法:设计肺炎链球菌的特异基因recA、ply及其菌属保守序列16S rRNA基因的引物,建立多重降落PCR的反应体系及条件,通过该方法检测13株标准菌株的基因以判定recA、ply、16S rRNA基因的检测特异性;并通过对不同稀释度肺炎链球菌DNA的检测判定该方法的灵敏度。最后,应用多重降落PCR方法检测98份痰标本的肺炎链球菌,并与细胞培养法进行比较。结果:建立的多重降落PCR方法检测肺炎链球菌的特异性达100%,灵敏度达5 pg/μL,该方法对98份痰标本中肺炎链球菌的检测结果与细胞培养法一致。结论:成功建立检测肺炎链球菌的多重降落PCR方法,灵敏度高,特异性强,可用于临床标本肺炎链球菌的快速检测。
肺炎链球菌;多重降落PCR;临床标本
肺炎链球菌(Streptococcus pneumonia,SP)是细菌性感染的主要病原体之一,在世界范围内引起较高的发病率和死亡率,既可导致败血症、脑膜炎等侵袭性感染,也可导致中耳炎、肺炎等非侵袭性感染[1]。我国每年因SP相关性疾病导致的儿童死亡人数位居全球前10列[2]。该菌培养要求较高,耗时且培养检出率较低,特别是已使用抗生素的患者标本中更加难以分离。由于SP不同菌株可能出现某个基因的缺失,或存在多个毒力基因,为提高检出率,本研究尝试建立一种可同时检测SP的特异基因recA基因(编码高度保守的细菌重组酶的亚基)[3],ply基因(肺炎链球菌溶血素基因)[4],以及该菌属的保守序列16S rRNA基因的灵敏度高、特异性强的多重降落PCR方法,以用于临床痰标本的检测。
1 材料与方法
1.1 材料
1.1.1 实验菌株及培养基 本研究所用菌株如表1,其中SP ATCC 49619由史利宁博士馈赠,粪肠球菌ATCC 29212由孙光明博士馈赠,b型流感嗜血杆菌ATCC10211购自美国模式菌种收集中心(ATCC),其他菌株均由江苏大学基础医学与医学技术学院检验医学研究所保存[5]。结核分枝杆菌、牛分枝杆菌、牛分枝杆菌BCG、耻垢分枝杆菌接种罗-琴培养基,37℃、5%CO2培养2~4周;流感嗜血杆菌ATCC 49247、b型流感嗜血杆菌ATCC 10211接种5129固体培养基,37℃、5%CO2培养24~48 h;其他菌株接种于血平板,37℃、5%CO2培养24~48 h,即获得各细菌的纯培养物。
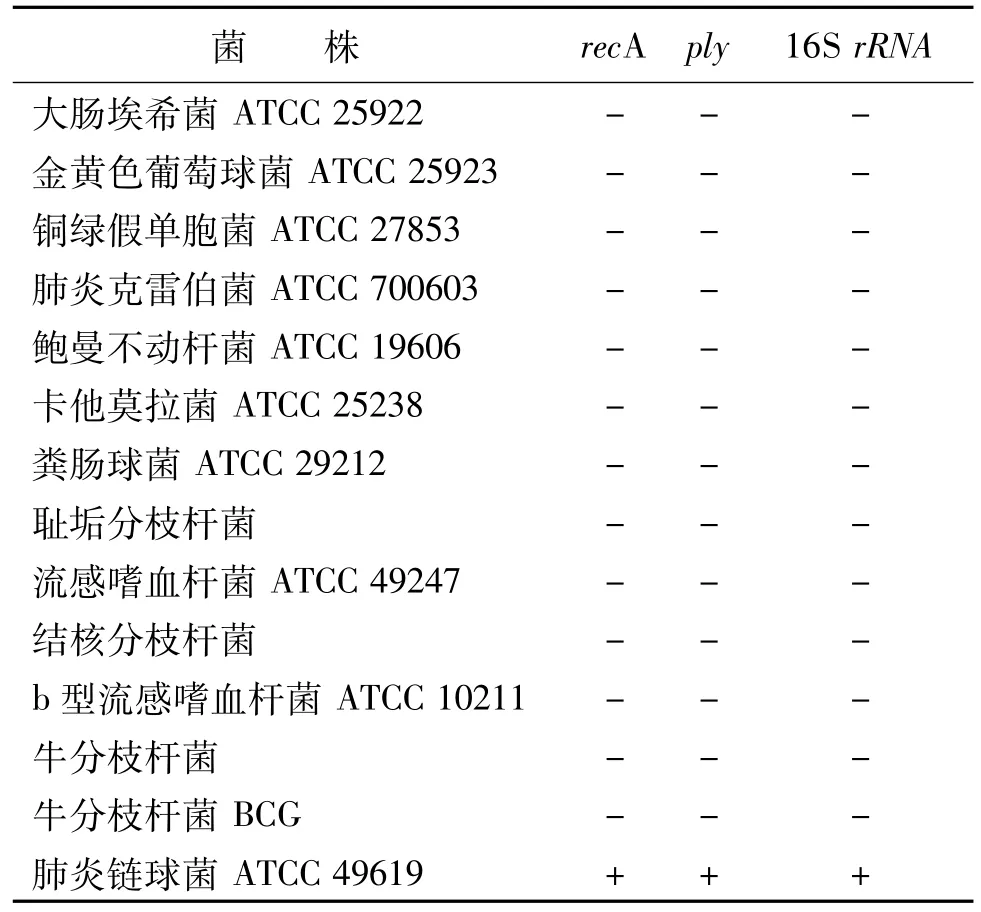
表1 用于评价引物特异性的菌株
1.1.2 试剂与仪器 琼脂糖(Sigma公司,美国);DL2000 DNA标准参照物、细菌基因组DNA提取试剂盒(TaKaRa公司,大连);Taq DNA聚合酶、dNTPs(Fermantas公司,立陶宛);PCR扩增仪(2720 Thermal Cycler,美国ABI公司);凝胶成像及分析系统(SYNGENE,GENE公司)。电泳仪(Jim-X,Bio-Rad公司);核酸检测仪(BioPhotometer,Eppendorf公司)。
1.2 方法
1.2.1 PCR引物的设计和合成 根据基因库公布的SP的recA、ply基因序列,应用Primer premier 6.0(PremierBiosoft,美国)软件设计recA、ply基因的特异性扩增引物;SP的保守序列16S rRNA基因的引物引用自文献[6]。引物均由上海英骏生物科技有限公司合成,序列见表2。

表2 目的基因的引物序列
1.2.2 DNA模板的制备 纯培养细菌DNA的提取按细菌基因组DNA提取试剂盒说明书操作。收集自江苏大学附属医院的98份临床痰标本,先用0.9%NaCl洗涤2次,然后用1%胰酶37℃消化90 min,再用细菌基因组DNA提取试剂盒提取DNA。提取的DNA保存于-20℃,备用。
1.2.3 单一降落PCR 反应体系:10×PCR缓冲液2.5μL,10 mg/mL BSA 0.25μL,25 mmol/L MgCl23μL,10 mmol/L dNTP 0.5μL,5 U/μL Taq DNA聚合酶0.2μL,SP DNA模板2μL,分别将10 μmol/L recA、ply或16S rRNA的上下游引物各1μL作为引物,加入反应体系。加ddH2O 14.55μL至体系25μL。
反应条件:94℃5 min;94℃30 s,65℃(每循环降低0.5℃)30 s,72℃1 min,20个循环;94℃30 s,55℃30 s,72℃1 min,20个循环;72℃7 min。PCR产物于2%琼脂糖凝胶6 V/cm恒压电泳,0.5 mg/L溴化乙啶溶液染色,在凝胶成像仪下分析电泳结果。
1.2.4 多重降落PCR 反应体系:10×PCR缓冲液2.5μL,10 mg/mL BSA 0.25μL,10μmol/L recA上下游引物各3μL,10μmol/L ply上下游引物各0.25μL,10μmol/L 16S rRNA上下游引物各0.5 μL,25 mmol/L MgCl23μL,10 mmol/L dNTP 0.5 μL,5 U/μL Taq DNA聚合酶0.2μL,DNA模板2μL,加ddH2O 9.05μL至体系25μL。
反应条件:94℃5 min;94℃30 s,65℃(每循环降低0.5℃)30 s,72℃1 min,20个循环;94℃30 s,55℃30 s,72℃1 min,20个循环;72℃7 min。PCR产物于2%琼脂糖凝胶6 V/cm恒压电泳,0.5 mg/L溴化乙啶溶液染色,在凝胶成像仪下分析电泳结果。
1.2.5 多重降落PCR体系特异性检测 采用13种常见菌株的DNA作模板,其中SP为阳性对照,ddH2O为阴性对照,通过多重降落PCR方法观察对recA、ply、16S rRNA3种基因检测的特异性。
1.2.6 多重降落PCR体系灵敏度检测 1.5 mL SP纯培养液提取的基因组DNA,经核酸蛋白检测仪于260 nm检测,其质量浓度为0.5 ng/μL。将0.5 ng DNA进行10倍梯度稀释后获得5,0.5,0.05,0.005,0.000 5 ng/μL的DNA,分别以其为模板进行多重降落PCR反应检测recA、ply、16S rRNA基因,试验重复2次,将产生特异性可见条带的最低DNA浓度定为检测下限。
1.2.7 应用多重降落PCR检测临床痰标本中的SP 将10μL已消化的98份临床痰标本接种于巧克力平板、血平板以及麦康凯平板,在5%CO2,35℃条件下孵育24~48 h后,进行细菌鉴定。同时,用已建立的多重降落PCR方法检测98份临床痰标本中提取的DNA,与传统细菌培养法鉴定SP的结果相比较,以验证其可靠性。
2 结果
2.1 降落PCR扩增结果
单一降落PCR扩增时,SP的recA、ply、16S rRNA 3种基因扩增片段长度分别为735、581、217 bp。多重降落PCR扩增时,3对引物混合后产生可区分的目的片段,且无非特异性扩增(图1)。
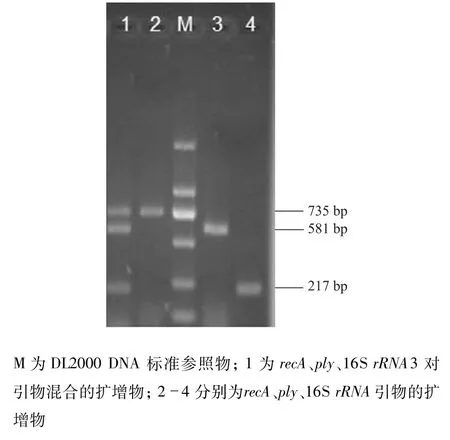
图1 降落PCR扩增目的基因
2.2 多重降落PCR体系的特异性
用已建立的多重降落PCR方法检测常见的13种菌株,结果显示只有阳性对照SP可扩增出recA、ply、16S rRNA3种基因的特异性条带,与其他菌株无交叉反应,特异性达100%,如图2。
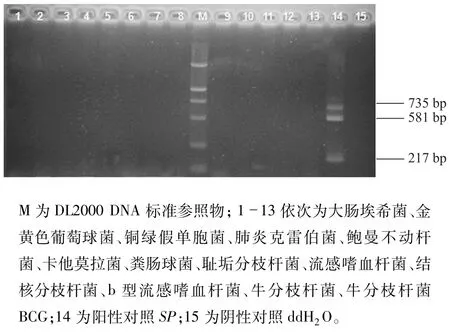
图2 多重降落PCR特异性评价
2.3 多重降落PCR体系的灵敏度
不同浓度SP DNA经多重降落PCR反应检测,发现产生特异性可见条带的最低DNA浓度为0.005 ng/μL(5 pg/μL),即为灵敏度(图3)。
2.4 临床痰标本检测
对98份临床痰标本基因组DNA进行多重降落PCR方法检测SP,发现在25份SP培养阳性的痰标本基因组DNA中均成功扩增出特异性条带,两种检测结果相一致,但多重降落PCR方法的检测时间大大缩短。图4为部分临床痰标本的扩增结果。
3 讨论
SP主要存在于人类上呼吸道黏膜表面,引起细菌性肺炎、脑膜炎和SP性败血病[7]。儿童社区获得性肺炎中,SP感染占30%~35%[8];在住院患者中,院内获得性肺炎位居院内获感染的第2位或第3位,是较常见的死亡原因。而快速检测和鉴定痰中的SP是及时有效控制呼吸道感染、降低药物耐药性的重要前提。目前检测SP的方法还是以培养镜检法为主,然后进一步用免疫学方法进行血清分型及生化鉴定,即培养镜检法、免疫学方法(酶联免疫吸附试验、免疫荧光试验、沉淀试验、凝集试验等),分子生物学方法(核酸分子杂交、基因重组法、PCR技术、生物芯片技术)等。但这些方法均分别在不同程度上存在烦琐复杂、费时、费力,敏感性或特异性不高等缺点,对标本很难在短时间内做出全面正确的诊断。因此,研究检测SP的敏感、特异、快速、简便和易于操作的方法尤为重要。
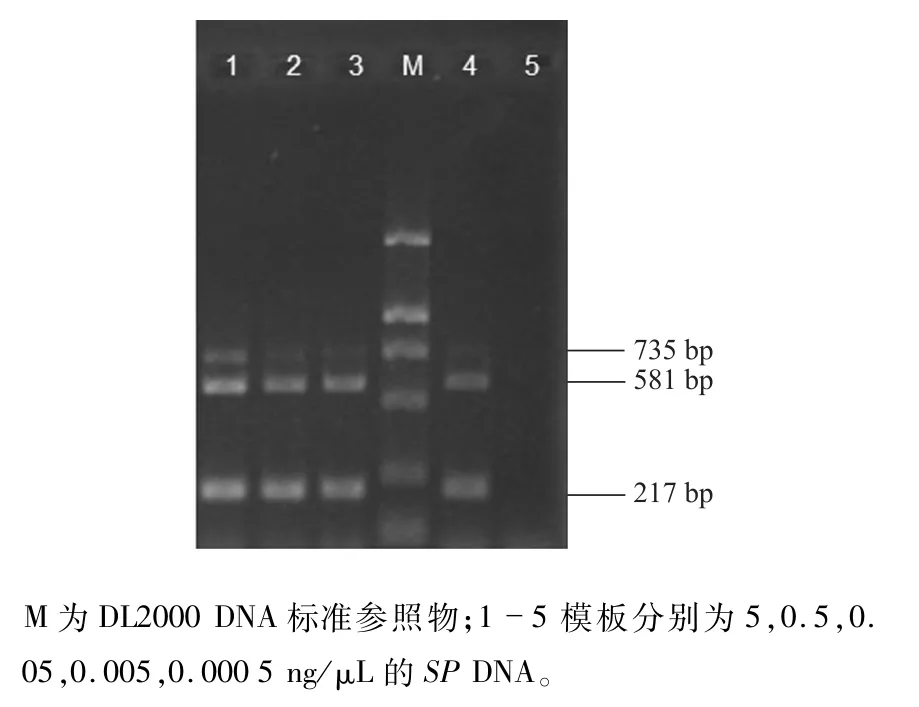
图3 多重降落PCR灵敏度检测

图4 多重降落PCR检测临床痰标本中的Sp
PCR技术对致病菌的鉴定已不再局限于细菌的外部形态结构及生理特性等一般检验上,而是从分子生物学水平研究生物大分子,特别是核酸结构及其组成部分,而且PCR敏感度高、特异性强、操作简便、快速,已被广泛应用于致病菌的检测。但常规PCR一次实验只能针对致病菌的单一基因,而SP可能会出现某个基因的缺失,或存在多个毒力基因。多重PCR根据致病菌的毒素基因、高度保守基因及特异性基因,设计合成多对寡核苷酸引物,建立多重PCR反应体系,降落PCR通过将退火温度从65℃经每一循环降低0.5℃共20个循环降至55℃,有效解决了退火温度不合适时PCR产物的非特异性结合及引物与模板的结合率低的问题,显著提高了检测灵敏度。
近年来已有PCR方法检测SP的文献报道[9-12],然而尚无同时针对recA、ply、16S rRNA3种基因的多重降落PCR方法的报道。本研究建立的多重降落PCR体系同时检测SP的3个基因,极大地缩短检测时间、降低成本和提高检出率,可为SP的检测提供快速、敏感、特异的诊断。我们一方面选取SP的特异性基因recA、ply及该菌属的保守序列16S rRNA基因作为目的基因设计引物,并使用Primer-BLAST在线比对、验证引物的特异性,另一方面使用临床常见的13种菌株作模板,SP、ddH2O分别作为阳性对照、阴性对照,验证体系的特异性。通过双重验证,确保多重降落PCR体系的特异性。另外,本研究所建立的多重降落PCR对SP的检测下限是5 pg/μL,低于Wang等[13]报道的50 pg/μL,与Tzanakaki等[14]报道的10 pg/μL相当,检测体系较为灵敏。而且,多重降落PCR对临床痰标本中SP的检测结果与传统细菌培养一致,能准确快速地检出SP。
[1]Jauneikaite E,Jefferies JM,Hibberd ML,et al.Prevalence of Streptococcus pneumoniae serotypes causing invasive and non-invasive disease in South East Asia:a review[J].Vaccine,2012,30(24):3503-3514.
[2]Chen Y,DengW,Wang SM,etal.Burden of pneumonia and meningitis caused by Streptococcus pneumoniae in China among children under5 years of age:a systematic literature review[J].PLoS One,2011,6(11):e27333.
[3]Zbinden A,Kohler N,Bloemberg GV.recA-based PCR assay for accurate differentiation of Streptococcus pneumoniae from other viridans streptococci[J].JClin Microbiol,2011,49(2):523-527.
[4]Shak JR,Ludewick HP,Howery KE,et al.Novel role for the Streptococcus pneumoniae toxin pneumolysin in the assembly of biofilms[J].MBio,2013,4(5):eoo655-13.
[5]Luo YC,Du P,Zhao JZ,et al.A multiplex touchdown PCR for detection of Streptococcus pneumoniae,Haemophilus influenzae type b and Mycobacterium tuberculosis complex in sputum samples[J].Trop Biomed,2012,29(3):422-428.
[6]El Aila NA,Em ler S,Kaijalainen T,et al.The development of a 16S rRNA gene based PCR for the identification of Streptococcus pneumoniae and comparison with four other species specific PCR assays[J].BMC Infect Dis,2010,10:104.
[7]Choi CW,An HY,Lee YJ,et al.Characterization of Streptococcus pneumoniae N-acetylglucosamine-6-phosphate deacetylase as a novel diagnostic marker[J].J Microbiol,2013,51(5):659-664.
[8]Morozumi M,Chiba N,Okada T,et al.Antibiotic susceptibility in relation to genotype of Streptococcus pneumoniae,Haemophilus influenzae,and Mycoplasma pneumoniae responsible for community-acquired pneumonia in children[J].J Infect Chemother,2013,19(3):432-440.
[9]Dominguez J,Gali N,Matas L,et al.PCR detection of Streptococcus pneumoniae DNA in serum samples for Pneumococcal pneumonia diagnosis[J].Clin Microbiol Infect,2001,7(3):164-166.
[10]Mayoral C,Norona M,Baroni MR,et al.Evaluation of a nested-PCR assay for Streptococcus pneumoniae detection in pediatric patients with community-acquired pneumonia[J].Rev Argent Microbiol,2005,37(4):184-188.
[11]李马超,张砺,李倩,等.肺炎链球菌PCR分型技术的建立与应用[J].中华流行病学杂志,2010,31(3):316-320.
[12]Koseoglu EO,Alp S,Ergin A,etal.Comparison of culture and real-time PCRmethods in the detection of Streptococcus pneumoniae and Haemophilus influenzae in acute otitis media effusion specimens[J].Mikrobiyol Bul,2012,46(4):676-681.
[13]Wang Y,Kong F,Yang Y,et al.A multiplex PCR-based reverse line blot hybridization(mPCR/RLB)assay for detection of bacterial respiratory pathogens in children with pneumonia[J].Pediatr Pulmonol,2008,43(2):150-159.
[14]TzanakakiG,Tsopanomichalou M,Kesanopoulos K,et al.Simultaneous single-tube PCR assay for the detection of Neisseria meningitidis,Haemophilus influenzae type b and Streptococcus pneumoniae[J].Clin Microbiol Infect,2005,11(5):386-390.
Establishment and application ofmultiplex touchdown PCR for rapid detection of recA,ply and 16S rRNA genes of Streptococcus pneumonia
HOU Yan-jiao1,LUO Yu-cheng2,SHAO Chen1,NIYing1,SHAO Shi-he1
(1.School of Medical Science and Laboratory Medicine,Jiangsu University,Zhenjiang Jiangsu 212013;2.Department of Clinical Laboratory,Xinghua People′s Hospital,Taizhou Jiangsu 225700,China)
Objective:To develop and applymultiplex touchdown PCR for rapid detection of recA,ply and 16S rRNA genes of Streptococcus pneumonia(SP).M ethods:Primers based on recA,ply and the genus conserved 16S rRNA gene sequenceswere designed for Sp respectively to establishmultiplex touchdown PCR system and conditions.To evaluate the specificity of primers,DNA template prepared from 13 standard strainswere tested using the established multiplex touchdown PCR method.The sensitivity of the method was determined by detecting serial dilutions of SP DNA template.Finally,multiplex touchdown PCR was applied to detect SP in 98 cases of sputum samples,and the resultswere compared with cell culturemethod.Results:The specificity of themultiple touchdown PCR were 100%,the SP detection limits of themultiple touchdown PCR assay was5 pg/μL.The results of SP in 98 cases of sputum samples bymultiplex touchdown PCR were consistentwith cell culture.Conclusion:A higher sensitivity and specificity multiplex touchdown PCR assay was successfully developed.It could be used for rapid detection of SP in clinical samples.
Streptococcus pneumonia;multiplex touchdown PCR;clinical samples
R446.5
A
1671-7783(2014)01-0040-04
10.13312/j.issn.1671-7783.y130259
江苏省科技创新与成果转化专项资金资助项目(BL2012047)
侯艳娇(1989—),女,山东滕州人,硕士研究生;邵世和(通讯作者),教授,博士生导师,E-mail:shaoshihe2006@163.com
2013-11-26 [编辑]何承志

