粉煤灰增强超声/H2O2降解左氧氟沙星的实验研究
魏 红,杨 虹,赵 琳,李克斌,于雪丽 (.西安理工大学西北水资源与环境生态教育部重点实验室,陕西 西安 70048;.西北大学化学与材料科学学院,合成与天然功能分子化学教育部重点实验室,陕西 西安 70069)
抗生素是近年来环境中频繁被检出的新兴污染物之一[1].据报道,由于氧氟沙星的抗生物降解性,传统的生物处理技术对废水中抗生素的去除效率不佳,不同国家污水厂出水的检测浓度在0.005~31.7μg/L[2-3].环境水体中抗生素的浓度很低,但水体中持续存在的抗生素能够选择性抑杀一些环境微生物,诱导抗药菌群的产生,导致其特殊的生态毒理效应[4-6].
水体中抗生素处理的高级氧化技术(AOPs)包括光解、微波辅助光催化降解、臭氧氧化、电化学氧化等,抗生素超声降解相对于文献中报道的其他AOPs,仅占4%[7].但超声与其他AOPs相比,具有过程便于控制、反应条件温和、效率高等优点,作者前期考察了超声/H2O2对喹诺酮类抗生素左氧氟沙星模拟废水的降解效果[8],发现催化效果和产物分布受溶液初始pH值影响较大.粉煤灰是常见的工业废弃物,含有SiO2、Al2O3、FeO/Fe2O3等无机氧化物,被用作廉价吸附剂[9].粉煤灰中的金属氧化物有催化 H2O2发生类Fenton反应的可能,但在处理水中抗生素类药物方面还未见文献报道.本文考察了粉煤灰对超声/H2O2体系降解左氧氟沙星的增强效果,分析TOC的变化,采用 HPLC/MS/MS方法对反应产物进行分析,探讨反应路径,为粉煤灰在抗生素类新型污染物的有效去除提供技术参考.
1 材料与方法
1.1 实验材料
粉煤灰(陕西省户县热电厂,主要组成如表 1所示);30% H2O2(分析纯,天津市天力化学试剂有限公司);氢氧化钠,盐酸(分析纯,天津傲然精细化工研究所);乙腈(色谱纯);超纯水.左氧氟沙星(新昌制药厂,纯度大于 99%),分子式: C18H20FN3O4,分子量为361.37.

表1 粉煤灰的主要化学组成(质量百分数,%)Fig.1 The main chemical components of fly ash (wt.%)
1.2 实验仪器
pHs-25数显酸度计(上海虹益仪器仪表有限公司)配E-201-C-9型pH复合电极(上海罗素科技); JY92-Ⅱ超声波细胞粉碎机(配备直径8mm的钛探头,宁波新艺仪器有限公司);Aglient1200液相色谱仪,配备G1311A四元泵,柱温箱 30℃,G1314C XL可变波长紫外检测器;Multi N/C 3000(德国耶拿分析仪器股份公司);UltiMate3000液相色谱(美国 Dionex公司) –micr OTOF-QⅡ飞行质谱(德国Bruker公司).
1.3 实验方法
1.3.1 粉煤灰的酸改性 称取一定量的粉煤灰,过 180目筛,称量后按照一定比例加入配制好的1.0mol/L HCl溶液,然后以150r/min的转速搅拌12h,静置后除去上清液,用蒸馏水洗涤数遍至pH值近中性,烘干,过180目的筛备用.
1.3.2 左氧氟沙星的超声降解实验 准确移取一定质量浓度为250mg/L的左氧氟沙星溶液和一定量的 H2O2(或/和粉煤灰)到 250mL烧杯(d=80mm)中,用 1.0mol/L 的 NaOH 或 H2SO4溶液调节pH值.然后,将JY92-Ⅱ超声波细胞粉碎机钛探针插入溶液,探针浸泡深度约 1cm,钛脉冲(on/off)为 1s/1s,在标准大气压和避光下超声处理,每隔一定时间取样,用 HPLC分析溶液中左氧氟沙星的浓度.左氧氟沙星的去除率按照式(1)计算:

式中,C0和C分别为开始和t时刻左氧氟沙星的浓度(mg/L).
1.3.3 左氧氟沙星的 HPLC定量分析 左氧氟沙星浓度通过Agilent l200高效液相色谱仪分析采用外标法定量.色谱分离条件为色谱柱:Eclipse XDB-C18(150mm×4.6mm,5µm);流动相为乙腈:甲酸水溶液(0.2%)=20:80(V:V);检测波长290nm;流速为 0.2mL/min;进样量为 10µL;柱温30℃.
1.3.4 左氧氟沙星的HPLC/MS/MS分析 左氧氟沙星的超声降解产物 LC-MS分析在microTOF-QⅡ(Bruker)上完成.LC分析条件为:色谱柱为Eclipse XDB-C18(150mm×4.6mm,5µm);流动相为乙腈-0.2%(体积分数)甲酸水溶液(体积比20:80);流速为0.2mL/min;检测波长290nm;进样量为10μL.MS条件:电喷雾ESI源,正离子电离模式;扫描方式:全扫描(scan),扫描范围(m/z):50~20000.
1.3.5 羟基自由基(·OH)的测定[10]香豆素与·OH自由基反应生成荧光性物质 7-羟基香豆素(激发波长 335nm,发射波长 460nm).向100mL浓度为1×10-3mol/L的香豆素溶液中加入一定量的 H2O2(或 H2O2/粉煤灰)进行超声降解反应,100min后取 5mL反应液于比色皿中,在HITACHI F4500荧光分光光度仪从350~700nm范围扫描荧光发生光谱,7-羟基香豆素的荧光强度与·OH的含量成正比.
2 结果与讨论
2.1 不同实验条件下左氧氟沙星的降解
实验考察了 pH=7.16,左氧氟沙星浓度为20mg/L,超声功率为 325W 的条件下,在单独超声、H2O2氧化、超声/H2O2、超声/粉煤灰、粉煤灰/H2O2氧化、US/粉煤灰/H2O2条件下,左氧氟沙星的去除(图 1).其中H2O2的添加量为15.0mmol/L,粉煤灰的添加量为 1.0g/L,粉煤灰/H2O2氧化条件下,搅拌速度为200r/m.

图1 不同实验条件下左氧氟沙星的去除效果Fig.1 Levofloxacin removing under different experimental system
图1可看出,与直接超声、H2O2氧化、超声/H2O2、粉煤灰/H2O2氧化相比,超声/粉煤灰/H2O2对左氧氟沙星具有明显的增强去除作用.反应160min,各体系中左氧氟沙星的去除率分别为3.53%、3.89%、23.14%、53.14%和98.84%;考虑到粉煤灰的吸附作用,实验考查了超声/粉煤灰体系的作用,反应 160min,左氧氟沙星的去除率为13.90%.左氧氟沙星在超声/粉煤灰/H2O2体系的去除率大于粉煤灰/H2O2、超声/粉煤灰体系中的去除率之和(37%).表明超声、粉煤灰和 H2O2存在协同效应.
左氧氟沙星的直接超声和H2O2氧化效果较差,与·OH和 H2O2的氧化性能有关.超声/H2O2作用主要在于·OH 产生量的增加[8,11-12].粉煤灰/H2O2一定程度促进了左氧氟沙星的降解,在于体系的类 Fenton反应[式(1)~式(2)],粉煤灰中的Fe2O3是 Fenton反应的主要成分.超声/粉煤灰/H2O2体系中,左氧氟沙星的去除率最高.这主要在于粉煤灰能提供更多的成核点形成空穴[13],此外超声震荡粉煤灰产生更多Fe2+,体系中产生大量·OH[式(3)~式(4)][14].

实验进一步比较了单独超声、超声/H2O2、粉煤灰/H2O2和超声/粉煤灰/H2O2体系中生成的·OH浓度情况,结果如图2所示.

图2 不同体系与香豆素反应的荧光光谱图Fig.2 The fluorescence spectra under different experimental system
由图 2可以看出,反应 100min,不同体系在460nm 处的荧光强度差别较大.单独超声几乎没有荧光吸收,其他 3种体系的荧光吸收强度依次为:超声/粉煤灰/H2O2>超声/H2O2>粉煤灰/H2O2,进一步表明,超声/粉煤灰/H2O2体系中有更多·OH产生.
2.2 粉煤灰添加量的影响
实验考察了 pH=7.16,左氧氟沙星初始浓度为 20mg/L,超声功率为 325W,H2O2浓度为15.0mmol/L,粉煤灰的添加量在0.5~2.0g/L范围,超声/粉煤灰/H2O2体系对左氧氟沙星去除过程的影响(图3).
由图 3可以看出,粉煤灰的添加量依次为0.5,1.0,1.5,2.0g/L时,超声 100min,左氧氟沙星的去除率依次为 48.25%、79.95%、96.58%和90.80%.添加量为1.5g/L时效果最好.这主要与催化表面积和Fe2+含量有关[14].粉煤灰投加量过低,催化表面较小,Fe2+较少,H2O2不容易立即生成·OH;继续增加投加量,溶液中 Fe3+/Fe2+平衡状态打破,·OH的生成量受到抑制[15],进而降低了催化效果.

图3 粉煤灰添加量对左氧氟沙星去除效果的影响Fig.3 Effect of fly ash adding amount on levofloxacin removal efficiency
2.3 H2O2添加浓度的影响
H2O2添加浓度对Fenton反应体系的催化性能有重要影响.实验考察了 pH=7.16,左氧氟沙星初始浓度为20mg/L,超声功率325W,粉煤灰添加量 1.5g/L,H2O2添加浓度 5.0~20.0mmol/L范围,超声/粉煤灰/H2O2体系中,左氧氟沙星的去除过程(图4).
由图 4可以看出,反应 160min,H2O2添加浓度依次为 5.0,10.0,15.0mmol/L时,左氧氟沙星的去除率随 H2O2添加浓度的增加而升高,继续从15.0mmol/L增加到 20.0mmol/L时,去除率反而有所降低.随着溶液中 H2O2添加浓度的增大,更多 H2O2吸附在粉煤灰表面,超声促进粉煤灰中Fe2+分解,体系中产生更多·OH,左氧氟沙星去除率提高.继续增加 H2O2的浓度,粉煤灰添加量一定,H2O2在粉煤灰表面吸附过饱和,Fe2+量有限,过量 H2O2不会被 Fe2+分解[16];同时过量 H2O2是·OH的清除剂[17],因此造成溶液中 H2O2的浓度继续增加,左氧氟沙星的去除率不升反降.

图4 H2O2添加浓度对左氧氟沙星去除效果的影响Fig.4 Effect of H2O2 concentration on levofloxacin removal efficiency
2.4 溶液初始pH值的影响
实验考查了左氧氟沙星浓度 20mg/L,H2O2添加浓度 15.0mmoL/L,粉煤灰添加量 1.5g/L,超声功率325W,溶液pH值分别为3.01、5.18、7.16和9.02时,左氧氟沙星的降解过程(图5).

图5 pH值对左氧氟沙星超声去除效果的影响Fig.5 Effect of pH values on levofloxacin removal efficiency
由图5可以看出,溶液初始pH值对左氧氟沙星超声降解的影响不大,表明该方法能在较宽pH范围有效降解污染物,有利于实际应用.
由表2进一步可以看出,不同pH值下左氧氟沙星的降解过程遵循一级反应动力学(R2>0.93).不同 pH条件下一级反应速率常数 k在 2.678×10-2~3.443×10-2min-1,pH=7.16 时降解速率常数达到最大.

表2 不同pH值条件下超声/粉煤灰/H2O2降解左氧氟沙星的一级动力学参数Table 2 The first-order kinetic parameters for removing levofloxacin by US/fly ash/ H2O2 at different pH values
pH值对超声/粉煤灰/H2O2体系降解左氧氟沙星的影响主要包括三个方面: (1) pH值对H2O2氧化性能及自由基的影响[4];(2)对左氧氟沙星的形态和溶解行为[18-19],由表 2可以看出,与超声/H2O2体系相比较,k值随pH的改变趋势与左氧氟沙星中性离子形态分布相似[7],但 k值大小受此影响较小; (3)pH值对含铁矿物的类Fenton反应的影响.有学者认为[19],当溶液中ΣFe浓度一定时,在 pH=3.0~9.0范围都具有较好的催化活性,而且主要以非均相催化反应为主[20].因此,在超声/粉煤灰/H2O2体系中,初始pH值对左氧氟沙星的降解速率常数大小影响较小.
2.5 TOC的去除
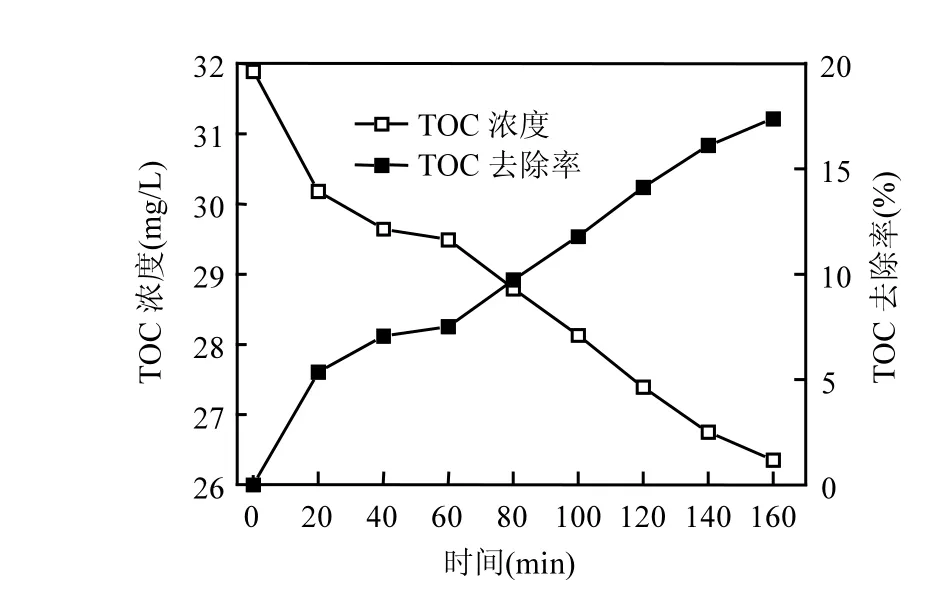
图6 左氧氟沙星超声过程中TOC的去除情况Fig.6 TOC removal during levofloxacin ultrasonic degradation
实验考查了左氧氟沙星浓度 20mg/L,H2O2添加浓度 15.0mmoL/L,粉煤灰添加量 1.5g/L,超声功率325W,溶液 pH值为7.16时,左氧氟沙星TOC的去除过程(图6).
由图6可以看出,溶液TOC随着反应时间的延长逐渐降低,TOC去除率逐渐增加.反应160min, TOC由31.89mg/L降低为26.35mg/L,对应的去除率为17.37%,而相同条件下左氧氟沙星的去除率为 99.12%.说明超声/粉煤灰/H2O2体系对左氧氟沙星降解速率快于矿化速度,完全矿化需要更长的时间.这可能与形成的中间产物较难氧化有关.
2.6 超声/粉煤灰/H2O2体系降解左氧氟沙星的产物分析
左氧氟沙星初始浓度20mg/L,粉煤灰添加量1.5g/L,H2O2添加浓度 15.0mmol/L,超声功率325W,pH 不调节,反应 160min,左氧氟沙星的HPLC如图7所示.

图7 超声/粉煤灰/H2O2反应体系中左氧氟沙星HPLC图谱的变化Fig.7 Changes in HPLC spectra of levofloxacin during the degradation by ultrasonic/fly ash/H2O2 system
由图7可以看出,本实验HPLC分析条件下,左氧氟沙星的保留时间 tR=10.840min,反应160min,tR=10.840min的谱峰基本消失,说明左氧氟沙星得到降解.同时在 tR1=8.61min(P1)、tR2=9.67min(P2)和 tR3=14.50(P3)出现 3个产物峰.tR=6.73min的色谱峰为残余的H2O2.产物P1、P2、P3的MS2谱如图8所示.
由图 8可以看出,左氧氟沙星超声降解过程中生成 3个主要产物的质荷比(m/z)分别为:338.1451(P1)、348.1325(P2)和 378.1435(P3).结合分子量、理论分子量和文献报道,推测P1为左氧氟沙星失去-C2的产物[21],其主要碎片离子 m/z 310.1542是P1失去-CO得到的.P2是左氧氟沙星失去亚甲基化-CH2的产物[21-22],主要碎片离子m/z 304.1438是P2失去-COOH得到的.P3是左氧氟沙星受到 O进攻的产物[21],碎片离子m/z361.1409是P3失去-OH得到的,m/z 317.1515是m/z 361.1409失去-COOH得到的.
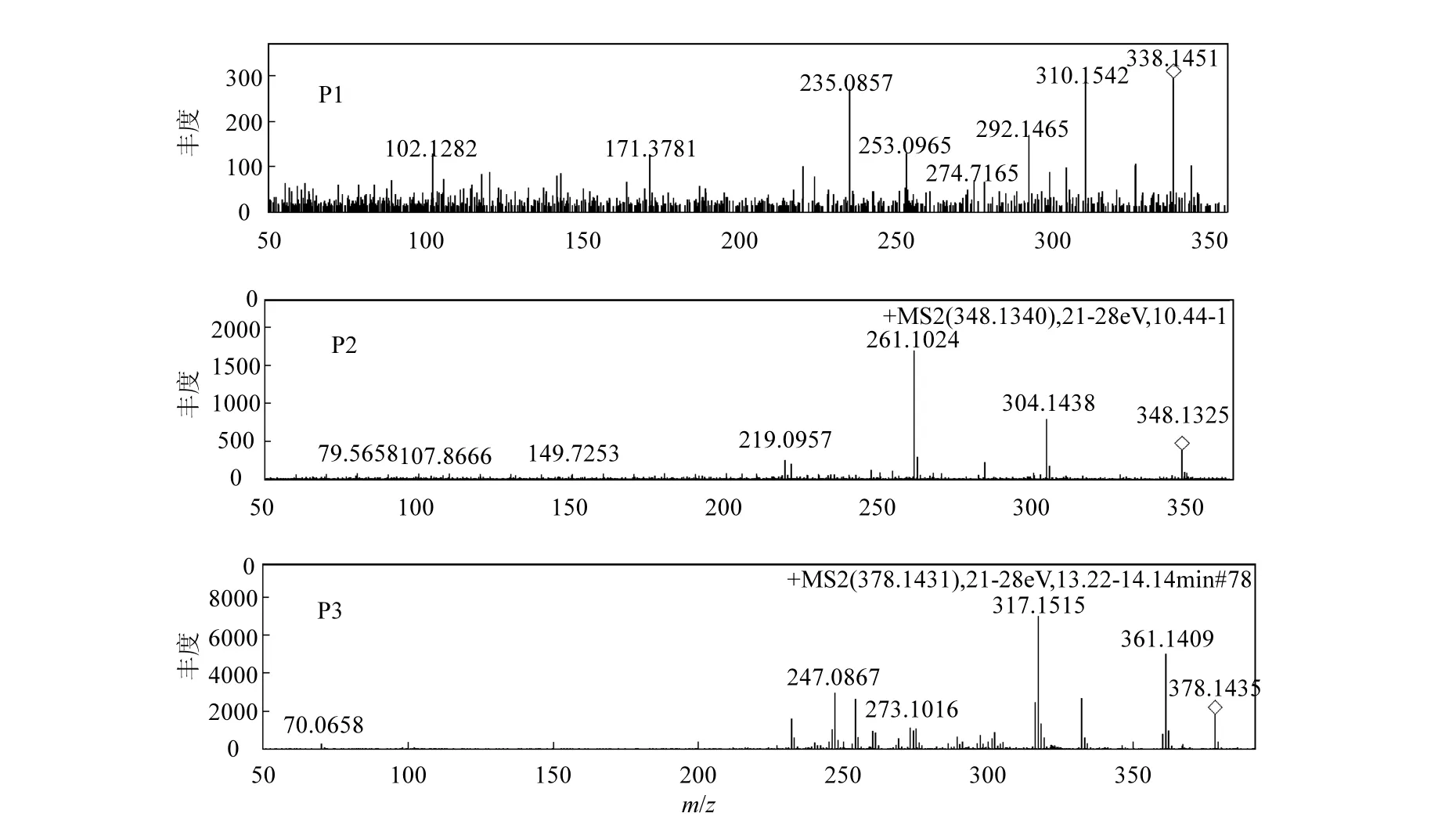
图8 左氧氟沙星降解过程中产物的二级质谱图Fig.8 MS2 spectrum of the main intermediates during levofloxacin ultrasonic degradation

图9 超声/粉煤灰/H2O2体系中左氧氟沙星的降解路径Fig.9 The proposed degradation pathway of levofloxacin under ultrasonic/fly ash/H2O2 system
根据以上 3种产物,推测超声/粉煤灰/H2O2降解左氧氟沙星的路径如图 9所示.左氧氟沙星喹诺酮环失去—C2生成P1,哌嗪环去亚甲基化生成P2,P3是·OH进攻喹诺酮环的产物.
3 结论
3.1 与单独超声、H2O2氧化、超声/H2O2、超声/粉煤灰、粉煤灰/H2O2氧化相比,超声/粉煤灰/H2O2能够显著提高左氧氟沙星降解.粉煤灰的添加量在 0.5~1.5g/L范围内左氧氟沙星沙星去除率随粉煤灰的添加量的增加而增大,超过 1.5g/L,去除率下降.
3.2 超声/粉煤灰/H2O2体系有较宽的 pH 值工作范围.在pH=3.0~9.0左氧氟沙星降解受pH值的影响较小.
3.3 左氧氟沙星在超声/粉煤灰/H2O2体系中的降解符合一级表观动力学,降解速率常数 k约在2.678×10-2~3.443×10-2min-1.
3.4 左氧氟沙星不能完全矿化,TOC去除率为17.37%;降解过程中主要生成 3种产物,HPLC/MS/MS表明,分别为喹诺酮环失去-C2,哌嗪环去亚甲基化,以及·OH进攻喹诺酮环的产物.
[1]Calamari D, Zuccato E, Castiglioni S, et al.Strategic survey of therapeutic drugs in the rivers Po and Lambro in nothern Italy [J].Environmental Science and Technology, 2003,37:1241-1248.
[2]Fatta-Kassinos D, Vasquez M I, Kümmerer K.Transformation
products of pharmaceuticals in surface waters and wastewater formed during photolysis and advanced oxidation processes-degradation, elucidation of byproducts and assessment of their biological potency [J].Chemosphere, 2011,85:693–709.
[3]Radjenovic J, Petrovic M, Barcelo D.Fate and distribution of pharmaceuticals in wastewater and sewage sludge of the conventional activated sludge (CAS) and advanced membrane bioreactor (MBR) treatment [J].Water Research, 2009,43:831–841.
[4]Volmer D A, Mansoori B, Locke S.Study of 4-quinolone antibiotics in biological samples by short-column liquid chromatography coupled with electrospray ionization tandem mass spectrometry [J].Analysis Chemistry, 1997,69(9):4143-4155.
[5]杨弯弯,武氏秋贤,吴亦潇,等.恩诺沙星和硫氰酸红霉素对铜绿微囊藻的毒性研究 [J].中国环境科学, 2013,33(10):1829-1834.
[6]杨晓凡,陆光华,刘建超,等.环境相关浓度下的药物对大型蚤的多代慢性毒性 [J].中国环境科学, 2013,33(3):538-545.
[7]Maria K, Dionissios M, Despo K.Removal of residual pharmaceuticals from aqueous systems by advanced oxidation processes [J].Environment International, 2009,35:402-417.
[8]魏 红,李 娟,李克斌,等.左氧氟沙星的超声/H2O2超声联合降解研究 [J].中国环境科学, 2013,33(2):257-262.
[9]Wang Y R, Chu W.Adsorption and Removal of a Xanthene Dye from Aqueous Solution Using Two Solid Wastes as Adsorbents [J].Eng.Chem.Res., 2011,50,8734–8741.
[10]Ishibashi K, Fujishima A, Watanabe T, et al.Detection of active oxidative species in TiO2photocatalysis using the fluorescence technique [J].Electrochemistry Communications, 2000,2:207-210.
[11]冯 勇,吴德礼,马鲁铭.氧化物催化类 Fenton反应 [J].化学进展, 2013,25(7):1219-1228.
[12]Wang J G, Wang X K, Guo P Q, et al.Degradation of reactive brilliant red K-2BP in aqueous solution using swirling jet-induced cavitation combined with H2O2[J].Ultrasonics Sonochemistry, 2011,18:494-500.
[13]Chou S, Haung C, Huang Y H.Heterogeneous and homogeneous catalytic oxidation by supported γ-FeOOH in annuitized-bed reactor: kinetic approach [J].Environmental.Science &Technology, 2001,35(6):1247-1251.
[14]Song Y L, Li J T.Degradation of C.I.Direct Black 168from aqueous so lution by fly ash/H2O2combining ultrasound [J].Ultrasonics Sonochemistry, 2009,16:440–444.
[15]Andersson A S, Thomas J O.The source of first—cycle capacity loss in LiFePO4[J].Journal of Power Sources, 2001,97/98(1/2):498-502.
[16]Wang N, Zhu L H, Wang M Q, et al.Sono-enhanced degradation of dye pollutants with the use of H2O2activated by Fe3O4magnetic nanoparticles as peroxidase mimetic [J].Ultrasonics Sonochemistry, 2010,17:78–83.
[17]Goel M, Hongqiang H, Mujumdar A S, et al.Sonochemical decomposition of volatile and non-volatile organic compounds-a comparative study [J].Water Research, 2004,38:4247-4261.
[18]Guo W L, ShiY H, Wang H Z, et al.Intensification of sonochemical degradation of antibiotics levofloxacin using carbon tetrachloride [J].Ultrasonics Sonochemistry, 2010,17:680-684.
[19]Kümmerer K.Antibiotics in the aquatic environment-A review-Part I [J].Chemosphere, 2009,75:417-434.
[20]Ma X J, Xia H L.Treatment of water-based printing ink wastewater by Fenton process combined with coagulation [J].Journal of Hazardous Materials, 2007,146:334-340.
[21]Witte B D, Langenhove H V, Hemelsoet K, et al.Levofloxacin ozonation in water: Rate determining process parameters and reaction pathway elucidation [J].Chemosphere, 2009,76:683-689.
[22]Evroula H, Ioulia F, Despo F K.Sonophotocatalytic treatment of of l oxacin in secondary treated eff l uent and elucidation of its transformation products [J].Chemical Engineering Journal,2013,224:96-105.

