酸化预处理紫茎泽兰厌氧消化能源转化效率和原料利用率对比分析*
许国芹, 柳静, 尹芳, 林卫东, 张无敌
(云南师范大学,云南 昆明 650500)
紫茎泽兰(EupatoriumadenophorumSpreng)属双子叶植物,菊目,菊科,泽兰属,多年生草本植物.因其茎和叶柄呈紫色,故名紫茎泽兰[1].紫茎泽兰俗名很多,在云南各地叫法不一,有解放草、黑头草、大毒草等.紫茎泽兰是国家环保局公布的我国首批16种外来入侵有害生物之一,随河谷、公路、铁路自南向北传播[2].自20世纪40年代,紫茎泽兰从缅甸、印度、越南等国传入我国,迅速遍及云南、贵州、广西、西藏等省区.它的繁殖能力强,传播速度快,以每年30 km的速度向北、向东推进[3].此外,紫茎泽兰化学成分和生态分布对农、林、牧有着极其严重的危害[4].
近年来,对紫茎泽兰的研究渐渐转向将其作为能源植物.无论是利用其进行厌氧发酵产沼气,还是生物发酵生产乙醇,都是侧重于对其碳源进行深层次的开发利用[5].紫茎泽兰中含有蛋白质、糖类、有机酸、黄酮、酚类、香豆素、内酯、挥发油和油脂等化学成分[6],沼气发酵系统中的各种微生物能够充分利用上述紫茎泽兰的各种成分进行沼气发酵[7].本文实验以实验室驯化的猪粪和紫茎泽兰混合物为接种物,通过对比料液未酸化预处理发酵和料液经过酸化预处理发酵之间的能源转化效率,从而获得提高紫茎泽兰的发酵效率的方法,为实现紫茎泽兰在工程上的利用提供参考.
1 实验材料和方法
1.1 实验材料
发酵原料:新鲜紫茎泽兰汁(取新鲜紫茎泽兰160 g,除去杂质并绞碎,加入600 mL水,放入榨汁机鲜榨,获得紫茎泽兰汁.在发酵之前需进行脱毒预处理[8]).其中紫茎泽兰为2014年3月1日采自云南师范大学周围未开花的植株.
接种物:分为未酸化接种物和酸化接种物两种.两种接种物都是猪粪与紫茎泽兰混合物(猪粪2 500 mL+紫茎泽兰2 500 mL+水5 000 mL).未酸化接种物pH在7.0左右.酸化接种物是在未酸化接种物正常产气的情况下,每天使用浓度为20%的盐酸调节接种物pH,使其pH维持在5.0左右.两种接种物的驯化时间均为50 d.
pH调节液:实验室自配20%盐酸溶液;
1.2 实验装置
1.2.1 未酸化预处理实验装置
使用实验室自制室温批量式发酵装置发酵,采用排水集气法收集气体,实验装置图如图1.
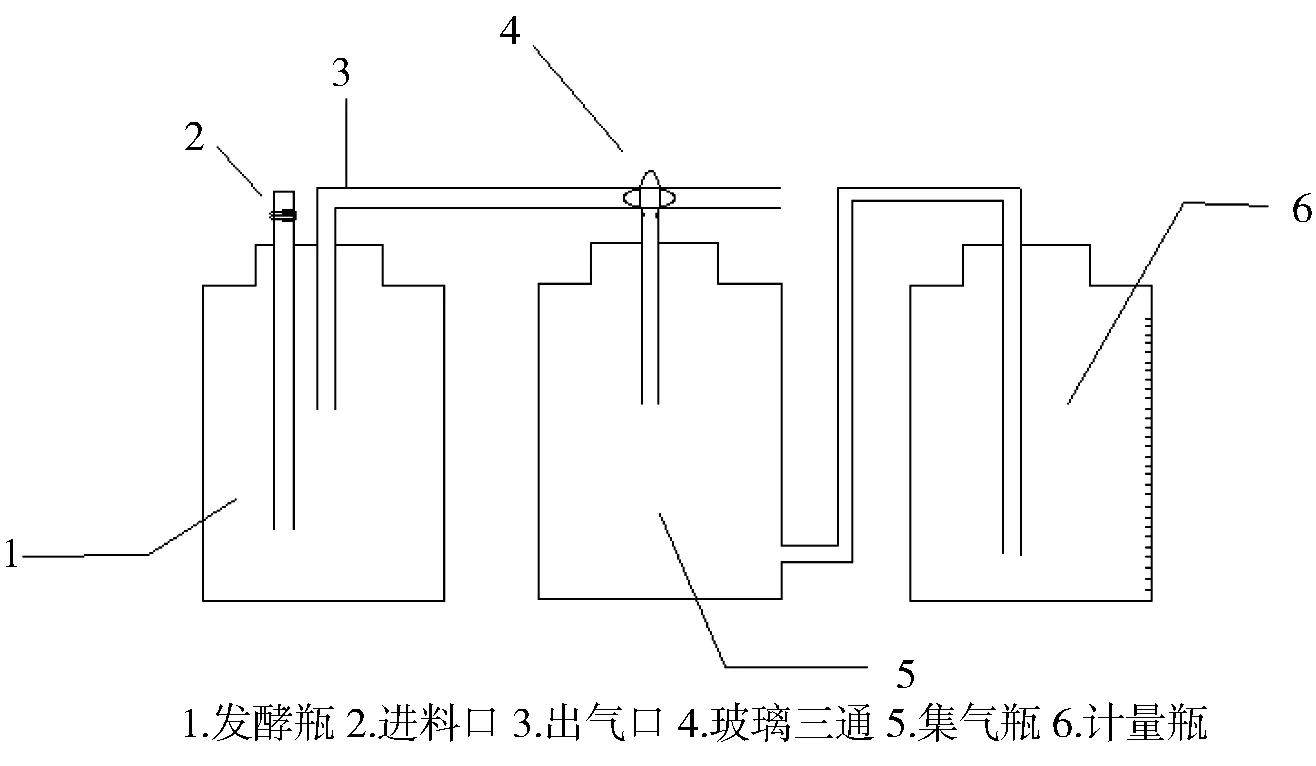
图1 实验1组发酵装置图
1.2.2 酸化预处理实验装置
使用实验室自制室温两相批量式发酵装置发酵,采用排水集气法收集气体,实验装置图如图2.

1.调酵预处理发酵瓶进料口 3.出气口 4.玻璃三通 5.集气瓶 6.计量瓶 7.甲烷发酵瓶甲烷发酵相进料口 9.集气瓶 10 玻璃三通 11.计量瓶
1.3 实验方法
1.3.1 实验设计
实验1组发酵料液未经酸化预处理,实验2组发酵料液经过酸化预处理,此外还设对照组.3组均设两个平行.
实验1组料液配方:接种物500 mL+每天5 mL新鲜紫茎泽兰汁(投料10 d)=550 mL;
实验2组料液配方:接种物500 mL(酸化罐)/接种物500 mL(未酸化罐)+每天5 mL新鲜紫茎泽兰汁(投料10 d)=每个罐中550 mL;
对照组料液配方:接种物500 mL+水50 mL=550 mL;
3个组均在室温条件下进行厌氧发酵,其中实验1组和实验2组在实验启动正常发酵后每天添加新鲜紫茎泽兰汁5 mL,对照组则不加料.实验1组按照常规的批量式厌氧发酵进行启动.实验2的发酵罐由两部分组成,其中一个作为酸化罐,另一个作为未酸化罐.进料时,发酵原料先经过酸化罐预处理(预处理时间为一天),然后再流入未酸化罐中进行厌氧发酵.实验过程中适时对发酵原料、接种物以及发酵前后料液TS、VS的含量和pH进行测定且每天定时进出料.
1.3.2 分析项目及方法
pH值:采用精密试纸进行测定;
产气量:采用排水集气法收集气体,每天下午定时进行读数.以两个平行样的产气平均值为该组的表征产气量;
TS、VS含量测定:采用沼气发酵常规方法进行测定[6];
COD测定:采用重铬酸盐法进行测定(GB11914—89).
木质纤维素测定:采用重量法进行测定[7];
1.3.3 数据处理
本次试验的能源转化效率可由下式计算:
其中,甲烷的热值为35.822 J/mL[6],紫茎泽兰的热值为17 220 J/g[9].
2 结果与分析
2.1 产气情况分析
图3为实验1组的产气量(两个平行样产气量的平均值)随发酵时间的变化.从图中可以看出实验1组发酵周期为27 d(根据实验组、对照组产气趋势是否一致可以判断发酵是否进行完全),启动后第1天开始产气且可以点燃,火焰呈蓝色,说明实验1组启动较快.第2天,产气量达到整个发酵周期的最大产气量60 mL.第3~26天,产气量逐渐在5~30 mL之间变化,这可能因为投料时沼气发酵体系发生改变,从而影响到紫茎泽兰产气的稳定性.第27天后,紫茎泽兰的产气量为0 mL,说明其产气周期结束.该次实验紫茎泽兰整个产气周期的总产气量为452 mL.(实验1发酵前后料液TS、VS、pH变化如表1所示.)
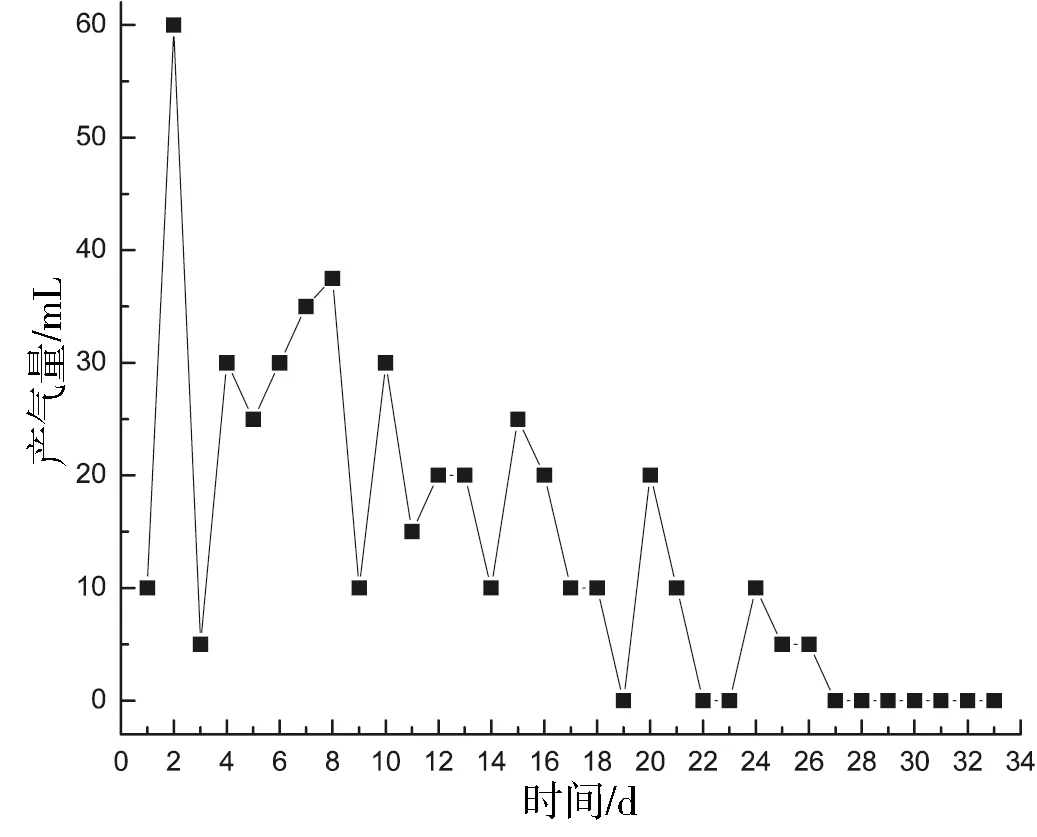
图3 实验1组产气曲线
表1实验1组料液TS、VS、pH分析
Table 1 Analysis on TS,VS and pH of the fermentation material for experiment 1

TS/%VS/%pH发酵前/后6.29/4.9068.94/64.987.0/6.8

表2 实验2组料液TS、VS、pH分析
实验2组产气曲线如图4所示.从图可知,实验2组发酵时间为33 d,多于实验1组的27 d.第1~10天紫茎泽兰产气量为0 mL,说明实验启动较慢,原因可能是原料经过酸化预处理,pH较低,影响沼气发酵的正常启动.从第11天开始,紫茎泽兰开始逐渐产气,但产气不稳定,上下波动,这可能由于酸化的发酵料液对紫茎泽兰发酵体系有一定影响造成的.第24天,产气量开始逐渐下降.发酵至第33天后,紫茎泽兰的产气量均为0,说明该产气周期结束.紫茎泽兰33天发酵时间内,其总产气量为780.5 mL.
实验2组发酵前后料液TS、VS、pH变化如表2所示.由表可知,未经酸化预处理发酵的VS原料利用率比酸化预处理的原料利用率高.这可能是因为实验2组发酵仍在进行中,没有发酵完全.
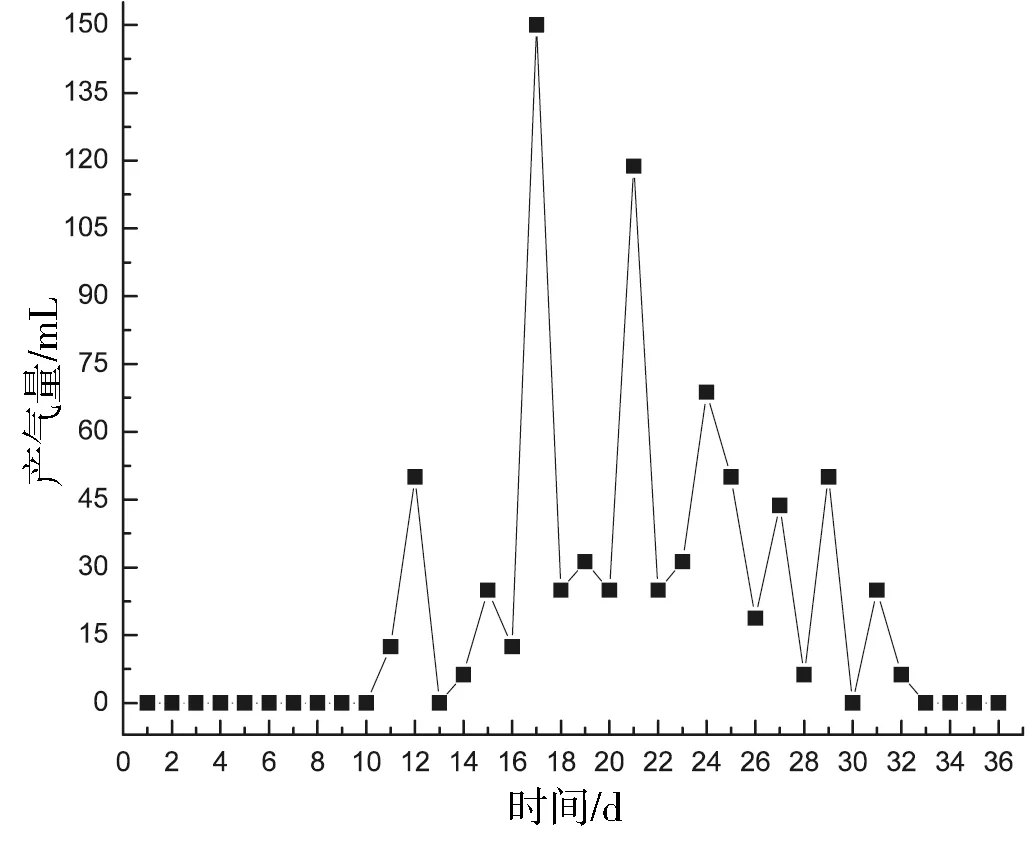
图4 实验2组产气曲线
2.2 产气潜力分析
实验1组共进行27 d,实验2组共进行33 d.各实验产气情况及潜力见表3.从表中可以看出,实验2组产气率高于实验1.实验2组原料的TS产气率和VS产气率分别比实验1组的TS产气率和VS产气率高42.02%和42.05%.同时实验2组的日产气率也比实验1组高31.82%.
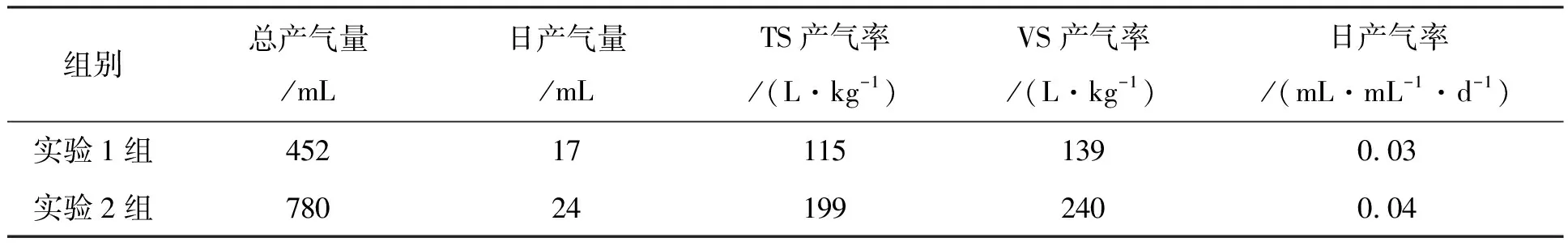
表3 紫茎泽兰厌氧发酵产气潜力
2.3 COD降解分析
紫茎泽兰发酵前和发酵后的COD值如表4所示.从表中可以看出,实验1组和实验2组发酵前COD值都为5 273.00 mg/L,而发酵后实验1组的COD降解到2 944 mg/L,实验2组的为2 033 mg/L.实验1组的COD降解率为44.07%,实验2组的COD降解率为61.50%.实验2的COD降解率比实验1组的高17.43%.
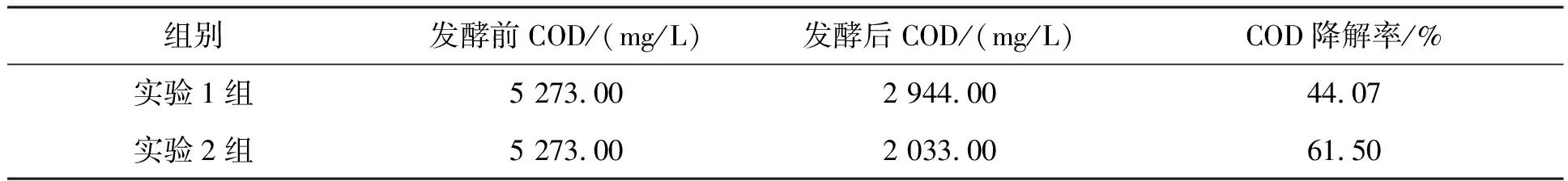
表4 紫茎泽兰厌氧发酵COD降解率分析
2.4 半纤维素、纤维素、木质素含量分析
紫茎泽兰汁厌氧发酵前后的半纤维素、纤维素及木质素含量及利用情况见表5.从表中可以看出,实验1组、实验2组的木质纤维素利用率均不高.但相对来讲,实验2组的半纤维素、纤维素、木质素利用率均高于实验1组,分别是实验1组的2倍、1.67倍和3.17倍.
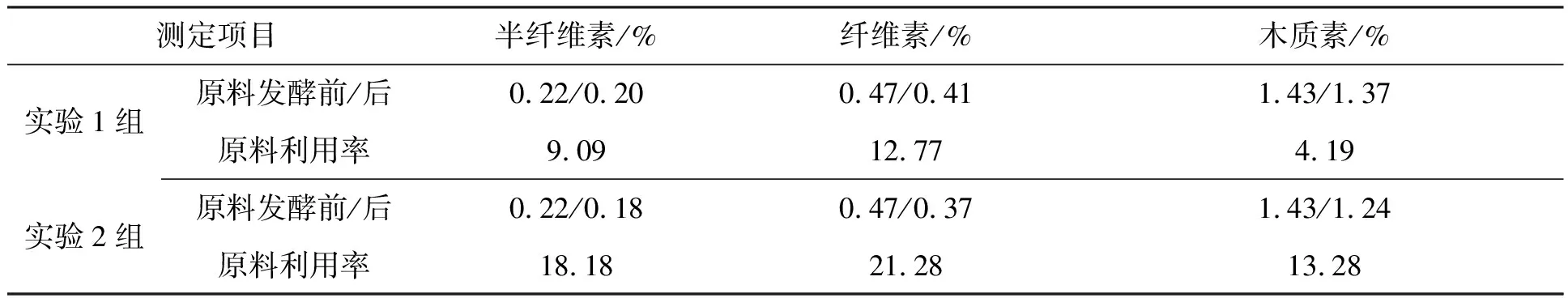
表5 紫茎泽兰厌氧发酵纤维素、半纤维素、木质素含量分析
3 讨 论
3.1 厌氧发酵原料利用率比较
沼气发酵经过三个阶段,分别是水解阶段、产氢产酸阶段和产甲烷阶段.经过酸化预处理和未经过酸化预处理的实验结果是有差别的.经过酸化预处理,紫茎泽兰中的化学成分得到充分降解,经实验证明体系酸化环境有利于原料纤维素、半纤维素、木质素等物质的降解利用[9].所以酸化预处理实验组发酵情况在某种程度上优于未酸化预处理的实验组.
如果以实验2组产气的各项指标值为1,实验1组产气各项指标值与实验2组相比,可直观地比较两个过程的不同,见图5.由图中可知,实验1组各项指标值均低于实验2组.但实验1组发酵周期较实验2组有所缩短,有利于节约成本.造成这一现象的原因是实验2原料首先经过酸化预处理,纤维素、半纤维素、木质素等物质的降解率提高了,体系中的代谢产物包括乙醇、乙酸、丙酮酸、丁酸以及其他有机酸等的可利用率也随之提高,产甲烷菌可利用底物含量也随之提高.
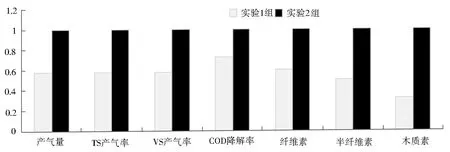
图5 产气阶段各项指标比较
紫茎泽兰未经酸化预处理发酵的TS、VS产气率分别为115 L·kg-1、139 L·kg-1;而紫茎泽兰经过酸化预处理发酵的TS、VS产气率分别为199 L·kg-1、240 L·kg-1;其次,从COD降解率方面来讲,酸化预处理实验组在相同时间内COD降解率比未经过酸化预处理实验组的COD降解率高出了17.43%;最后,实验1组的木质纤维素利用率低于实验2组,酸化预处理实验的纤维素、半纤维素、木质素的原料利用率分别比未经酸化预处理实验组的利用率高60.1%、50%、31.55%.总之,原料经过酸化预处理发酵比原料未经酸化预处理发酵的原料利用率高.
酸化预处理实验组发酵周期延长是由于发酵体系中各种微生物对环境的适应能力造成的.为了克服这一缺陷,可以尝试在酸性条件下,对产酸产氢菌进行驯化,从而富集相关菌群,实现产氢产甲烷联合发酵,从而缩短发酸周期并进一步提高原料利用率.
3.2 能源转化效率比较
在原料厌氧发酵过程中,原料的能源转化效率是衡量厌氧发酵品质的重要指标.本次实验的能源转化效率与文献值[10],见图6.其中甲烷含量按48.58%计算[5].
由图6可知,实验1组、实验2组的能源转化效率分别为23.73%、42.13%均高于文献值.原料经过酸化预处理可以提高原料的能源转化效率,经过酸化预处理的紫茎泽兰发酵可提高能源转化效率48.85%,而未经过酸化预处理的紫茎泽兰发酵仅提高能源转化效率9.19%.
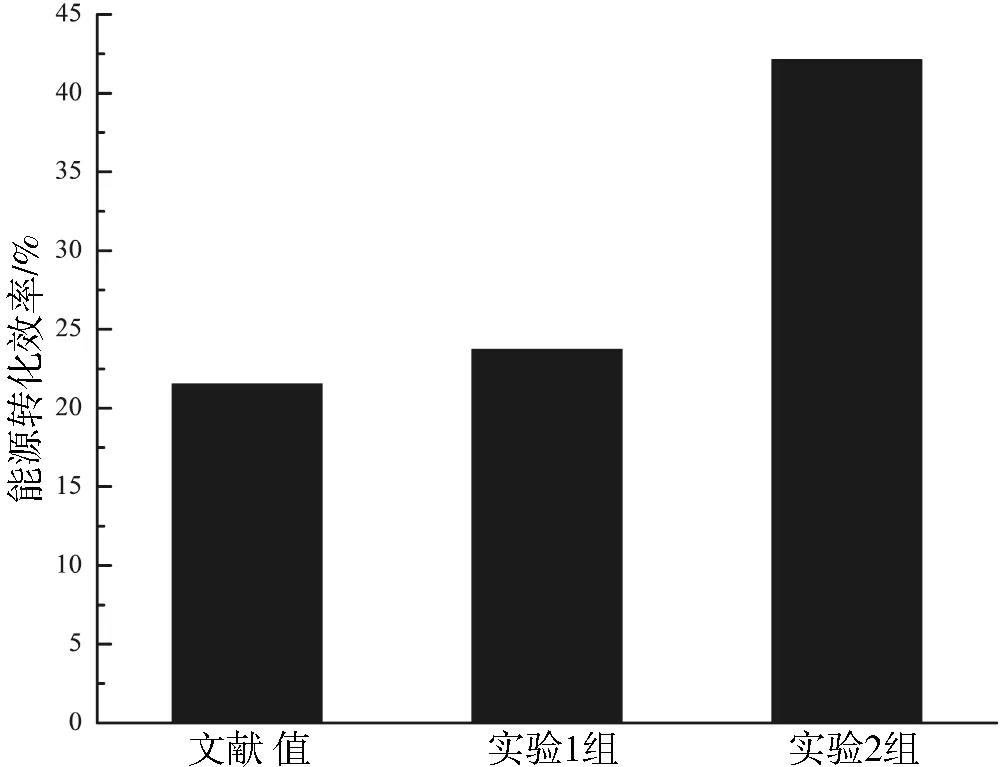
图6 两个实验组的能源转化效率
4 结 论
⑴紫茎泽兰未酸化预处理发酵实验,TS产气率、VS产气率分别为115 L·kg-1、139 L·kg-1;紫茎泽兰酸化预处理发酵,TS产气率、VS产气率分别为199 L·kg-1、240 L·kg-1.
⑵酸化预处理发酵和未经酸化预处理发酵的COD降解率分别为61.50%和44.07%,其前者比后者高出17.43%.
⑶酸化预处理发酵实验的纤维素、半纤维素和木质素的利用率分别为21.28%、18.18%、13.28%;未经酸化预处理实验的纤维素、半纤维素、木质素的利用率分别为12.77%、9.09%、4.19%.纤维素、半纤维素、木质素利用率前者分别是后者的1.67倍、2.00倍、3.16倍.
⑷酸化预处理发酵和未酸化预处理发酵的能源转化效率分别是23.73%和42.13%.酸化预处理产甲烷比未酸化预处理产甲烷,表现出更好的原料利用率和能源转化效率.其能源转化效率是未经过酸化预处理发酵的1.78倍和文献值的1.95倍.
参 考 文 献:
[1] 李丽,张无敌,尹芳.紫茎泽兰的各种利用研究[J].农业与技术,2007,27(4):51-54.
[2] LU Z J,MA K P.Spread of the exotic croftonweed(Eupatoriumadenophorum)across southwest China along roads and streams[J].Weed Science,2006,54(6):1068-1072.
[3] 赵国晶,马云祥.云南省紫茎泽兰的分布与危害的调查研究[J].杂草学报,1989,3(2):37-40.
[4] 尹芳,黄梅,徐锐,等.紫茎泽兰的危害及其综合利用进展分析[J].灾害学,2009,24(4):63-67.
[5] 胡觉,张无敌,尹芳,等.紫茎泽兰连续发酵产沼气实验研究[J].农业与技术,2006,26(4):33-36.
[6] 仁杰,刘洪位,郭莉,等.紫茎泽兰化学成分初步研究[J].广州化工,2011,39(15):123.
[7] 王秀菊,曾国揆,刘士清,等.玉米芯厌氧消化产气实验研究[J].安徽农学通报,2006,12(10):55-57.
[8] 张无敌,宋洪川,尹芳,等.沼气发酵与综合利用[M].昆明:云南科技出版社,2004.
[9] 余晓华,江蕴华,张无敌,等.微生物降解紫茎泽兰毒素的初步研究[J].云南大学学报:自然科学版,1995,17(3):259-263.
[10]尹芳,胡觉,张无敌,等.紫茎泽兰产氢产甲烷联合发酵的研究[J].科学通报,2010,55(36):3469-3476.
[11]江蕴华,张无敌,谷林茂,等.延长紫茎泽兰发酵滞留期的研究[J].云南大学学报:自然科学版,1989,11(1):51-55.

