丹参素及其衍生物合成方法的研究进展*
李俊鹏, 杨涵, 陈家林, 周利民, 崔浩, 陈立桥
(1.昆明贵金属研究所 稀贵金属综合利用新技术国家重点实验室,云南 昆明 650106;2.湖北文理学院 低维光电材料与器件湖北省重点实验室,湖北 襄阳 441053)
1 丹参素的药理活性及结构特点
1.1 丹参素的生理药理活性
丹参素是唇形科植物丹参(SalviamiltiorrhizaBge)中的主要药用成分,具有广泛的生理药理学活性,临床上应用于扩张冠状动脉、抑制血小板聚集和心肌细胞凋亡、抗血栓和防止动脉粥样硬化、保肝护肝、抗炎和增强机体免疫等等[1].目前,丹参素主要是从中药丹参中提取.丹参素的化学性质不稳定,一是分离、合成过程中易消旋、易氧化,给分离、纯化造成困难;二是生物体内代谢的脂溶性差、体内代谢不稳定,大鼠体内的生物利用度为14.18%,而SD大鼠口服生物利用度仅为9.53%;因此,开发具有适当脂溶性、物化性质稳定及体内代谢时间较长的丹参素衍生物是丹参素类药物研发的重点.
目前,大量研究致力于分离提取工艺,提高了其分离的产率和效率,但仅仅依靠从中药中分离获得丹参素还远不能满足需要[2].近年来,利用细胞工程、基因工程等现代生物技术对丹参作了应用性研究,但存在代谢产物繁多、分离提取步骤复杂、干扰因素众多及产率较低等诸多问题,难以实现工业化应用.而利用化学方法合成是获得丹参素的重要途径之一.本文就丹参素衍生物的合成方法进行了归纳和总结.
1.2 丹参素的结构特点

图1 丹参素及部分丹参素类药物的结构
图1给出了丹参素及部分丹参素类药物的结构[3].丹参素的结构包括三个部分.第一部分是左边的儿茶酚结构,第二部分是右边的疏水酯基部分,第三部分是中间的(R)-羟基.目前,对丹参素结构的改造,主要是从这三个方面入手,同时,这三部分对丹参素的药理、药效以及药代学的影响也是不同的.
儿茶酚(即3,4-二羟基苯基)结构是丹参素体内外抗氧化及抗自由基损伤的活性药效团[4].大量研究表明,具有儿茶酚结构的化合物,如咖啡酸、咖啡酸苯乙酯、肾素等等,都具有清除自由基的能力.虽然目前其具体作用机制尚未明确,但是可以肯定的是,儿茶酚结构是丹参素抗心肌缺血再灌注作用的主要药效基团.不过,令人困扰的是,该类结构的物化性质不太稳定,溶液中易被氧化为醌式结构,降低其生理活性.对策之一是将这两个羟基用不同的官能团保护,进入体内后,在到达药物作用靶点前,在生理环境中脱去保护基,从而增加了其化学稳定性以及体内代谢稳定性,有利于制备、制剂及给药形式的开发.第二部分疏水酯基的变化是丹参素类药物多样性开发的重点,如处于临床2期研究的丹参素异丙酯主要用于抗高原反应[5],丹参素降冰片酯用于抗脑缺血[6]等(结构见图1).丹参素类药物与其作用靶点结合时,受体可能会有一个疏水腔,通过疏水作用与药物结合,从而启动下游通路[7].第三部分是药物化学研究的难点,原因有二:一是易消除,生成咖啡酸的结构,二是易消旋,生成外消旋化合物.因此,如何简单、高效的构建该手性羟基是药物化学和有机化学研究的重点内容之一.
2 丹参素外消旋体的合成
丹参素的外消旋体,即(±)-丹参素特殊的结构很早就引起了有机化学家的关注,具体的合成路线较多,基本策略是从α-羰基羧酸(酯)的还原得到丹参素或其衍生物.因此,从关键中间体α-羰基羧酸(酯)的制备入手,可归纳为两类较成熟的合成路线:
2.1. Knoevenagel缩合路线
1992年,黄乃正发展了乳酸衍生物的合成(图2)[8].该路线以3,4-二羟基苯甲醛为原料,与乙酰甘氨酸的Knoevenagel缩合反应得到噁唑酮衍生物,并探讨了Knoevenagel缩合后由烯胺制备α-羟基羧酸酯的合成条件,开环后经烯胺中间体合成关键中间体α-羰基酸衍生物;随后通过各种方法还原羰基得到丹参素(或其衍生物).

图2 Knoevenagel缩合路线
2005年,邓喜玲等采用该路线,以5步、31%产率得到了丹参素的外消旋体;其中,第四步采用的Clemmenson还原条件,还原α-酮酸为α-羟基酸,产率为66%,该路线将烯胺的水解和还原反应分开,总反应产率稳定[9].
同年,冯淑华小组也采用该路线,但是还原α-酮酸时所用的试剂是KBH4,反应条件相对温和,同时将两个酚羟基用乙酰基保护,在一定程度上增加了丹参素的稳定性[10].
2008年,郑晓辉小组采用该路线,合成了丹参素的外消旋体,同时也合成了丹参素的酰胺衍生物,随后从孪药的思路出发,用传统的合成方法将丹参素与非天然氨基酸缩合得到了丹参素酰胺衍生物[11].
2011年,张群正小组针对Knoevenagel缩合及开环反应的时间较长,产率较低的问题,采用微波辅助催化技术,将反应时间从5 h和4 h分别降低到15 min和8 min,同时产率略有增加[12].由此可见,新的合成技术和方法对丹参素的合成是十分有帮助的.
2.2 Darzens缩合路线
该合成路线也是以3,4-二羟基苯甲醛为起始原料,经关键步骤Darzens缩合[13]反应合成苯基环氧乙烯酯衍生物,再选择性开环,得到α-羟基酸衍生物,这路线虽然增加了保护/脱保护两步,但是总产率与前一路线基本接近.
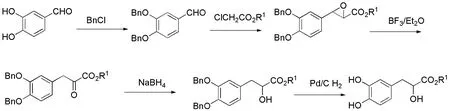
图3 Darzens缩合路线
2007年吴松小组采用该路线,以3,4-二羟基苯甲醛为起始原料,经六步反应,以48.4%产率得到了丹参素的外消旋体.其中Darzens缩合反应是一步构建碳-碳键及环氧键的关键反应.该小组通过将催化剂四丁基硫酸氢铵改为苄基三乙基氯化铵(TEBAC) ,使反应时间由原来的5 d缩短为1 d[14].
2009年,张群正小组采用类似路线合成了丹参素的降冰片酯,总产率为29%[15].第二步的缩合反应中,当采用疏水的、大体积的降冰片酯时,产率较低,这可能与空间效应和电子效应都有关系.值得注意的是,作者讨论了氯乙酸酯中酯基对Darzens缩合反应影响,同时,也通过该反应引入丹参素衍生物所需的具有适当空间大小和疏水性质的酯基.
2010年,顾军小组研究了芳环上不同取代基对Darzens缩合反应的影响,结果显示Darzens反应能容忍大部分保护基,其中双苄基保护的3,4-二羟基苯甲醛的产率较低[16].
2010年后,有机化学家开始关注第三、四步的反应,并试图将开环和还原反应合二为一,即从环氧化合物一步得到α-羟基酸衍生物,当然该步反应需要温和的还原性条件以及合适的选择性,目前来看似乎效果不理想.
以上这些合成方法只针对(±)-丹参素的合成,都无法获得光学纯的(R)-丹参素.大量研究表明,化学合成的(±)-丹参素与天然的(R)-丹参素在药理、药效以及药代方面明显不同,甚至表现出相反的活性[17-19].同时,根据新药申报的标准,要求区分化合物的不同异构体(包括对映异构体和非对映异构体)为不同的化学实体.因此,光学纯丹参素的合成也是药物化学关注的重点之一.
3 光学纯丹参素及其衍生物的合成
3.1 酶拆分法
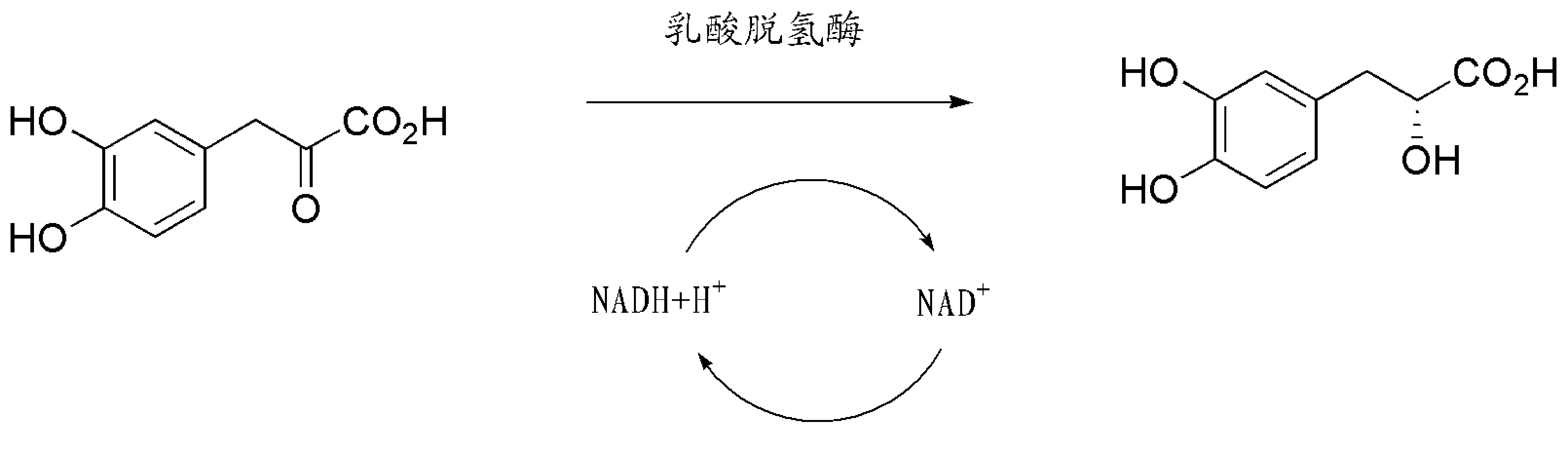
图4 酶拆分光学纯丹参素的路线
2005年,Findrik小组成功地利用了来源于细菌Lactobacillusleishmannii的D-乳酸脱氢酶立体选择性的还原α-羰基酸衍生物(图4),从而得到了(R)-丹参素[20].该方法可以获得几乎100%光学纯的(R)-丹参素,但是缺点是该酶的分离、纯化比较困难,且反应过程中需要NADH/NAD+氧化还原体系的参与,拆分条件不易控制.
3.2 从原料引入手性中心的方法
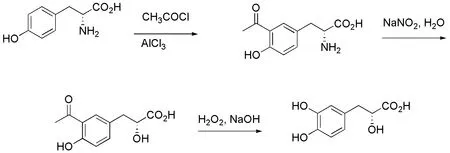
图5 借助原料中手性氨基的路线
从结构特点上来看,丹参素是α-羟基-β-苯基的羧酸衍生物,与酪氨酸的α-氨基-β-苯基羧酸的结构类似,中心碳原子的绝对构型相同,主要的不同是:α-位的官能团,一个是氨基,一个是羟基.基于此,Bogucki小组用(S)-酪氨酸为原料通过傅克酰基化,重氮化反应,Dakin反应,合成了(S)-丹参素,即为天然丹参素的对映异构体[21].于沛小组从(R)-酪氨酸出发,经相似步骤合成了(R)-丹参素(图5)[22-23].该合成路线充分利用了原料中的手性碳原子,降低了不对称合成的成本.合成中需要注意的是在傅克酰基化过程中,较强的酸性条件容易使得原料中的手性氨基消旋化,因此对于反应条件的要求是比较苛刻的.
3.3 不对称催化氢化方法
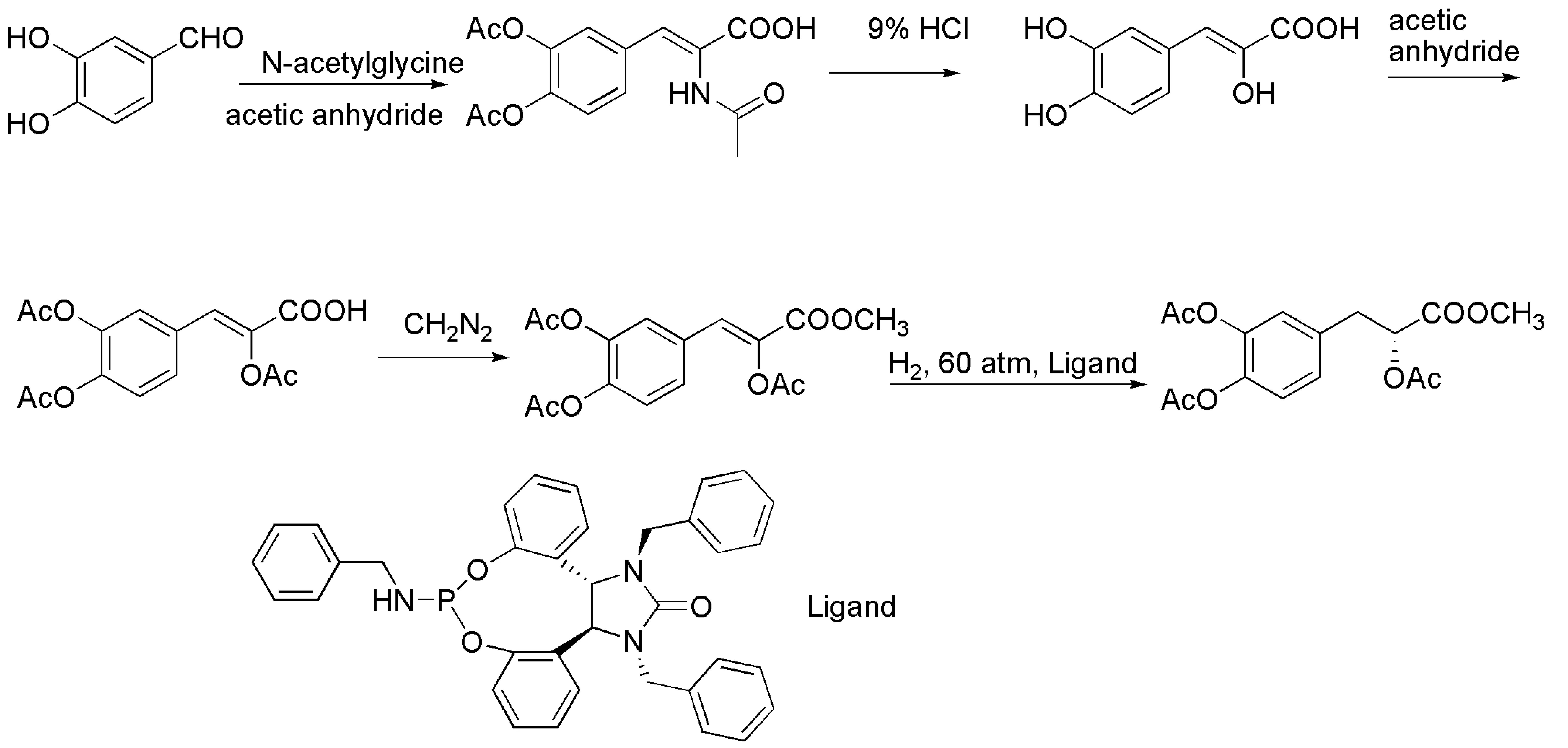
图6 不对称催化氢化的合成路线
该路线利用双键的不对称催化氢化来构建手性碳原子,即先合成苯乙烯衍生物,然后不对称还原得到手性碳,再通过官能团转化合成丹参素衍生物.王洋小组即采用这一路线(图6)[24].以3,4-二羟基苯甲醛为原料先合成α-羰基酸衍生物,进而用酯基保护烯醇化后的α-醇羟基得到关键中间体α,α-酯基-β-苯基烯烃的衍生物,随后在[Rh(cod)2]BF4和手性配体的催化下加氢,得到了一系列不同保护基和酯基的丹参素衍生物,最高产率89%,对映选择性92%.同时,该小组对该类衍生物的药效团和药动团进行了初步的筛选.该合成路线充分利用了较为成熟的不对称催化氢化技术,有多种催化体系,为以后的工业化操作提供方便.值得一提的是该催化氢化底物不是很稳定,易生成α-酮酸或共轭烯烃结构,虽然可以使用保护基,但无疑会增加合成步骤.
3.4 不对称环氧化方法
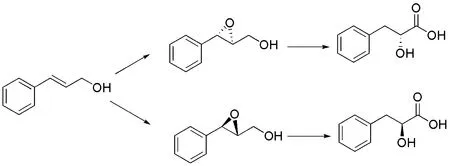
图7 Sharpless环氧化的合成路线
该路线从醛出发,先合成苯乙烯衍生物,然后通过Sharpless环氧化引入手性中心,选择性开环后得到手性α-羟基酸(图7).楼亚平、邵以德小组即采用这一路线,即先合成具有酯基苯乙烯结构的E-肉桂醇,随后利用sharpless不对称环氧化得到绝对构型确定的、酯基取代的环氧苯乙烯,催化氢化开环后得到所需的丹参素衍生物.该合成路线的优点是双键的不对称环氧化有多种催化体系,而这些催化体系有工业化应用的成功案例.不足之处可能是在环氧原料的制备上.它需要通过多步反应才能得到苯乙烯衍生物,而后进行不对称环氧化.随后,该小组从苯环的代谢稳定性出发,用氟替代苯环对位上的氢,采用类似的方法合成了对氟苯基乳酸及其衍生物[25].同样为了提高丹参素的代谢稳定性,特别是I相代谢稳定性,朱依谆等人在苯环的邻位引入硝基,效果明显[26].
3.5 不对称双羟化/脱羟基方法
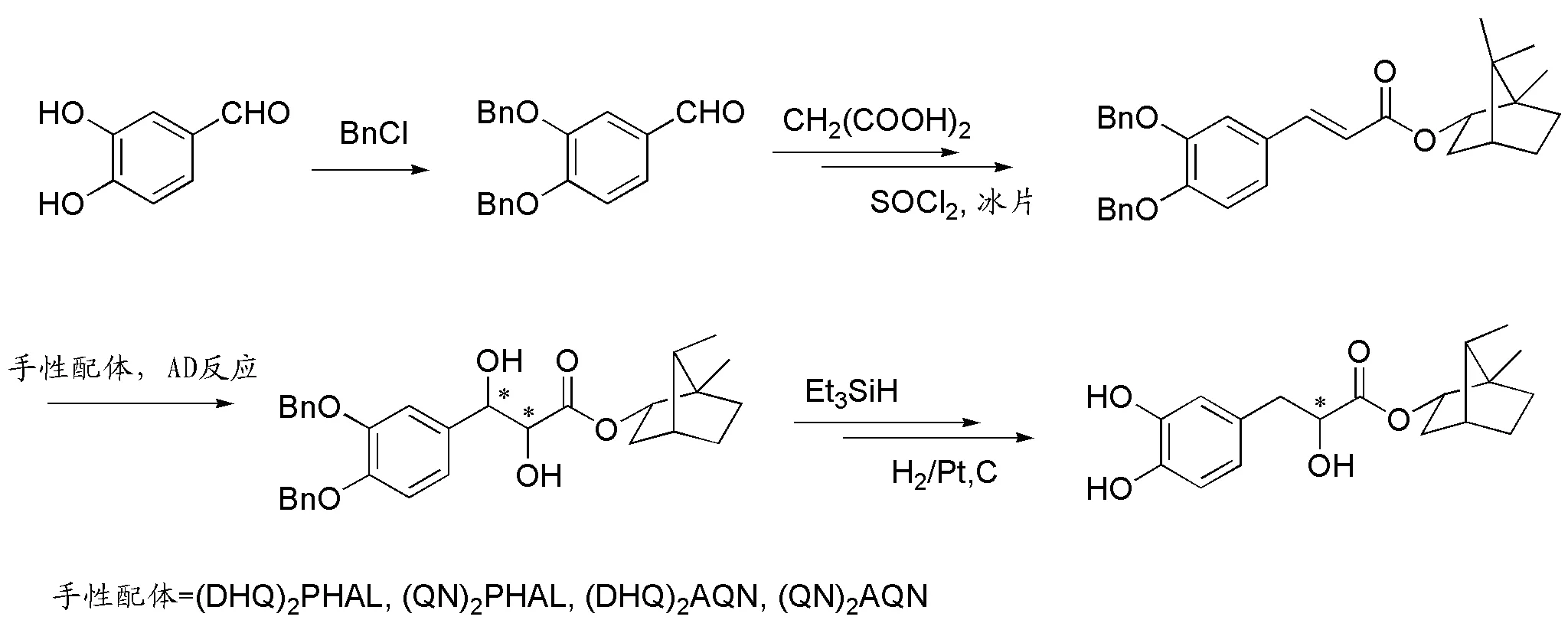
图8 Sharpless双羟化的合成路线
2011年,姜茹等采用Sharplass不对称双羟化合成了丹参素的冰片酯.该路线也是从儿茶酚醛出发,保护后合成苯乙烯衍生物,通过Sharpless双羟化引入两个手性羟基,随后在三乙基硅氢条件下,脱除苄位的羟基,保留手性α-羟基结构(图8)[27].该路线得到的丹参素冰片酯的光学纯度非常高(大于99.9%).
4 展 望
丹参素及其衍生物独特的结构和广泛的生理药理活性是吸引化学工作者的关键.因此,新的合成方法及丹参素(及其衍生物)结构与生理药理活性间的关系是今后关注的焦点.
1)新的合成方法
新的合成方法,特别是关于手性α-羟基的构建方法是丹参素衍生物合成的关键.如何简单有效、高选择性的构建手性羟基是不对称催化合成所关注的重点.
2)新的构效关系
迄今为止,丹参素结构与药理活性的构效关系尚无系统的研究报道.当然这需要合成大量的衍生物,以及基于不同体内外模型,筛选的活性数据,建立其构效关系.另外,在分子水平认识丹参素衍生物的作用靶点及其可能的作用方式是丹参素类药物研发的重点.
参 考 文 献:
[1] 许本洪,崔庆彬,朱华,等.新型丹参素衍生物的合成与初步活性研究[J].中南药学,2011,29(2):83-88.
[2] 张相宜,赵青威,张幸国.盐酸水溶液提取丹参素的工艺[J].中国医院药学杂志,2010,30(15):1329-1331.
[3] 于晶晶,徐飞鹤.RP-HPLC同时测定香丹注射液中丹参素钠、原儿茶酚和丹酚酸B的含量[J].海峡药学,2012,24(2):45-47.
[4] HUANG L,DENG Y Y,ZHANG M W,et al.Comparisons between phenolic compounds and antioxidation ofMomordicacharantiaL. in different varieties[J].Agricultural Science & Technology,2012,13(6):1263-1269.
[5] 程亮星,岳云霄,王世祥,等.丹参素异丙酯对离体大鼠缺血/再灌注损伤心肌的影响[J].中国药理学通报,2010,26(8):1045-1049.
[6] 田海林,周晓伟,陈明,等.丹参素冰片酯的不对称合成研究[J].中国药物化学杂志,2012,22(2):113-116.
[7] FANELLI F,DE BENEDETTI P G.Update 1 of: computational modeling approaches to structure-function analysis of G protein-coupled receptors [J].Chem.Rev.2011,111(12):PR438-PR535.
[8] Wong H NC,Xu Z L,Chang H M,et al.A modified synthesis of (±)-β-aryllactic acids[J].Synthesis,1992,1992 (8):793-797
[9] 邓喜玲,陈学敏,江发寿,等.丹参素的合成[J].中国医药工业杂志,2005,36(9):523-524.
[10]张彦文,冯淑华.丹参素及其衍生物的合成[J].天津医科大学学报,2005,11(4):522-524.
[11]李小玲,单玉庆,张群正,等.丹参素及其衍生物的合成方法[J].药学专论,2008,17(10):17-19.
[12]张群正,贺天,熊迅宇,等.微波辅助合成丹参素[J].化学试剂,2011,33(3):259-262.
[13]DEMIR A S,EMURULLAHOGLU M,PIRKIN E,et al.Darzens reaction of acyl phosphonates with α-bromo ketones:selective synthesis of cis- and trans-epoxyphosphonates[J].J.Org.Chem.,2008,73(22):8992-8997.
[14]童元峰,郭晓赟,陈永浩,等.dl-丹参素的合成[J].中国药物化学杂志,2007,17(2):92-94.
[15]张群正,童岩,南叶飞,等.β-(3,4-二羟基苯基)-α-羟基丙酸异丙酯/冰片酯合成研究[J].有机化学,2009,29(9):1466-1469.
[16]孙举,顾军,李灵芝.丹参素衍生物的合成[J].合成化学,2010,18(2):215-218.
[17]TANG Y Q,WANG M H,LE X Y,et al.Antioxidant and cardioprotective effects of Danshensu (3-(3,4-dihydroxyphenyl)-2-hydroxy-propanoic acid from Salvia miltiorrhiza) on isoproterenol-induced myocardial hypertrophy in rats[J].Phytomedicine,2011,18(12):1024-1030.
[18]袁恒杰,陈宇华,任耘,等.丹参素钠对大鼠脑缺血再灌注损伤耐缺氧作用研究[J].中国医院药学杂志,2010,30(18):1545-1549.
[19]吴宗辉,戴立里,余斌斌,等.丹参素对IL-1β刺激的大鼠肝星状细胞JNK、NF-κB信号通道的影响[J].南方医科大学学报,2009,29(5):914-917.
[21]BOGUCKI D E,CHARLTON J L.A non-enzymatic synthes is of S-(-)-rosmarinic acid and a study of a biomimetic route to (+)-rabdosiin[J].Can.J.Chem.,1997,75(12):1783-1794.
[22]陈永红,续倩,赵增超,等.一种新的丹参素制备方法[J].中药材,2011,34(3):472-474.
[23]王玉强,于沛,王磊.一种丹参素的合成方法:中国,CN102153462A[P].2011-08-17.
[24]DONG C N,WANG Y,ZHU Y Z.Asymmetric synthesis and biological evaluation of Danshensu derivatives as anti-myocardial ischemia drug candidates [J].Bioorganic & Medicinal Chemistry,2009,17(9):3499-3507.
[25]周小鸣,薛芬,楼亚平,等.R-和S-β-氟苯基乳酸及其甲酯的合成[J].上海医科大学学报,1989,16(2):135-141.
[26]朱依谆,王洋,董村南.一种丹参素衍生物及其制备方法和在药学上的应用:中国,CN101607954A[P].2009-12-23.
[27]姜茹,郑晓辉,李晓晔.丹参素冰片酯的不对称合成方法:中国,CN102432468A[P].2012-05-02.

