基于PSS/PAH包被的AuNRs免疫传感器用于CEA的测定*
牛小方, 赵锦航, 郑丽, 杨云慧
(云南师范大学 化学化工学院,云南 昆明 650500)
1 引 言
癌胚抗原(CEA)最初由Gold和Freedman在1965年首次发现于结肠癌及胎儿肠组织中,其后的研究表明CEA是存在于细胞表面的富含多糖的蛋白复合物,相对分子量约为15 000~20 000[1].它是目前国际上公认的肿瘤标志物.在正常成人血清中含量甚微,而肿瘤患者的血清CEA水平会升高[2],当CEA浓度高于20 ng/mL时,则意味着可能患有消化道肿瘤.因此对CEA的研究对结肠癌、肺癌、胰腺癌、胃癌等恶性肿瘤的鉴别诊断、病情检测、临床诊断和术后复发转移检测均具有重要的意义[3-6].
已有多种检测方法用于血清中CEA的测定,包括酶联免疫法(ELISA)[7-9]、电化学免疫传感器(ECLIA)[10-11]、质谱分析法(MS)[12-13]、荧光检测法[14]、放射免疫测定法(RIA)[15-16].然而采用紫外可见分光光度法检测CEA的报道并不多见.
目前由于纳米技术的发展,各种各样的金纳米材料被应用于生物及医疗领域,包括生物传感器、药物运输、光热治疗、医学成像等[17-18],这是因为它们有着特殊的物理和光学性质.由于金纳米棒(AuNRs)是一种棒状的金纳米颗粒,特殊的形状使其具有更为奇特的性质.其突出的光学性质之一是有着纵向和横向两种表面等离子共振吸收峰,在可见光到近红外光区的光有着较强的吸收和散射能力[19-21],并且其制备方法简单,有着良好的稳定性质.通过自组装,AuNRs很容易得到具有一维(1D)、二维(2D)、三维(3D)的有序结构的自组装体系,使其在生物分子的检测、光学器件以及癌症治疗和检测方面有着重要的潜在应用[22].
本文将AuNRs的表面等离子共振现象和免疫分析技术相结合研究了一种新型的CEA免疫传感器.由于在AuNRs合成过程中需要用十六烷基溴化铵(CTAB)作为金纳米棒生长的保护剂和软模板,而CTAB具有生物毒性[23-25],所以必须去除其毒性效应.Wilson等发现利用聚苯乙烯磺酸钠(PSS)和聚丙烯氯化铵(PAH)之间的静电吸附作用而层层堆积(LBL)在AuNRs表面,这样可以覆盖AuNRs的生物毒性[26].然后通过戊二醛使PAH与CEA抗体(Ab)相交联,将Ab固定在AuNRs的表面,再用牛血清蛋白(BSA)封闭其表面未结合位点,以避免非特异性吸附作用.未加入CEA时,AuNRs在溶液中呈分散的状态,当加入CEA后,由于CEA与Ab发生特异性的作用,导致AuNRs发生自组装,从而引起AuNRs的表面等离子共振吸收发生变化.通过测定其吸收峰的变化,实现CEA浓度的测量.该方法克服了AuNRs上面的CTAB对生物分子的毒性效应,可用于CEA的定性和定量检测.
2 实验部分
2.1 试剂与仪器
CTAB、硼氢化钠(NaBH4)、硝酸银(AgNO3)、抗坏血酸(AA)、戊二醛购于国药集团试剂有限公司(上海);磷酸盐缓冲溶液(10 mmol/L,PBS)、聚苯乙烯磺酸钠(PSS)、聚丙烯氯化铵(PAH)、壳聚糖(CHIT)购于美国sigma公司;牛血清蛋白(BSA)、癌胚抗原(CEA)、CEA抗体(Ab)、氯金酸(HAuCl4)购于昆明铂锐金属材料有限公司;丝网印刷电极(TE100)购于台湾禅普科技有限公司;实验室所用水为二次蒸馏水.
UV-1800紫外可见分光光度计(日本岛津公司);一次性丝网印刷电极(台湾禅普科技有限公司);JOEL JEM-2100透射电子显微镜;TGL 16型离心机(长沙湘智离心机仪器有限公司);HY-2型多用振荡器(国华电器有限公司);CHI 660C电化学分析仪(上海辰华仪器公司).
2.2 实验过程
2.2.1 AuNR合成
AuNR的合成方法是在CTAB溶液的环境中通过种子介导的方法合成,主要步骤如下:取40.5 μL HAuCl4(2.346×10-2mol/L)溶液加入到4.0 mL CTAB(0.1 mol/L)溶液中,充分搅拌后溶液变为浅黄色.迅速注入24 μL NaBH4(0.1 mol/L)冰水混合物,继续搅拌直到溶液由浅黄色变为棕色.将溶液在28 ℃环境温度下静置2 h后得到种子溶液.取206 μL HAuCl4(2.346×10-2mol/L)和10 μL AgNO3(0.1 mol/L)于10 mL CTAB(0.1 mol/L)溶液中并搅拌.加入52.5 μL AA(0.1 mol/L),继续搅拌到溶液变为无色,向溶液中注入30 mol/L种子溶液,将其在28 ℃环境温度下静置3 h.将AuNRs在9 000 rpm的转速下离心分离,用二次蒸馏水洗涤后分散于蒸馏水中.最终得到长度约为40~50 nm,直径约为10~15 nm并且表面带有CTAB分子的AuNRs.
2.2.2 AuNRs的表面修饰过程
通过利用层层堆积(LBL)的作用,将AuNRs的表面氨基化,使其与Ab相互交联.修饰过程如下:取1 mL PSS(10 mg/mL)加入到5 mL AuNRs溶液中,在振荡器上振摇30 min,使带负电荷的PSS静电吸附到带正电的CTAB分子表面.然后加入1 mL 带正电荷且含有氨基的聚电解质PAH(10 mg/mL),继续摇振30 min,重复两次.最后AuNRs表面被PSS和PAH层层堆积在一起.将1 mL戊二醛(5%)加入到AuNRs中混匀后静置活化1 h,7 000 rpm离心分离,弃去上层清夜.用PBS洗涤三次,去除过量的戊二醛.将AuNRs分散在1 mL PBS中,加入100 μL Ab,室温下振摇约12 h,在9 000 rpm下离心分离5 min,弃去上层清夜.加入500 μL 5%的BSA振摇30 min以封闭AuNRs表面的非特异性结合位点.产物离心分离,用PBS洗涤以除去游离的Ab和BSA,最终得到表面带有Ab的AuNRs.
2.2.3 实验原理及流程
当向溶液中加入CEA后,其与Ab会发生特异性结合.由于Ab已经被修饰在AuNRs的表面,而使AuNRs相互吸附发生自组装现象,导致其紫外吸收峰的变化.随着CEA浓度的增加,其与Ab的结合数量增多,发生自组装的AuNRs也越多,紫外吸收峰变化的也越多.通过测量其长轴的吸收峰(840 nm附近)吸光度变化情况即可实现对CEA的定量测定.实验流程及原理如图1.
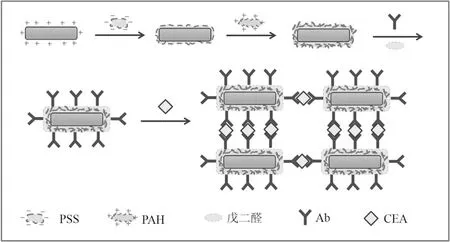
图1 免疫传感器检测CEA的原理示意图
3 结果与讨论
3.1 AuNRs在检测CEA前后的形貌表征
在对CEA检测的过程中,采用JEOL JEM-2100型透射电子显微镜(TEM)观察AuNRs在加入CEA前后的对比.从图2可以看出未加入CEA之前,AuNRs呈现良好的分散状态,未发生自组装(图2A).当加入CEA反应后,AuNRs相互之间相互吸附并且堆叠在一起,发生自组装现象(图2B).

图2 金纳米棒溶液在加入CEA的前后变化的透射电镜图
3.2 AuNRs表面不同修饰界面的电化学行为
用壳聚糖溶液将AuNRs固定到丝网印刷电极上,通过电化学交流阻抗法和循环伏安法可以用来表征物质在修饰过程中界面的变化情况[27].图3为AuNRs在修饰过程中各界面在含有5 mmol/L K3Fe(CN)6、5 mmol/L K4Fe(CN)6和0.1 mol/L KCl混合溶液中的电化学交流阻抗曲线和对应的循环伏安曲线.
图3A中曲线a为未修饰过的AuNRs在电极上的电化学交流阻抗曲线,只有较小的电化学阻抗值;曲线b为修饰过PSS之后的AuNRs电化学交流阻抗曲线,其阻抗值增大,表明PSS已修饰到AuNRs表面,阻碍了电子的传递.曲线c为PSS/AuNRs表面被修饰PAH之后的电化学阻抗曲线,电阻进一步增大,说明PAH已和PSS发生层层堆积现象;曲线d为PAH/PSS/AuNRs结合了抗体Ab之后的电化学行为,其电化学交流阻抗值最大,表明CEA抗体Ab已与PAH发生结合,并且固定到AuNRs表面.
图3B中,曲线a为AuNRs在丝网印刷电极上的循环伏安曲线(CV曲线),有一对可逆性较好的氧化还原峰,其氧化峰电流为27 μA;曲线b为PSS/AuNRs中CV曲线,此时仍然有较好的氧化还原峰,其氧化峰电流稍有降低,为12 μA;曲线c为PAH/PSS/AuNRs的CV曲线,其氧化峰电流进一步减小到5 μA,这表明电极表面仍允许电活性探针铁氰化钾通过其孔道进行扩散传质;曲线d为Ab/PAH/PSS/AuNRs的CV曲线,此时氧化还原峰几乎消失,表明CEA抗体Ab在AuNRs表面形成了稳定的Ab/PAH/PSS/AuNRs复合物,妨碍了K3Fe(CN)6/K4Fe(CN)6的扩散过程,AuNRs有了较强的特异性.
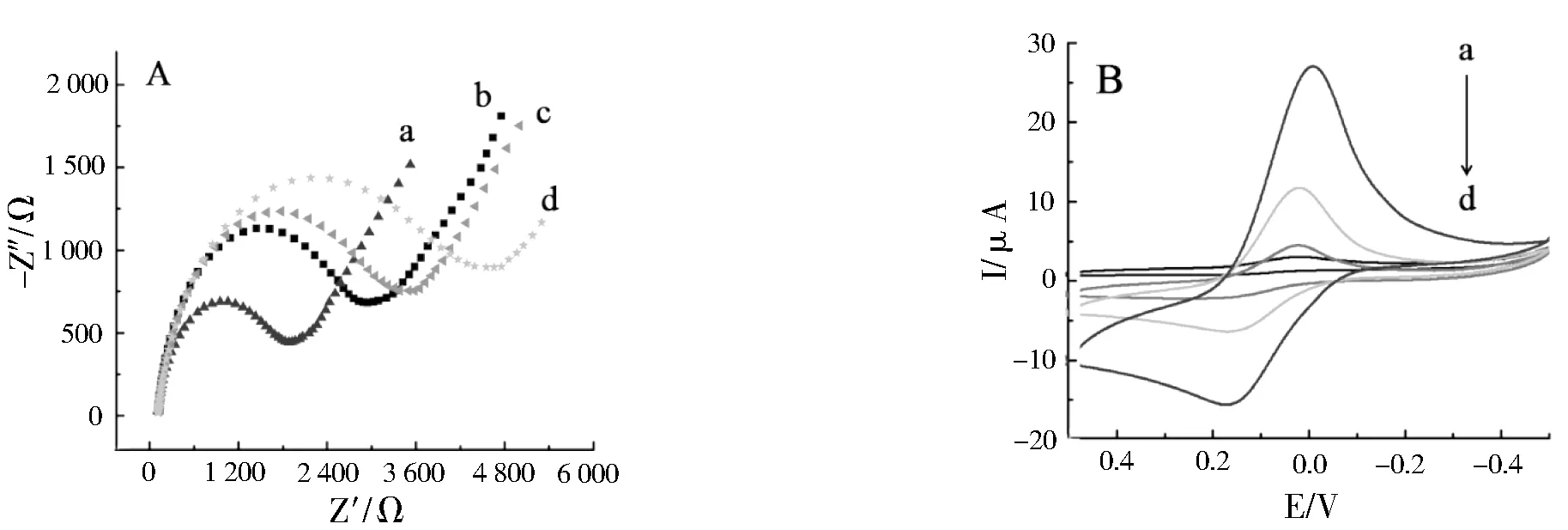
图3 不同表面修饰过程的金纳米棒在含有5 mmol/L K3Fe(CN)6、5 mmol/L K4Fe(CN)6和0.1 mol/L KCl 混合溶液中的电化学交流阻抗(A)和循环伏安曲线(B)
3.3 检测条件的优化
3.3.1 CEA与AuNRs的结合时间对紫外可见吸收强度的影响
Ab与CEA发生特异性结合的时间对AuNRs的自组装的性能有着至关重要的作用,图4表示CEA加入Ab/PAH-PSS/AuNRs溶液后,其紫外吸收峰强度随时间的变化曲线.由图可以看出在0~60 min区间内,随着时间的增加,其紫外吸收强度越来越小,在60~100 min区间,其紫外可见吸收强度变化很小,这表明在Ab与CEA结合时间为60 min时达到最佳结合状态,AuNRs发生自组装已达到稳定,所以选择60 min为CEA与Ab/PAH-PSS/AuNRs结合的最佳时间.
3.3.2 溶液的pH对CEA测定的影响
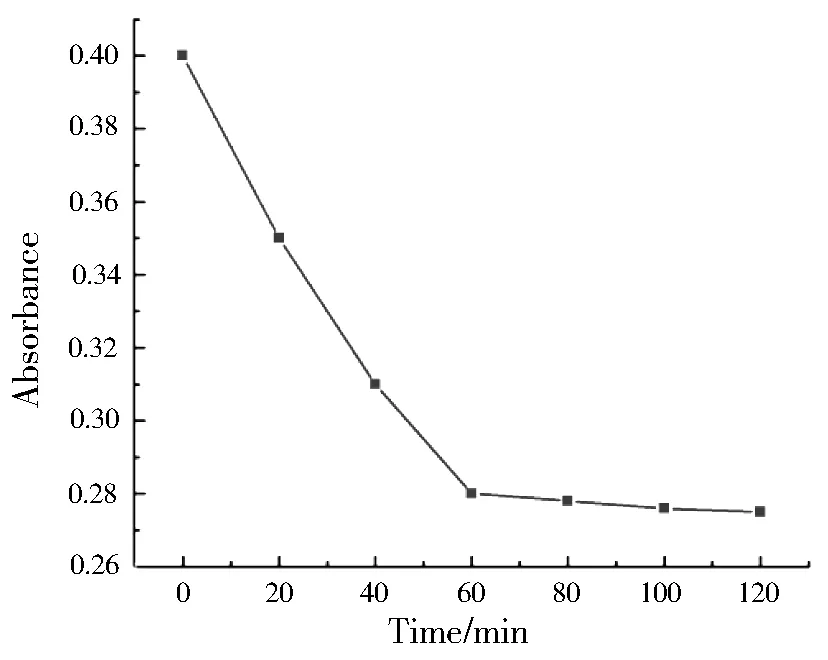
图4 CEA与金纳米棒的结合时间对紫外可见吸收强度的影响
Fig.4 Effect of the reaction time of CEA and AuNRs on Uv-Vis absorption intensity
考察溶液pH在6.8~8.0区间内变化时对CEA检测的影响(图5).结果表明,在pH为7.6的时候,其检测效果最好,所以选择pH值为7.6的溶液环境作为CEA的测试溶液.
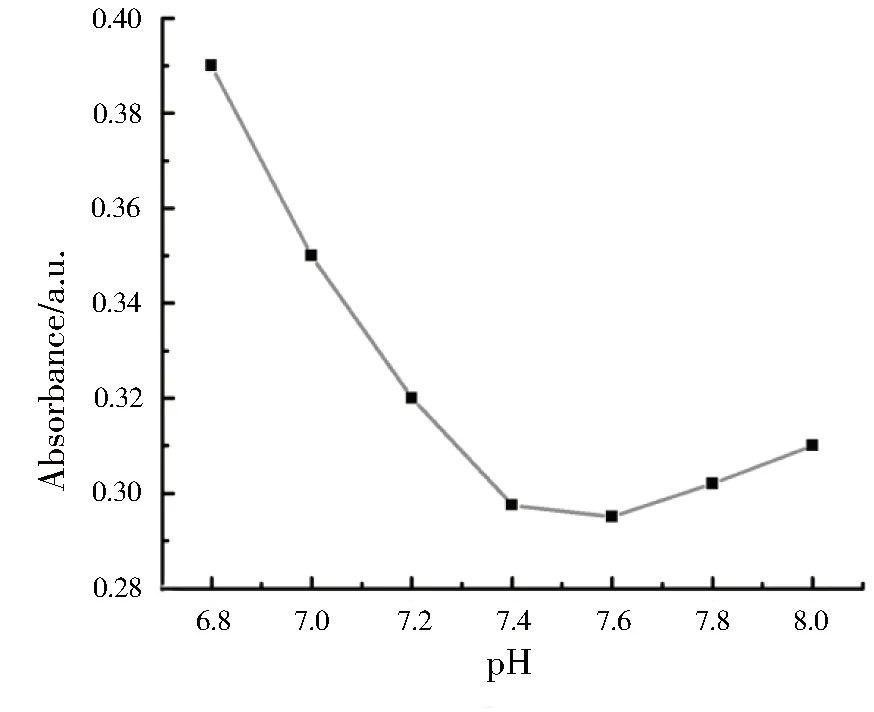
图5 溶液pH对紫外可见吸收强度的影响
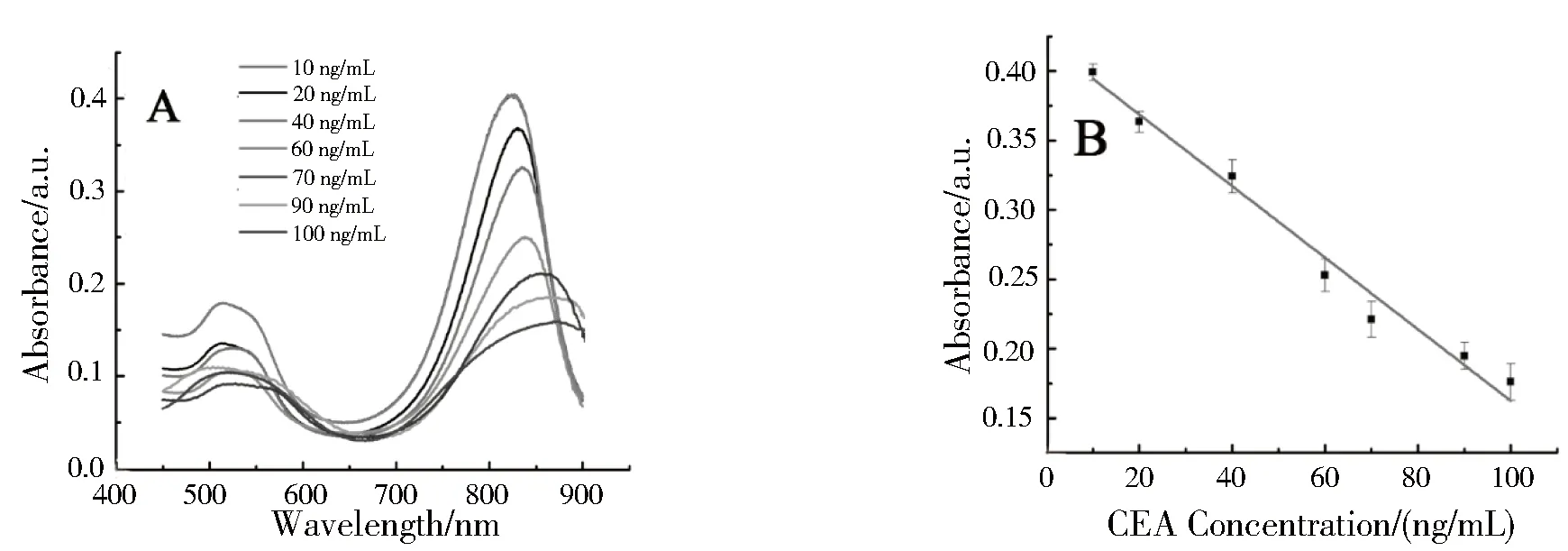
图6 免疫传感器检测不同浓度CEA时的吸收光谱图(A)和校正曲线(B)
3.4 传感器对CEA的检测性能
图6为传感器检测不同浓度的CEA时的紫外吸收曲线和校正曲线,在10~100 ng/mL的范围内有良好的线性关系,线性方程为y=2.102 6-0.013x(其中y为吸光度,x为CEA的浓度),检测下限为3.33 ng/mL.
3.5 抗干扰实验
在相同测试条件下,选择几种可能的干扰物质,如甲胎蛋白(AFP)(40 ng/mL)、免疫球蛋白(IgG)(40 ng/mL)、人绒毛膜促性腺(HCG)激素(40 ng/mL)与CEA(40 ng/mL)做对比.图7表示加入这些干扰物之后的AuNRs长轴吸收峰强度的变化值(Sensitivity),从图中可以看出该传感器对CEA的响应明显大于其他物质,说明该传感器对CEA具有良好的选择性.
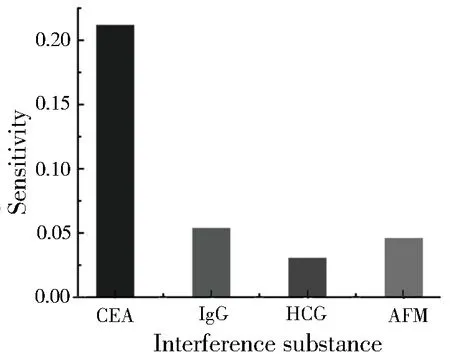
图7 免疫传感器对几种可能干扰的物质的选择性
3.6 回收率的测定
对传感器进行CEA回收率的测定,将血清样品用PBS溶液稀释,测定结果如表1所示.其平均回收率为94.55%,说明该传感器可用于实际样品中CEA的测定.
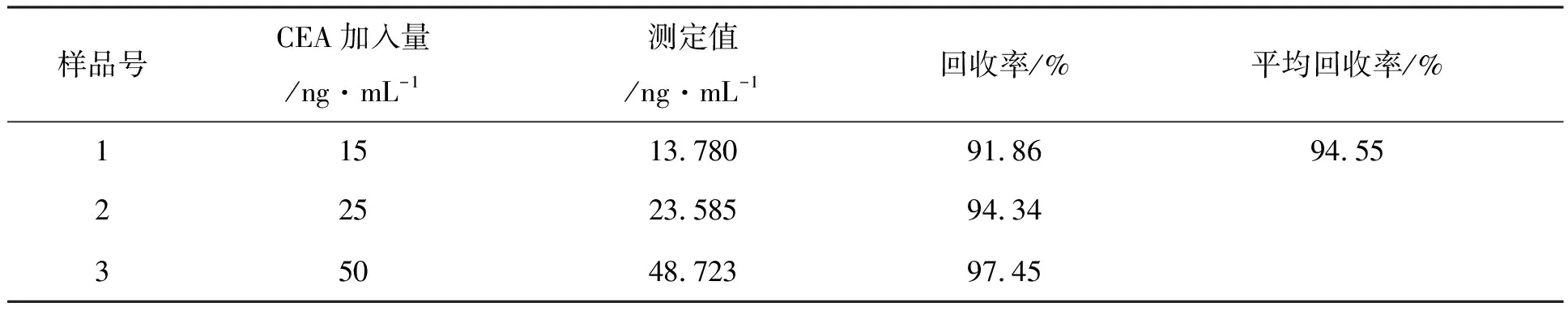
表1 CEA回收率的测定
4 结 论
利用种子介导的方法合成了AuNRs,并且利用聚电解质聚合物PSS和PAH将AuNRs表面具有生物毒性的CTAB所覆盖,使AuNRs表面成功固定了CEA抗体,研制了一种新型的基于AuNRs的免疫传感器,该传感器检测速度快,具有良好的检测范围,并且可以将该检测方法推广到其他的生物分子检测,为抗癌物质的检测提供一种较好的新方法.
参 考 文 献:
[1] WATANABE R,TAKIGUCHI Y,KURIYAMA T.Serum tumor markers for primary lung carcinoma[J].Nihon Rinsho,2000,58(5):1070-1073.
[2] 王玉金,王玉珠,杨书豪,等.胶体金免疫层析法检测血清癌胚抗原[J].标记免疫分析与临床,2003,10(3):167-170.
[3] GOULD D,MOSCOSO G,YOUNG M,et al.Human first trimester fetal ovaries express oncofetal antigens and steroid receptors[J].J Soc Gynecol Investig,2000,7(2):131-138.
[4] IWAZAWA T,KANOH T,MATSUI S,et al.Diagnosis of lung cancer metastasis with CEA extracted from the dissected regional lymph nodes[J].Lung Cancer,2000,29(1):254.
[5] SCHNEIDER J.Tumor markers in detection of lung cancer[J].Adv Clin Chem,2006,42:1-41.
[6] HALL N,FINAN P,STEPHENSON B,et al. The role of CA-242 and CEA in surveillance following curative resection for colorectal cancer [J]. Br J Cancer,1994,70(3):549-553.
[7] MEKLER V,BYSTRYAK S.Application of phenylenediamine as a fluorogenic substrate in peroxidase-mediated enzyme-linked immunosorbent assay [J]. Anal Chim Acta,1992,264(2):359-363.
[8] DELA ROSA A M,KUMAKURA M.Trapping method of antibodies on surfaces of polymerizing discs for enzyme immunoassay[J].Anal Chim Acta,1995,312(1):85-94.
[9] PINA T C,ZAPATA I T,HERNNDEZ F C,et al.Tumour markers in serum,bronchoalveolar lavage and biopsy cytosol in lung carcinoma:what environment lends the optimum diagnostic yield?[J].Clin Chim Acta,2001,305(1):27-34.
[10]XIANG Y,ZHANG Y,CHANG Y,et al.Reverse-micelle synthesis of electrochemically encoded quantum dot barcodes:application to electronic coding of a cancer marker[J].Anal Chem,2010,82(3):1138-1141.
[11]CHIKKAVEERAIAH B V,BHIRDE A A,MORGAN N Y,et al.Electrochemical immunosensors for detection of cancer protein biomarkers[J].ACS Nano,2012,6(8):6546-6561.
[12]LIAO H,WU J,KUHN E,et al.Use of mass spectrometry to identify protein biomarkers of disease severity in the synovial fluid and serum of patients with rheumatoid arthritis[J].Arthritis Rheum,2004,50(12):3792-3803.
[13]LI J,ORLANDI R,WHITE C N,et al.Independent validation of candidate breast cancer serum biomarkers identified by mass spectrometry[J].Clin Chem,2005,51(12):2229-2235.
[14]YUAN J,WANG G,MAJIMA K,et al.Synthesis of a terbium fluorescent chelate and its application to time-resolved fluoroimmunoassay[J].Anal Chem,2001,73(8):1869-1876.
[15]CHU T M,REYNOSO G.Evaluation of a new radioimmunoassay method for carcinoembryonic antigen in plasma,with use of zirconyl phosphate gel[J].Clin Chem,1972,18(9):918-922.
[16]PERGTERS J,SCHMIDE G H,PETERS B,et al.Immunoradiometric assay of carcinoembryonic antigen with use of avidin-biotin labeling[J].Clin Chem,1989,35(4):573-576.
[17]杨玉东,徐菁华,杨林梅,等.金纳米棒表面修饰技术及其功能化的研究进展[J].化工进展,2010,29(3):389-396.
[18]马占芳,田乐,邸静,等.基于金纳米棒的生物检测,细胞成像和癌症的光热治疗[J].化学进展,2009,21(1):134-142.
[19]李峰杰,郝鹏,吴一辉.金纳米棒对SPR生物传感器灵敏度的增强效应[J].传感器与微系统,2011,30(7):20-23.
[20]JIN R,CAO Y C,HAO E,et al.Controlling anisotropic nanoparticle growth through plasmon excitation[J].Nature,2003,425(6957):487-490.
[21]EUSTIS S,EL-SAYED M A.Why gold nanoparticles are more precious than pretty gold:noble metal surface plasmon resonance and its enhancement of the radiative and nonradiative properties of nanocrystals of different shapes[J].Chem Soc Rev,2006,35(3):209-217.
[22]柯善林,阚彩侠,莫博,等.金纳米棒的光学性质研究进展[J].物理化学学报,2012,28(06):1275-1290.
[23]陈强,李凯,周宇荀,等.基于金纳米棒的 DNA 杂交检测[J].传感器与微系统,2011,30(10):137-140.
[24]ALKILANY A M,NAGARIA P K,HEXEL C R,et al. Cellular uptake and cytotoxicity of gold nanorods:molecular origin of cytotoxicity and surface effects[J].Small,2009,5(6):701-708.
[25]PARAB H J,CHEN H M,LAI T-C,et al.Biosensing,cytotoxicity,and cellular uptake studies of surface-modified gold nanorods[J].J Phys Chem C,2009,113(18):7574-7578.
[26]WILSON C G,SISCO P N,GADALA-MARIA F A,et al.Polyelectrolyte-coated gold nanorods and their interactions with type I collagen[J].Biomater,2009,30(29):5639-5648.
[27]ZHANG X Y,ZHANG L D,LEI Y,et al.Fabrication and characterization of highly ordered Au nanowire arrays[J].J Mater Chem,2001,11(6):1732-1734.

