加速溶剂萃取技术提取海洋沉积物中游离态脂肪酸的方法研究
李小琳,贺行良,李 凤,张媛媛,陈立雷,张培玉
(1.青岛大学环境科学与工程学院,山东 青岛 266071;
2.国土资源部海洋油气资源和环境地质重点实验室,山东 青岛 266071;
3.中国海洋大学化学化工学院,山东 青岛 266100)
脂肪酸是沉积物中含量最丰富的脂类标记物之一,同时脂肪酸还是所有生物体的重要组分,广泛存在于海洋浮游植物(如海洋微藻和大型海草)、浮游动物、陆源高等植物以及细菌等生物中,其中海藻中的脂肪酸含量占有机质的5%~25%[1-2]。脂肪酸分子中含有羟基官能团,可以与沉积物中的大分子有机物、矿物等发生相互作用,因而沉积物中脂肪酸的存在形式主要有游离态脂肪酸和结合态脂肪酸(包括碱不稳定态脂肪酸和酸不稳定态脂肪酸)[3-10]。研究表明,不同海区的沉积物中其脂类物质的形态分布不同,Wakeham[11]发现黑海沉积物中的脂肪酸以游离态和碱不稳定态存在,其中游离态为主要存在形态。胡建芳[12]研究表明南海沉积物柱状样中的脂类物质几乎完全以游离态形式存在。而Zegouagh等[13]研究长江口2个表层沉积物中的脂肪酸,发现结合态脂肪酸含量高于游离态。
目前针对中国海域沉积物中脂肪酸等脂类物质的形态分布研究已有报道,但对于提取脂肪酸的方法探索研究较少。不同形态的脂肪酸其提取方法又有不同难点与差异:游离态脂肪酸可由溶剂直接萃取得到,结合态脂肪酸是在已提取出游离态脂肪酸的沉积物残渣中加入酸碱加热后再用溶剂提取。目前地质样品生物标志化合物分析方法中,索氏提取、超声波提取和加速溶剂萃取(ASE)是使用广泛的脂类化合物提取方法[14-17]。索氏提取是一种经典高效的提取方法。Wakeham[11]提取黑海沉积物中的脂肪酸、胡建芳[12]提取南海沉积物中的脂肪酸以及Zegouagh等[13]对长江口表层沉积物中脂肪酸的提取,均采用索氏提取法。但该法耗时长、样品需求量较大、溶剂使用量大,一些高沸点溶剂以及受热易分解或变色的物质不宜采用此方法[16]。超声波提取法操作相对简单,设备较便宜,但残渣与抽提物的分离操作需消耗大量溶剂、消耗时间长,尤其对于有机质含量低的地质样品难以操作[17]。ASE是在较高的温度和压力下用有机溶剂萃取固体或半固体的自动化方法,具有省时省溶剂、成本低和操作毒性小等优点,且萃取效率不低于经典的索氏提取[18],此法在脂类生物标志化合物研究中已经得到了较广泛的应用。Andersson等[19]利用ASE法采用两次加热两次循环的循环过程,同时提取样品中正构烷烃、芳烃、脂肪醇、脂肪酸以及磷脂等多种脂类生物标志物,并应用于东欧俄罗斯北极地区全新世泥炭序列的研究,极大地提高了工作效率。但ASE技术以海洋沉积物作为研究对象的方法研究报道较少。
本文采集东海近海海域沉积物作为研究样本,由于样品中游离态脂肪酸含量丰富,而结合态脂肪酸由于含量过低,测定结果精密度差[10,20],难以作为方法研究对象,因此本文针对游离态脂肪酸应用ASE法进行提取,并对ASE萃取剂的选择、萃取温度、静态萃取时间和循环次数等实验条件进行了优化,以期建立一种简单、快速地提取海洋沉积物样品中游离态脂肪酸的方法。这对于今后进一步研究沉积物中脂肪酸的迁移、转化和降解,乃至脂肪酸对环境变化指示作用的应用等均有重要意义。
1 实验部分
1.1 仪器及工作条件
ASE200型加速溶剂萃取仪(美国Dionex公司);7890A-5975C型气相色谱-质谱联用仪(GC-MS,美国Aglient公司);KL512/509J型恒温水浴氮吹仪(北京康林公司)。
气相色谱条件:HP-5石英毛细管柱(50 m×0.25 mm×0.25 μm);进样口温度300℃;升温程序:60℃保持1 min,然后5 ℃/min升温至310℃并保持14 min;载气为高纯氦气(99.999%),柱流速1.5 mL/min,进样量1 μL,不分流进样。
质谱条件:电子轰击(EI)离子源,电子能量70 eV;传输线温度280℃;离子源温度230℃;四极杆温度150℃;溶剂延迟6 min;全扫描模式[21]。
1.2 主要试剂
硅胶填料(SiO2,0.147~0.175 mm,美国Supelco公司);1-十九酸(C19H38O2,上海Sigma-Aldrich贸易有限公司);衍生化试剂BF3-MeOH(上海安谱科学仪器有限公司);二氯甲烷、甲醇、氯仿、正己烷(HPLC级,德国Merck公司)。
1.3 样品采集与保存
本研究取得沉积物样品是位于闽浙沿岸泥质区的褐色黏土。取样器为多管式重力采样器。样品采集后,现场按密集型 1 cm间距分割成子样,放入已于450℃灼烧过的铝箔中包裹封装,冷冻保存(-20℃)至分析。
1.4 分析方法
将海洋沉积物样品冷冻干燥、磨碎、过筛,称量适量处理好的样品并加入替代物1-十九酸。设定萃取溶剂为甲醇-二氯甲烷(V/V,1∶3),静态萃取时间5 min,萃取温度110℃,循环2次等条件进行ASE萃取,得到总可萃取有机质。萃取液加入铜片过夜脱硫。高纯氮气(99.99%)吹干后加入6%氢氧化钾-甲醇溶液于80℃加热水解2 h,再以正己烷萃取分液,得到上层清液为中性-非极性组分,向萃取剩余液中加入盐酸使其pH<2。正己烷萃取分液,得到上层清液为酸性-极性组分。氮气吹干加入衍生化试剂BF3-MeOH溶液于90℃下进行2 h衍生化反应。取出后于干燥器内降至室温,正己烷萃取分液,得到上层清液,氮吹浓缩转移到样品瓶中,用正己烷润洗吹干定容,上机分析。
1.5 定性分析和定量分析
为了方便讨论,现将脂肪酸(游离态脂肪酸,下文统一简称脂肪酸)分成如下5类[22-24]。
LSFA(长链饱和脂肪酸):碳数大于 20的偶数碳正构饱和脂肪酸。
MSFA(中等链长饱和脂肪酸):碳数不大于 20的偶数碳正构饱和脂肪酸。
MUFA(单不饱和脂肪酸):含有一个不饱和双键的脂肪酸。
BRFA(支链脂肪酸):带有支链的脂肪酸。
OFA(奇数碳脂肪酸):碳链长度为奇数的正构饱和脂肪酸。
脂肪酸的含量= 1-十九酸含量×脂肪酸的峰面积/1-十九酸的峰面积。
单体化合物的定性分析可根据保留时间、色谱图与本仪器数据系统内NIST08谱库中的谱图进行自动检索确定。
2 结果与讨论
2.1 萃取条件优化
为优化ASE法的实验条件,分别改变萃取条件:萃取溶剂为甲醇-二氯甲烷(,1∶3)、甲醇-二氯甲烷(1∶9)和氯仿,静态萃取时间为5、10和15 min,萃取温度为70℃、110℃和150℃,循环次数是1、2和3次。不同条件下的样品做3次重复性实验。最终以脂肪酸的提取效率为依据,选择ASE法的最佳实验条件。
2.1.1萃取溶剂
固定静态萃取时间5 min,循环2次,萃取温度110℃,利用3种不同极性的萃取剂:甲醇-二氯甲烷(1∶3)、甲醇-二氯甲烷(1∶9)和氯仿,提取海洋沉积物中脂肪酸,经3次重复性试验,ASE提取脂肪酸总量的精密度分别为10%、13%和5%。取3次实验平均值,ASE提取脂肪酸总量分别为24.68、19.21、16.71 μg/g。如图1所示,甲醇-二氯甲烷(1∶3)、甲醇-二氯甲烷(1∶9)、氯仿作为萃取剂提取的各脂肪酸的总量、不同类别的脂肪酸的含量以及单体脂肪酸的含量均依次递减;相对于含量较低的脂肪酸类别,含量最高的MSFA(特别是C14、C16和C18的单体脂肪酸)的规律最为明显;甲醇-二氯甲烷作为萃取剂的提取效率相对于氯仿更为明显。对比不同体积比的甲醇-二氯甲烷萃取剂,甲醇-二氯甲烷(1∶3)的提取效率高于甲醇-二氯甲烷(1∶9),这可能是由于甲醇的极性更大,与脂肪酸的极性接近,基于相似相容原理使脂肪酸更容易在甲醇溶液中被提取出来。因此,本文选择具有优势的甲醇-二氯甲烷溶剂(1∶3)对ASE萃取条件进行优化。
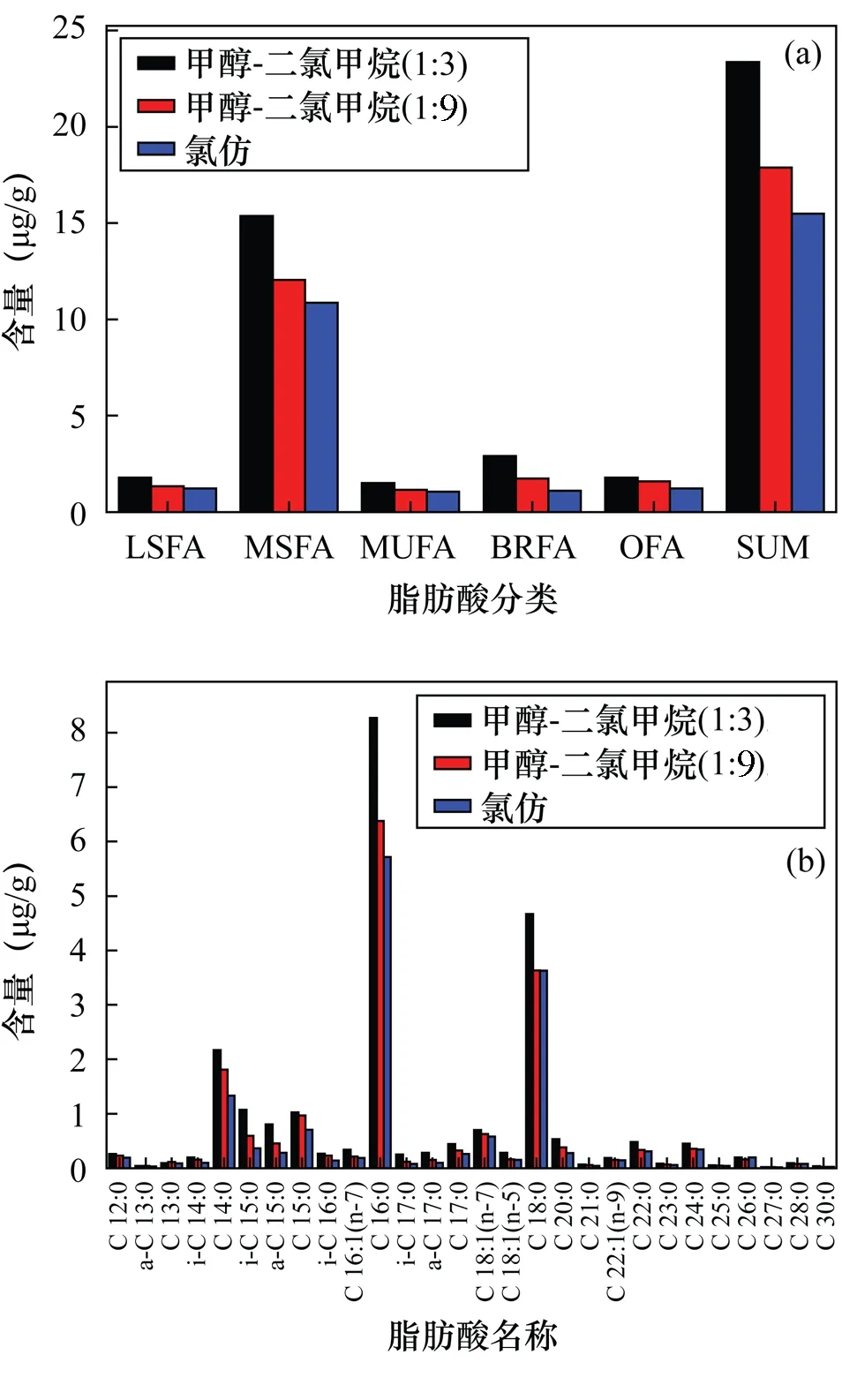
图1 不同溶剂对脂肪酸提取效率的影响
2.1.2萃取温度
以甲醇-二氯甲烷(1∶3)为萃取溶剂,固定静态萃取时间5 min,循环2次,改变萃取温度(70℃、110℃、150℃),研究不同温度下脂肪酸提取效率,经3次重复性试验,ASE提取脂肪酸总量的精密度分别为3%、11%和8%。取3次实验平均值,ASE提取脂肪酸的总量分别是20.89、21.73、21.23 μg/g。如图2所示,不同类别脂肪酸的提取量对于温度条件所呈现的规律有所不同:MUFA以及BRFA的提取量随着温度的增加逐渐提高;LSFA、MSFA以及OFA的提取量在110℃条件下最高,而在70℃和150℃条件下其提取量差距较小且在误差范围内;单体脂肪酸与其对应的脂肪酸类型所呈现的规律相同。ASE提取不同类型的脂肪酸其所需的最适温度不同,由于MUFA的双键以及BRFA中的支链增强了脂肪酸的极性,减弱其稳定性,而LSFA、MSFA以及OFA作为饱和脂肪酸结构稳定,极性差距造成了其最适温度的变化[18]。根据样品中脂肪酸的种类及含量不同,可以选择不同的反应温度,本文作为脂肪酸的方法研究,选择涵盖脂肪酸种类更多的最适温度为110℃。
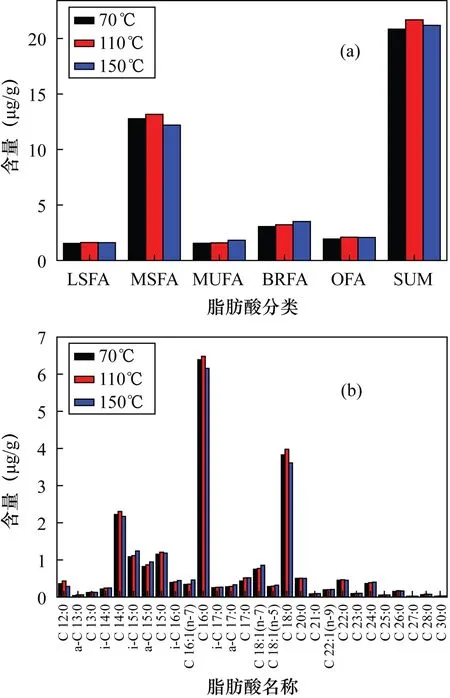
图2 不同萃取温度对脂肪酸提取效率的影响
2.1.3静态萃取时间

图3 不同静态萃取时间对脂肪酸提取效率的影响
以甲醇-二氯甲烷(1∶3)为萃取溶剂,固定萃取温度110℃,循环2次,改变静态萃取时间(5、10、15 min),研究不同静态萃取时间下脂肪酸提取量的变化,经过3次重复性试验,ASE提取脂肪酸总量的精密度分别为10%、4%和14%。取3次实验平均值,ASE提取脂肪酸的总量分别是21.83、24.23、23.56 μg/g。从图3可以看出,不同静态萃取时间条件下,不同类别脂肪酸的提取量所呈现的规律有所不同:MUFA以及BRFA的提取量随着萃取时间的增加逐渐降低,这可能是由于MUFA的双键以及BRFA中的支链影响,萃取时间加长反而不容易保持其稳定性致使萃取效率降低;LSFA以及OFA的提取量在10 min条件下最高,而在5 min和15 min条件下其提取量差距较小且在误差范围内;脂肪酸含量最高的MSFA,其最适静态萃取时间为15 min,由于其含量相对较高,长时间静态萃取有利于提取更多样品中的脂肪酸。各单体脂肪酸与其对应的脂肪酸类型所呈现的规律相同,根据样品中脂肪酸的种类含量,可以选择不同的静态萃取时间,本文作为脂肪酸的方法研究,综合考虑时间因素,选择最适条件需涵盖更多种类的脂肪酸,最终选择10 min。
2.1.4循环次数
以甲醇-二氯甲烷(1∶3)为萃取溶剂,固定萃取温度110℃,静态萃取时间5 min,改变循环次数(1、2、3次),研究不同循环次数下脂肪酸提取效率的变化,经过3次重复性试验,ASE提取脂肪酸总量的精密度分别为2%、11%和0.4%。取3次实验平均值,ASE提取脂肪酸的总量分别是22.60、23.45、24.77 μg/g。如图4所示,随着循环次数的增加,脂肪酸的提取量逐级增加,循环3次时对于脂肪酸的提取量略高于其他条件的提取量。可见,多次循环有利于提高脂肪酸的萃取效率,本文作为方法研究,选择最优条件循环3次。
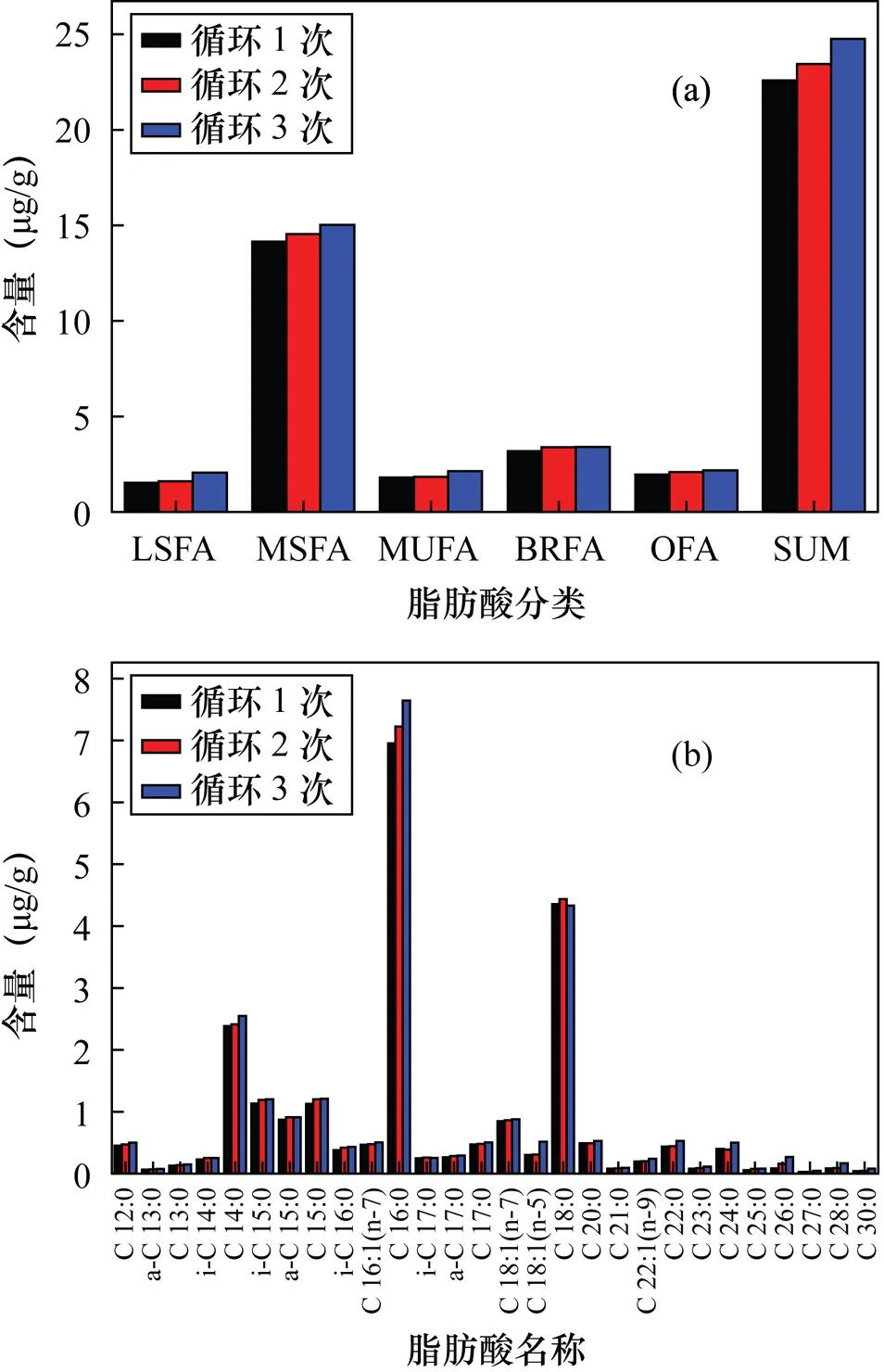
图4 不同循环次数对脂肪酸提取效率的影响
2.2 方法精密度与回收率
利用ASE提取游离态脂肪酸所选择的优化条件:萃取溶剂甲醇-二氯甲烷(1∶3),萃取温度110℃,静态萃取时间10 min,循环3次。在选定的优化条件下重复操作5次,表1分析结果表明,大部分脂肪酸的方法精密度(RSD)为3.3%~19.0%,而C28和C30的脂肪酸可能因为含量低致使精密度偏大,C12和C13的脂肪酸可能由于碳链短,实验过程中易挥发损失造成精密度略大。替代物在样品预处理前定量加入样品中,随样品经过预处理和仪器分析的全过程。由于替代物不存在于样品中,可以认为替代物的损失或沾污的程度,即回收率,能够准确测量[25]。以1-十九酸作为样品替代物,得到替代物回收率为72.2%~104.6%。
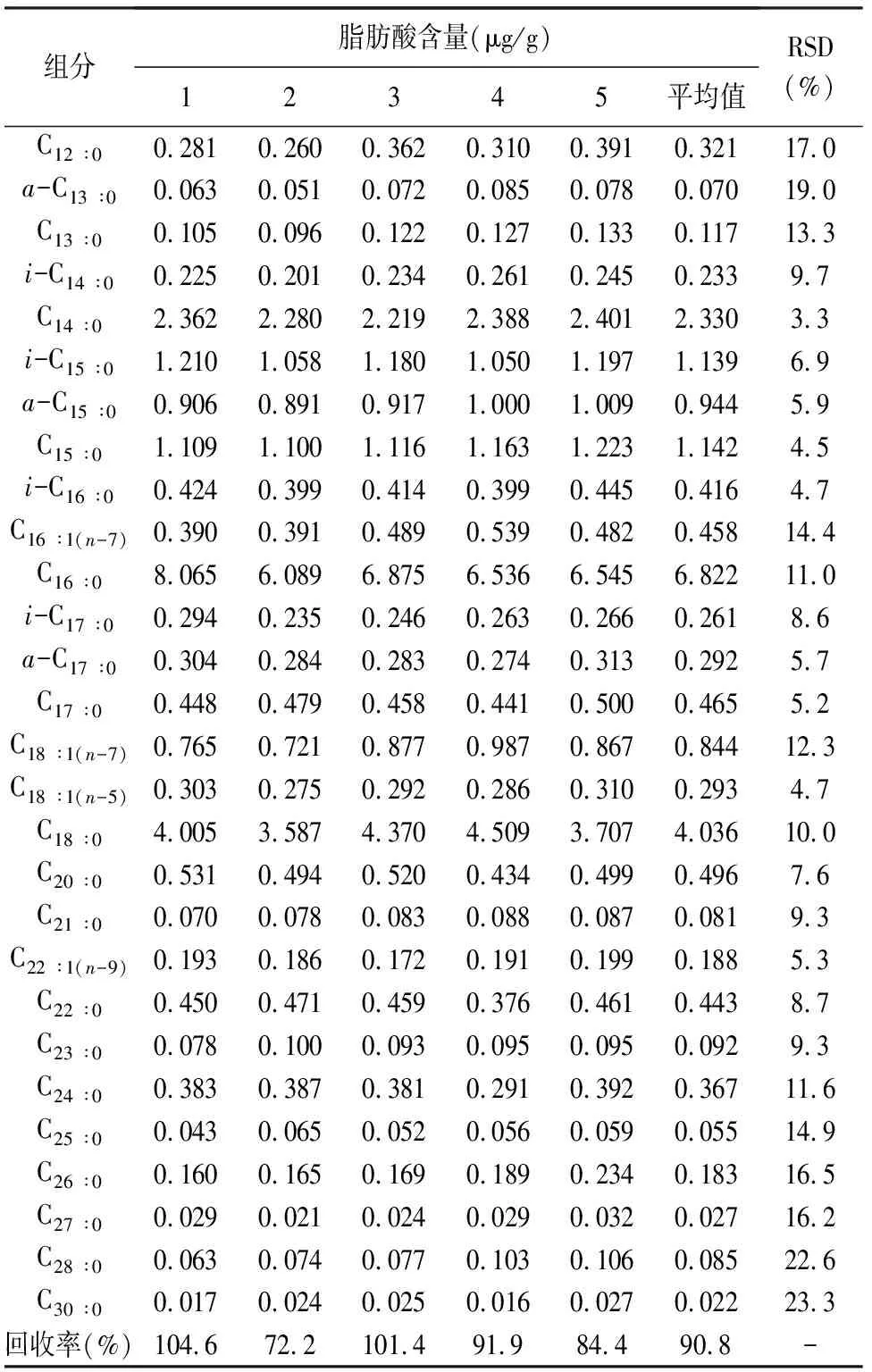
表1 方法精密度
3 实际样品分析
采集东海海域及黄海近海海域中不同位置的海洋沉积物样品各3个,其中东海海域的褐色黏土样品中脂肪酸含量相对高于黄海海域,而且不同海域中的脂类物质均以游离态脂肪酸为主。6个不同样品中均含有饱和脂肪酸、支链脂肪酸和单不饱和脂肪酸,种类较复杂,符合实际样品分析条件。
按上述实验方法的最佳方案提取、分析海洋沉积物中的脂肪酸,测定结果见表2,ASE法可作为海洋沉积物中脂肪酸的分析方法。由不同海域、不同位置的沉积物样品中脂肪酸的含量分布情况可见,实际样品中检测到的脂肪酸,包含了C12~C30的所有饱和脂肪酸、C13~C17的部分支链脂肪酸以及常见C16∶1(n-7)、C18∶1(n-7)、C18∶1(n-5)、C22∶1(n-9)等不饱和脂肪酸。
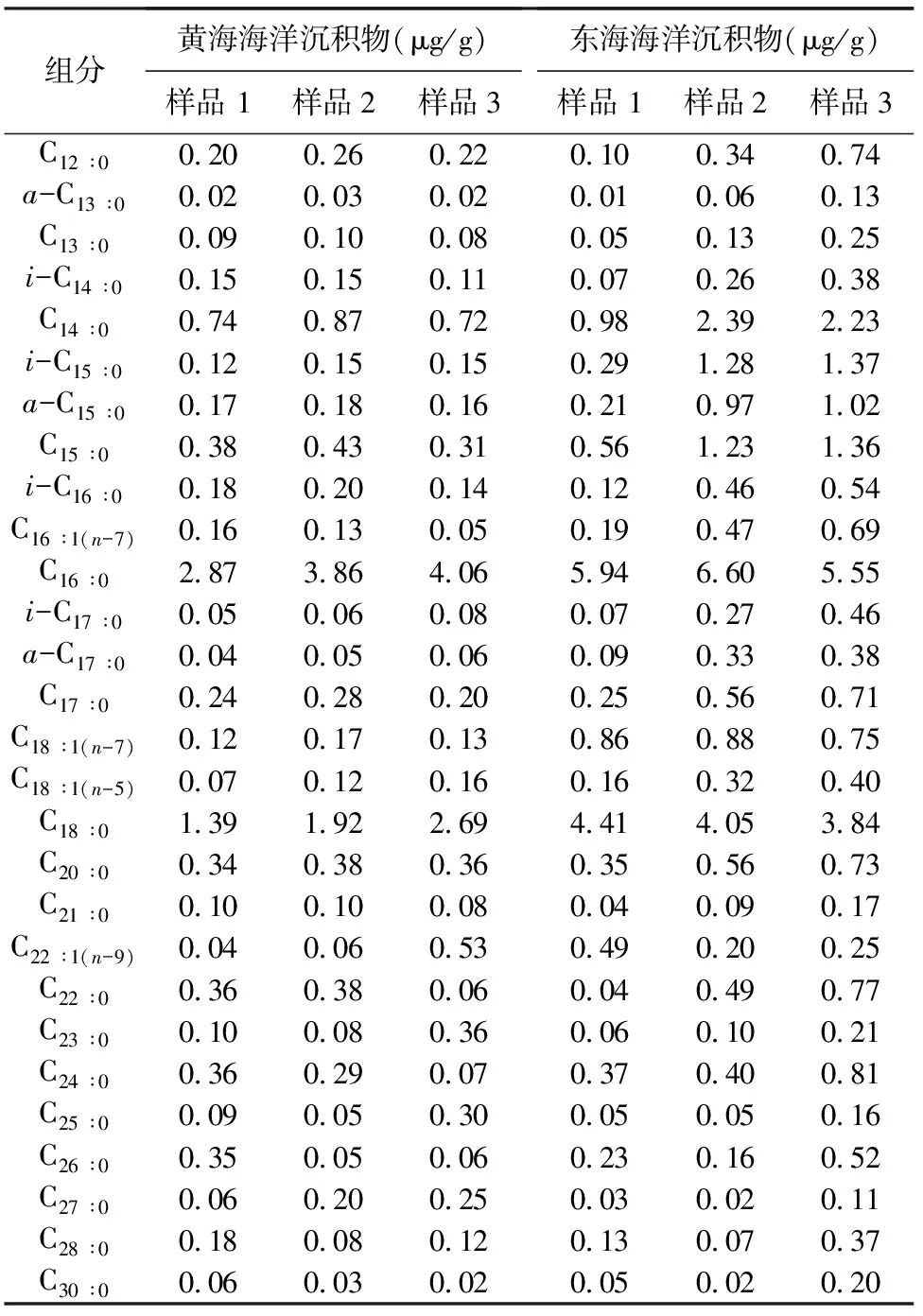
表2 实际样品中脂肪酸的分析
4 结语
通过选择萃取剂,优化萃取温度、静态萃取时间、循环次数等参数,建立了ASE快速提取海洋沉积物中游离态脂肪酸的方法。对于萃取温度及静态萃取时间两个条件,不同类型的脂肪酸所呈现的规律性有所差异,该方法以提取脂肪酸含量最大化(提取效率最高)为依据,优化了最佳实验条件。大部分游离态脂肪酸的方法精密度为3.3%~19.0%,替代物回收率为72.2%~104.6%。实际样品分析结果显示,本文针对游离态脂肪酸选择ASE进行萃取,对比文献[10-13]中传统的索氏提取法,该方法流程简单,极大地提高了工作效率,同时具备精密度良好等特点,适用于海洋沉积物样品中游离态脂肪酸的定量分析。
应用ASE测定海洋沉积物中的游离态脂肪酸,由于脂肪酸的种类繁多,结构复杂,对含不同种类脂肪酸的样品要分别改变实验条件,以减少测定误差。各种脂肪酸的结构、含量、稳定性千差万别,难以用一种方法涵盖所有类型的脂肪酸,此方法主要是针对游离态脂肪酸萃取条件的优化,而结合态脂肪酸由于含量较低难以提取等因素未作研究,该方法精确度还有待提高以备将来测定含量偏低的结合态脂肪酸。
5 参考文献
[1] 刘亚娟.东海赤潮高发区沉积物中脂类生物标记物的分布和指示意义[D].青岛:中国海洋大学,2012.
[2] Woulds C,Middelburg J J,Cowie G L.Alteration of org-anic matter during infaunal polychaete gut passage and links to sediment organic geochemistry. Part Ⅰ: Amino acids[J].GeochimicaetCosmochimicaActa,2012,77:396-414.
[3] Campos G M,Rabl C,Havel P J,Rao M,Schwarz J M,Schambelan M,Mulligan K.Changes in post-prandial glucose and pancreatic hormones,and steady-state insulin and free fatty acids after gastric bypass surgery[J].SurgeryforObesityandRelatedDiseases,2014,10(1): 1-8.
[4] Bush N C,Triay J M,Gathaiya N W,Hames K C,Jensen M D.Contribution of very low-density lipoprotein triglyceride fatty acids to postabsorptive free fatty acid flux in obese humans[J].Metabolism,2014,63(1):137-140.
[5] 孟凡冰,李云成,钟耕.灵芝孢子油的提取及脂肪酸检测[J].食品科学,2013,34(2):42-45.
[6] Peng Q,Wang X,Shang M,Huang J,Guan G,Li Y,Shi B.Isolation of a novel alkaline-stable lipase from a metagenomic library and its specific application for milkfat flavor production[J].MicrobialCellFactories,2014,13(1):1.
[7] Brash A R,Boeglin W E,Stec D F,Voehler M,Schneider C,Cha J K.Isolation and characterization of two geometric allene oxide isomers synthesized from 9S-hydroperoxylinoleic acid by cytochrome[J].JournalofBiologicalChemistry,2013,288(29):20797-20806.
[8] Jadoon A,Chiu C C,McDermott L,Cunningham P,Frangou S,Chang C J,Stewart R. Associations of polyunsaturated fatty acids with residual depression or anxiety in older people with major depression[J].JournalofAffectiveDisorders,2012,136(3):918-925.
[9] Morris B E,Herbst F A,Bastida F,Seifert J,von Bergen M,Richnow H H,Suflita J M.Microbial interactions during residual oil andn-fatty acid metabolism by a methanogenic consortium[J].EnvironmentalMicrobiologyReports,2012,4(3):297-306.
[10] 杨庶,王江涛.山东半岛南部近海表层沉积物中脂类生物标志物的组成及形态分析[J].海洋环境科学,2012,31(1):11-15.
[11] Wakeham S G.Monocarboxylic,dicarboxylic and hydr-oxyl acids released by sequential treatments of suspended particles and sediments of the Black Sea[J].OrganicGeochemistry,1999,30:1059-1074.
[12] 胡建芳.3万年来南沙海区古气候、古环境演变:分析有机地球化学研究[D].广州:中国科学院广州地球化学研究所,2001.
[13] Zegouagh Y,Drerenne S,Largeau C,Saliot A.A geochemical investigation of carboxylic acids released via sepuential treatments of two surficial sediments from the Changjing delta and East China Sea[J].OrganicGeochemistry,2000,31:375-388.
[14] Zhang H C,Yang M S,Zhang W X,Chang F,Pu Y,Fan H.Molecular fossil and paleovegetation records of paleosol S4 and adjacent loess layers in the luochuan loess section,NW China[J].ScienceinChina:SeriesD,2008,51(3):321-330.
[15] Kornilova O,Rosell-Mel A.Application of microwave-assisted extraction to the analysis of biomarker climate proxies in marine sediments [J].OrganicGeochemistry,2003,34(11):1517-1523.
[16] 魏彩云,王汇彤,王慧,孟建华.快速溶剂抽提仪萃取岩石中氯仿沥青“A”方法探索[J].现代科学仪器,2009(2):96-98.
[17] 任松,陈卫卫,建平,张丽旭.超声波提取在近海沉积物油类测定中的应用[J].海洋环境科学,2005,24(1):35-37.
[18] 石丽明,刘美美,王晓华,孙青,储国强.加速溶剂萃取提取土壤中正构烷烃的方法研究[J].岩矿测试,2010,29(2):104-108.
[19] Andersson R A,Meyers P A.Effect of climate change on delivery and degradation of lipid biomarkers in a Holocene peat sequence in the Eastern European Russian Arctic[J].OrganicGeochemistry,2012,53:63-72.
[20] 王萍,张银波,江木兰.多不饱和脂肪酸的研究进展[J].中国油脂,2008,33(12):42-46.
[21] 李凤,张媛媛,贺行良,王江涛.硅胶-氰丙基复合固相萃取柱分离原油中饱和烃及芳烃组分[J].分析测试学报,2013,32(7):796-802.
[22] Budge S M,Parrish C C,McKenzie C H.Fatty acid composition of phytoplankton,settling particulate matter and sediments at a sheltered bivalve aquaculture site[J].MarineChemistry,2001,76:285-303.
[23] Shi W,Sun M Y,Molina M,Hodson R E.Variability in the distribution of lipid biomarkers and their molecular isotopic composition in Altamaha estuarine sediments: Implications for the relative contribution of organic matter from various sources[J].OrganicGeochemistry,2001,32:453-467.
[24] Do K R,Jeun J A,Houng S J,Jun H J,Lee J H,Jia Y Y,Lee S J.Soybean(GlycinemaxL.Merr.) hexane extracts inhibit cellular fatty acid uptake by reducing the expression of fatty acid transporters[J].FoodScienceandBiotechnology,2011,20(4):1171.
[25] 李权龙,袁东星.替代物和内标物在环境样品分析中的作用及应用[J].海洋环境科学,2002,21(4):46-49.

