苹果酸催化大豆异黄酮糖苷水解苷元的工艺研究
于丽颖,成乐琴
(吉林化工学院化学与制药工程学院,吉林吉林 132022)
大豆异黄酮的健康功效多种多样,可以预防多种疾病和改善骨健康状况[1]。大豆中天然存在的异黄酮包括大豆异黄酮糖苷和大豆异黄酮苷元两类,其中,大豆异黄酮糖苷占到了总异黄酮含量的80%~95%以上,糖苷型大豆异黄酮由于分子较大,食用后不能被人体直接吸收,一般是在体内消化酶作用下转化为苷元被人体吸收,但目前保健品大豆异黄酮各种类型主要成分是糖苷,资料显示[2-4],体内消化酶一般水解率在20%~40%,产品功效较低。另外,每个人肠道消化酶不太一样,也就是说,因人而异,即使食用同样的大豆异黄酮,效果相差也会很大。因此体外水解工艺开发就具有实际意义。目前,大豆异黄酮糖苷转化苷元的方法[5-9]最常用的是酸催化法、碱催化法、酶催化法。酸水解通常用盐酸、硫酸作催化剂,强酸条件下水解同时对大豆异黄酮苷元的稳定性有所影响。碱催化产物苷元容易降解,应用受到很大限制。酶水解法具有水解条件温和、产物稳定性好、纯度高等特点,但酶生产成本很高,而且酶不容易重复利用,需要进一步研究低成本的酶固化技术。用苹果酸做催化剂来催化大豆异黄酮糖苷的水解,避免目前工业上的水解方法对设备的腐蚀,水解产物无需分离直接用于功能性食品,弥补了现有大豆异黄酮转化苷元工艺中选用盐酸催化、碱催化和酶催化等技术缺陷,因此是一条应用价值较高的工艺路线。
1 材料与方法
1.1 材料与仪器
大豆异黄酮糖苷标样 大豆苷,黄豆黄苷、染料木苷,大豆苷元,黄豆黄素,染料木素,含量超过98%,购天津马克生物有限公司;糖苷型大豆异黄酮提取物 含量为91.3%,购西安金绿生物工程公司。
高效液相色谱仪 大连依利特分析仪器有限公司;分析天平 北京医用天平厂;CS101-3型电热鼓风干燥箱 重庆实验设备厂;KQ-250VDE型双频数控超声清洗器 昆山市超声仪器有限公司。
1.2 实验方法
称取大豆异黄酮糖苷50mg置于50mL圆底烧瓶中,加入一定浓度苹果酸水溶液10mL,超声水浴1h,超声频率45kHz,水浴温度75℃。反应液转移到高压釜中,反应温度为110~130℃,反应时间为0.5~2h,反应结束后,冷却反应液到室温。将冷却后具有部分析出的反应液用5mL甲醇全部溶解后,取一定量反应液用甲醇稀释到100μg/mL,过0.45μm滤膜后上机测其糖苷的含量,通过单因素和正交实验确定最佳水解条件。
1.3 糖苷及其苷元含量的测定
色谱条件:色谱柱:Shimadzu VP-ODS C18柱,150mm×4.6mm,5μm;流动相A:0.4%磷酸水溶液;流动相B:甲醇;梯度洗脱程序:0~10min,30%~35%B;10~20min,35%~40%B;20~30min,40%~55%B;30~40min,55%~65%B。流速:1mL/min;检测波长为:260nm,测定温度为30℃;进样量:20μL。
根据糖苷和苷元化学性质的不同,从色谱柱中流出的先后顺序不同,经紫外检测器测定,通过与标准品比较,以保留时间定性、峰面积定量、外标法计算。
大豆异黄酮糖苷水解率(%)=水解前后大豆异黄酮糖苷含量之差/水解前大豆异黄酮糖苷含量×100
1.4 单因素实验设计
1.4.1 水解温度的选择 实验分别选择110、115、120、125、130℃为水解温度,在苹果酸溶液浓度为2.0mol/L,水解时间2.5h的条件下水解,按照1.2的步骤操作,计算大豆异黄酮糖苷水解率。
1.4.2 苹果酸水溶液浓度的选择 实验分别选择0.5、1.0、1.5、2.0、2.5、3.0mol/L的苹果酸水溶液为催化剂,水解温度125℃,水解时间2.5h的条件下水解,按照1.2的步骤操作,计算大豆异黄酮糖苷水解率。
1.4.3 水解时间的选择 实验分别选择0.5、1.0、1.5、2.0、2.5、3.0、3.5h为水解时间,在苹果酸水溶液浓度为2.0mol/L,水解温度125℃的条件下水解,按照1.2的步骤操作,计算大豆异黄酮糖苷水解率。
1.5 正交实验设计
在单因素实验的基础上,采用正交实验方法,优化大豆异黄酮糖苷水解苷元的工艺。以水解率为考察指标,选择反应温度(120、125、130℃)、反应时间(2.0、2.5、3.0h)、苹果酸浓度(1.5、2.0、2.5mol/L)作为考察因素,按三因素三水平进行正交实验设计L9(43),见表1。
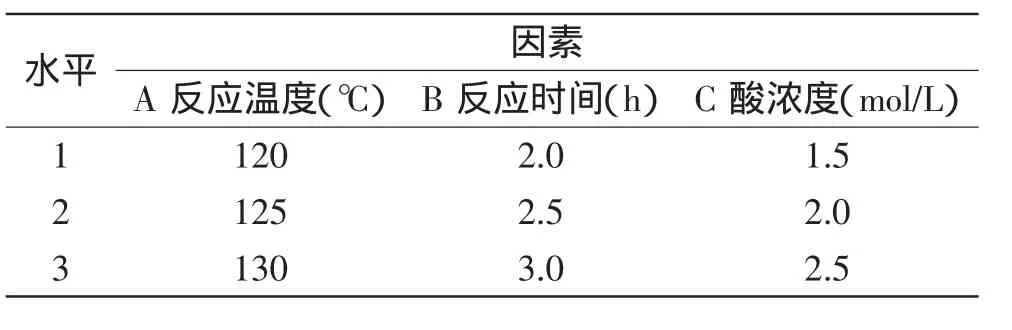
表1 正交实验因素水平表Table 1 The factor level table of orthogonal experiment
2 结果与分析
2.1 单因素实验
2.1.1 不同反应温度对大豆异黄酮水解率的影响实验结果如图1所示。
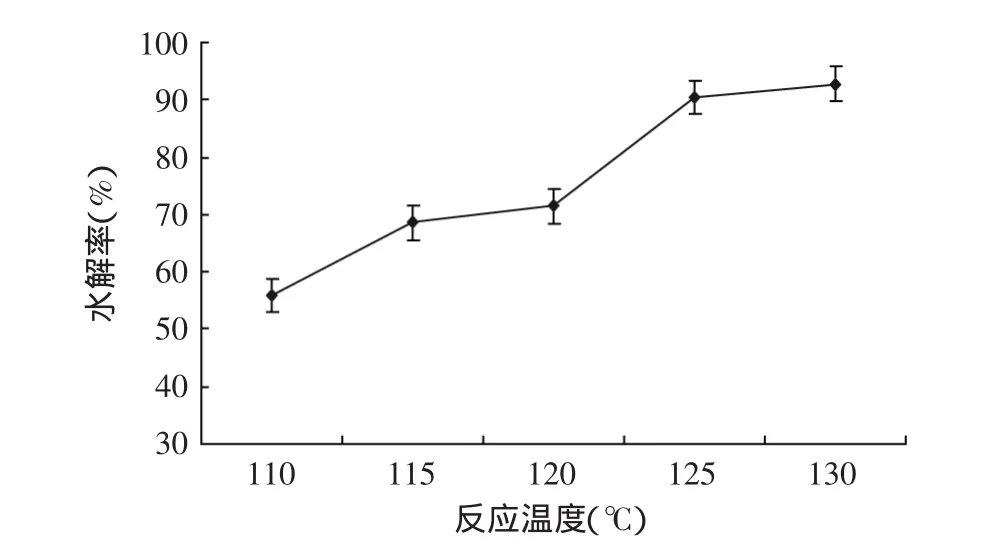
图1 不同反应温度对水解率的影响Fig.1 Effect of different reaction temperature on hydrolysis rate
实验结果表明,随着温度增加,水解率逐渐增加。当反应温度为125℃,水解率达到90.4%,一般大豆异黄酮糖苷在人体消化酶作用下,水解率为20%左右,大豆异黄酮糖苷水解率达到90%更具有实际意义。因此,在单因素水解反应实验中,适宜温度为125℃。为了进一步考察反应温度对大豆异黄酮糖苷水解率的影响,选择反应温度分别为120、125、130℃进行正交实验。
2.1.2 不同苹果酸水溶液浓度对大豆异黄酮糖苷水解率的影响 实验结果如图2所示。
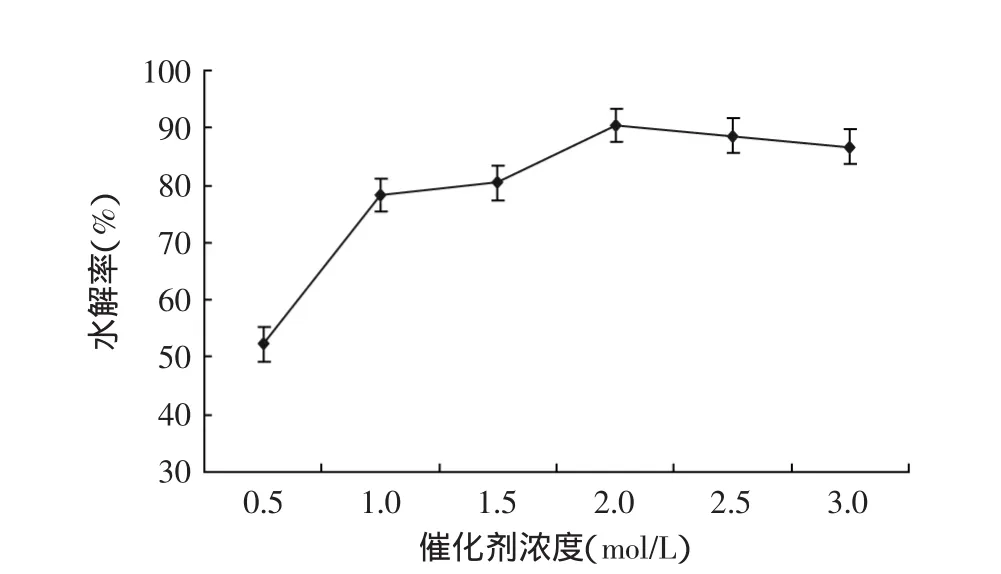
图2 不同催化剂苹果酸水溶液浓度对水解率的影响Fig.2 Effect of different concentrations of catalyst malic acid on hydrolysis rate
实验结果表明,随催化剂苹果酸水溶液浓度的增加,水解率逐渐增加,然后降低;当苹果酸浓度为2.0mol/L时,水解率为90.4%,再增加酸浓度,水解率有所降低,可能的原因,苹果酸为有机弱酸,适宜的浓度酸性较强,浓度过大会抑制其电离,从而减弱酸性,所以适宜的苹果酸浓度为2.0mol/L。为了进一步考察催化剂浓度对大豆异黄酮糖苷水解率的影响,选择苹果酸浓度分别为1.5、2.0、2.5mol/L进行正交实验。
2.1.3 不同反应时间对大豆异黄酮糖苷水解率的影响 实验结果如图3所示。
实验结果表明,随反应时间增加,水解率也逐渐增加;当反应时间为2.5h,水解率达到90.4%,延长时间,水解率变化不大。为了进一步考察反应时间对大豆异黄酮糖苷水解率的影响,选择反应时间时间分别为2.0、2.5、3.0h进行正交实验。
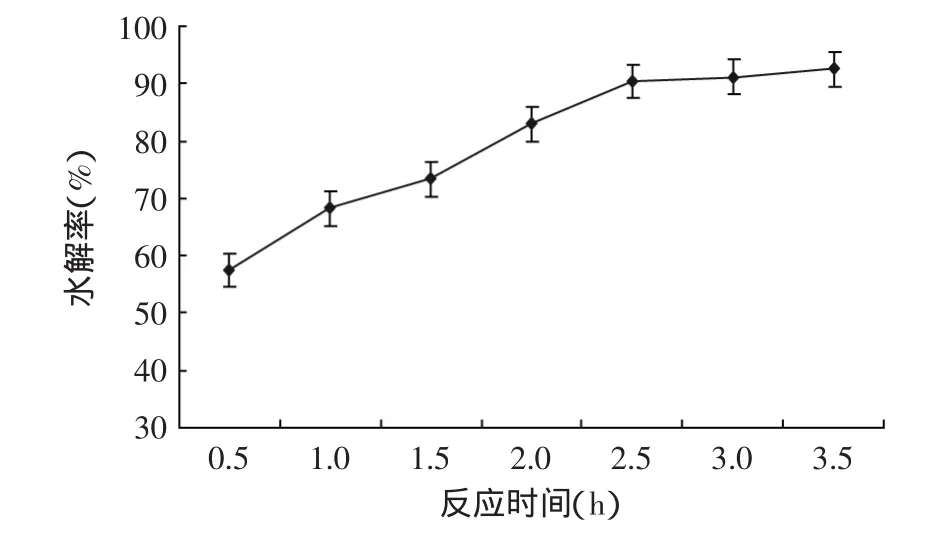
图3 不同反应时间对水解率的影响Fig.3 Effect of different reaction time on hydrolysis rate
2.2 正交实验确立优化实验条件
2.2.1 正交实验结果 按正交实验表进行实验,结果见表2。
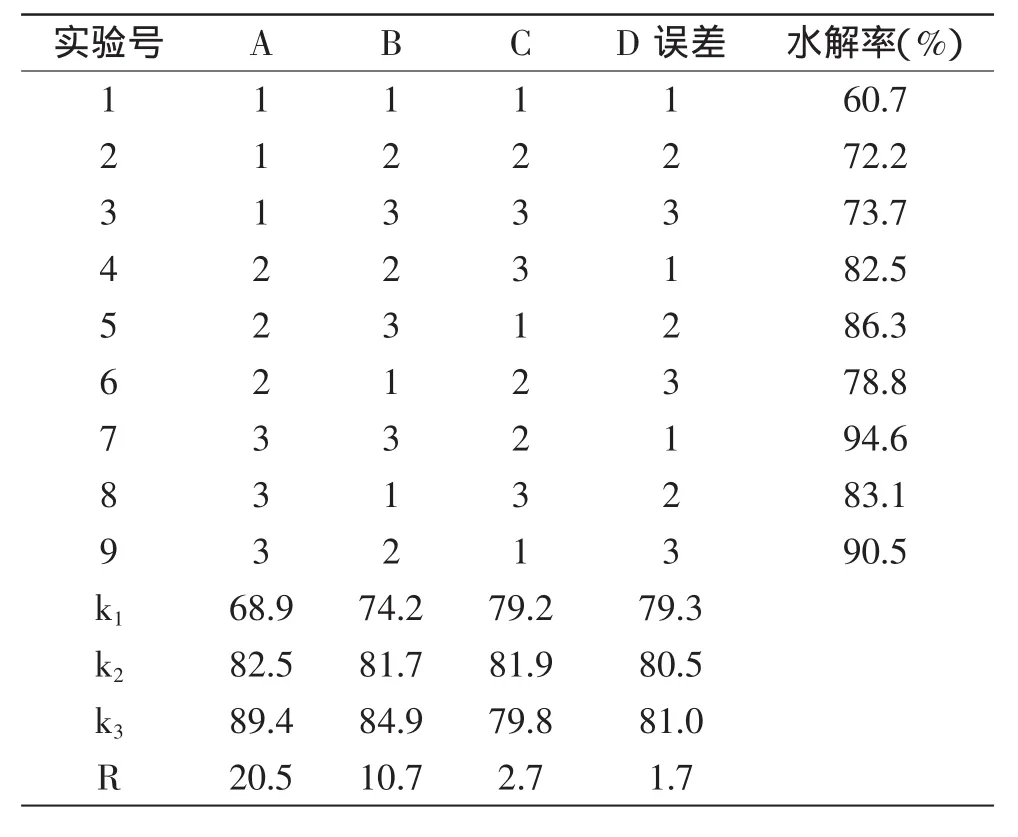
表2 正交实验结果分析表Table 2 The result analysis of orthogonal experiment
根据表2实验结果,进行方差分析见表3[10]。
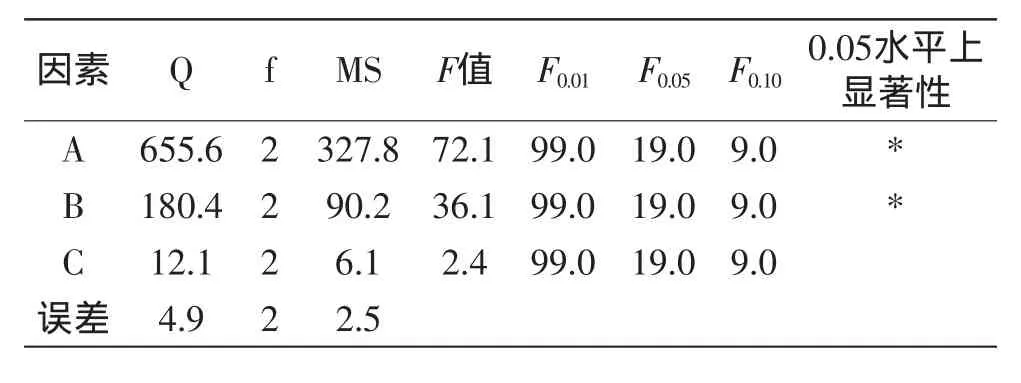
表3 苹果酸水解正交实验方差分析表Table 3 The variance analysis of orthogonal experiment in the malic acid hydrolysis
从表2的极差分析结果可知,三因素对水解率的影响程度依次为A>B>C,三因素的最佳水平组合为A3B3C2,即苹果酸催化大豆异黄酮糖苷水解苷元的最佳工艺条件为:反应温度130℃,反应时间为3.0h,苹果酸水溶液浓度为2.0mol/L,水解率达到94.0%以上。表3的方差分析结果表明,水解温度和水解时间对大豆异黄酮糖苷的水解效果具有显著影响。
2.2.2 最佳工艺验证实验 为了考察上述优选工艺的稳定性,按该工艺条件重复提取3次,测得大豆异黄酮糖苷的水解率分别为94.8%、95.1%、94.2%,平均为94.7%,表明本实验优选的工艺稳定可靠。
大豆异黄酮标准品、原料及水解后样品的液相色谱分析图见图4。
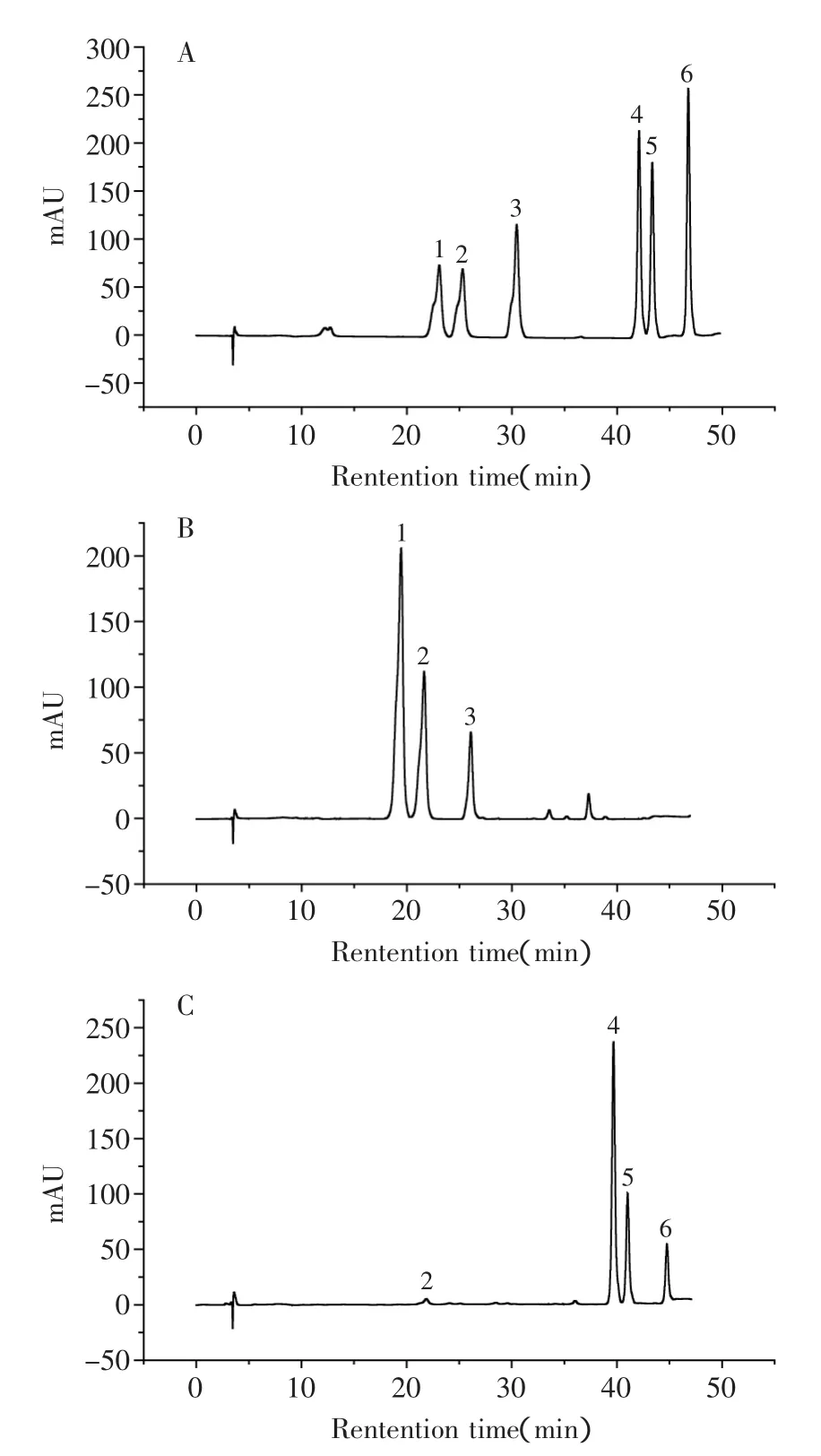
图4 大豆异黄酮标准品、原料及水解后样品的液相色谱分析图Fig.4 Liquid chromatographic analysis of soybean isoflavones standard,raw material and hydrolysis sample
由图4液相色谱分析结果表明,根据保留时间,对应A和B,水解产物C中峰1和峰3信号基本消失,峰2仅有微弱的信号峰,与此同时,峰4~峰6相应增加,说明苹果酸对大豆异黄酮糖苷显示出较强的水解能力。
3 结论
在单因素实验基础上,通过正交实验优化苹果酸催化大豆异黄酮糖苷水解苷元的工艺条件,以大豆异黄酮糖苷的水解率作为评价指标,得出各因素对水解效果影响的主次顺序依次为反应温度>反应时间>苹果酸水溶液浓度。通过极差分析可知,反应温度对水解率影响显著。大豆异黄酮糖苷水解的最佳工艺条件为反应温度130℃,反应时间3.0h,催化剂苹果酸水溶液浓度2.0mol/L,在此条件下所得的大豆异黄酮糖苷水解率达到94.7%,达到和超过目前一般文献报导大豆异黄酮糖苷水解率。
本课题成功地探索出了一条简便、清洁、成本较低,水解产物无需后处理直接用于功能性食品的绿色合成工艺路线,弥补了现有工艺中的技术缺陷,因此实用性较高。
[1]Lun C K,Kung T L.Cloning,expression,and characterization of two β -glucosidases from isoflavone glycoside—hydrolyzingBacillus subtilisnatto[J].Journal of Agricultural and Food Chemistry,2008,56:119-125.
[2]Kawakami Y,Tsurugasaki W,Nakamura S,et al.Comparison of regulative functions between dietary soy isoflavones aglyeone and glucoside on lipid metabolism in rats fed cholesterol[J].Journal of Nutrition Biochemistry,2005,16:205-212.
[3]Setchell K D R,Cassidy A.Dietary isoflavones:biological effects and relevance to human healthr[J].Journal of Nutrition,1999,129:758S-767S.
[4]张逊,姚文,朱伟云.肠道大豆异黄酮降解菌研究进展[J].世界华人消化杂志,2006,14(10):973-978.
[5]高荣海,郑艳,刘长江.大豆异黄酮糖苷酸法水解工艺的研究[J].粮食加工,2008,3(1):54-57.
[6]孙艳梅,张永忠,许晶,等.黑曲霉β-葡萄糖苷酶水解大豆异黄酮糖苷研究[J].东北农业大学学报,2007,38(1):9-12.
[7]孙体健,王浩江,曹晓峰,等.发酵法水解大豆异黄酮提取条件的研究[J].食品研究与开发,2006,27(4):11-12.
[8]孟宪文,李长彪,刘长江,等.乳酸菌β-葡萄糖苷酶的分离纯化及特性研究[J].食品科学,2006,27(11):116-119.
[9]王振丽,李莉.利用微生物代谢酶转化大豆异黄酮的研究[J].食品研究与开发,2006,27(8):196-198.
[10]罗传义,时景荣.实验设计与数据处理[M].吉林:吉林人民出版社,2002:210-212.

