硫氧还蛋白TXN对视神经轴突损伤的保护作用
刘晓文 付汛安
硫氧还蛋白TXN对视神经轴突损伤的保护作用
刘晓文 付汛安
硫氧还蛋白;轴突形成;轴突保护;视神经
目的研究硫氧还蛋白(thioredoxin,TXN)在视神经轴突保护中的作用,为视神经损伤提供有效的治疗方案。方法制作大鼠视神经夹伤模型,以正常大鼠作为正常对照组。按夹伤后处死时间不同,选取伤后1周、2周、4周三个时间点,提取实验组和正常对照组中大鼠视网膜的mRNA和蛋白,通过RT-PCR和Western blot实验方法检测TXN表达情况;用曲古抑菌素A(TSA)刺激RGC-5细胞,观察在TSA刺激后,RGC-5细胞的轴突形成情况,并检测TXN表达量的变化。构建TXN的真核表达质粒,转染进RGC-5细胞,在TNF-α刺激条件下,观察RGC-5细胞的轴突形成情况以及轴突长度的改变。结果与正常大鼠比较,视神经夹伤模型大鼠中TXN的mRNA以及蛋白水平明显下降。在伤后1周,TXN mRNA表达量仅下降了32%,而在伤后2周、4周则分别下降了55%以及70%,说明TXN表达水平的降低是随着夹伤后时间的延长而增加的。用TSA诱导RGC-5细胞24 h,观察到RGC-5细胞形态发生明显改变,约65%的细胞分化产生轴突,而对照组(DMSO处理)中细胞没有形成轴突,同时Western blot结果显示,相对于DMSO处理,TSA刺激后TXN的表达明显升高。在TNF-α刺激下,RGC-5细胞的轴突形成比率从(65±5)%减少至(30±4)%,轴突长度从(100±6)μm下降至(74±6)μm。而在过表达TXN情况下,TNF-α刺激RGC-5细胞,轴突形成比率为(52±7)%,轴突的长度为(92±8)μm,较未刺激细胞仅有较少的降低。结论在轴突发生损伤后,TXN的表达量显著下降。而在轴突形成过程中,TXN的表达量明显上升并且过表达TXN能很好地减轻外界刺激诱导的轴突损伤。TXN可能参与了轴突形成并且能有效地防止轴突的损伤。
[眼科新进展,2014,34(7):636-639]
视神经是由视网膜神经节细胞(retinal ganglion cell,RGC)的轴突组成,RGC的进行性死亡是视神经损伤时导致视功能不可逆性损害的主要原因[1]。因此如何使视神经功能恢复,从而能够促进RGC的修复和再生是目前研究的热点。但目前在临床上,对视神经损伤后轴突再生的治疗还没有既安全又有效、能够推广应用的方法。硫氧还蛋白(thioredoxin,TXN)系统是一种普遍分布于各种生物、各个组织器官的氧化还原系统,由TXN、TXN还原酶(thioredoxin reduetase,TrxR)和还原型辅酶II(NADPH)共同组成[2-4]。近年来的研究证实,TXN系统广泛参与体内氧化还原反应、细胞增殖与凋亡、炎症应答、个体发育等多种生物学过程[5-7]。本研究将检测在轴突形成以及损伤过程中,TXN的表达情况,以及过表达TXN是否能有效保护轴突免受外界刺激导致的损伤,该研究将为视神经的保护以及再生提供理论依据。
1 材料与方法
1.1实验动物与分组健康成年Wistar大鼠(清洁级)60只,购自华中科技大学同济医学院实验动物中心,雌雄不限,室温环境下饲养。按随机数字表法分为正常对照组(30只)以及实验组(30只),在视神经夹伤后1周、2周、4周分别处死10只正常大鼠和10只视神经夹伤模型的大鼠,对动物的处理方法符合动物伦理学要求。
1.2RGC-5细胞培养细胞培养基为DMEM(Gibco),培养细胞时加入体积分数10%的胎牛血清,购于Invitrogen公司。细胞培养箱设定温度为37 ℃,CO2的含量为体积分数5%。
1.3实验试剂TSA和TNF-α购于Sigma公司,TXN来源于多克隆抗体(12000,Epitomic公司),RNA抽提试剂以及反转录试剂盒购于Invitrogen公司;TXN的RT-PCR引物为F:5’-AGCTTGTGGTAGTGGACTTCTCTG-3’;R:5’-CACCAGAGAACTCCCCAACCT-3’。
1.4实验方法
1.4.1构建大鼠视神经夹伤模型成年Wistar大鼠,用夹持力为148 g、端宽1 mm的小号动脉阻血镊,在眼球后2 mm处夹伤左侧视神经,致伤时间10 s,即可构建出视神经夹伤模型[8]。
1.4.2TXN真核表达质粒构建从武汉三鹰公司购得TXN基因的cDNA,通过EcoRⅠ和BamHⅠ将该cDNA接入到p3xFLAG-CMV-7.1质粒中。
1.4.3RT-PCR实验不同时间处死正常对照组以及实验组大鼠,取视网膜组织,加入2 mL的Trizol溶液,研磨后转入EP管中,室温放置5 min,加0.4 mL的氯仿,放置2~3 min后,4 ℃12 000 r·min-1离心15 min,取上层水相置于新EP管中,加入1 mL的异丙醇,放置10 min,4 ℃12 000 r·min-1离心10 min,加1 mL体积分数75%乙醇进行洗涤后,让沉淀的RNA在室温下自然干燥,用30 μL的RNAase-free water 溶解RNA沉淀。测定抽提的RNA浓度,利用Invitrogen公司的反转录试剂盒反转录2 μg总RNA,产生cDNA,用TXN特异性引物进行扩增。
1.4.4Westernblot实验分别在正常对照组以及实验组大鼠的视网膜组织中加入1 mL蛋白裂解液,研磨后转入EP管,4 ℃12 000 r·min-1离心10 min,收集上清,即为视网膜组织的总蛋白,用BCA试剂盒测定蛋白浓度。将收集得到的正常对照组以及实验组的蛋白样品进行SDS-PAGE电泳后电转到PVDF膜上,PVDF膜用TXN抗体4 ℃孵育过夜后,用TBST溶液洗涤3次,每次5 min,加入二抗,室温孵育1 h,TBST洗涤后,ECL显影。
1.4.5RGC-5细胞处理在DMSO培养液中加入和不加入500 nmol·L-1的TSA来培养RGC-5细胞,24 h后观察细胞形态的改变,并通过RT-PCR和Western blot的方法检测TXN表达量的变化。轴突RGC-5细胞在用药物刺激后,除去培养基,细胞固定后,用预热的Hochest溶液孵育20 min,再换用含轴突特异性定位蛋白的抗体温育1 h,用PBS清洗3次,每次5 min,加入 FITC标记的荧光二抗,孵育1 h。在荧光显微镜下计算细胞轴突产生的比例以及对轴突的长度进行测量。观察多个视野后进行统计,细胞总数目应大于200个[9]。在RGC-5细胞中分别转染p3xFLAG-CMV-7.1或者p3xFLAG-CMV-7.1-TXN质粒,培养12 h后,用500 nmol·L-1的TSA诱导24 h再分别用DMSO以及0.5 μg TNF-α刺激细胞4 h后,统计刺激后细胞轴突比率及长度的改变。
1.5数据处理和统计学分析用Quantity One软件对Western blot以及RT-PCR的结果进行灰度值计算,结果用Excel 7.0以及SPSS 16.0软件进行统计学分析。P<0.05为差异有统计学意义。
2 结果
2.1大鼠视神经夹伤后TXN的表达变化构建大鼠的视神经夹伤模型,取夹伤后1周、2周、4周3个时间点,分别提取正常大鼠以及视神经夹伤大鼠的视网膜mRNA以及蛋白,利用RT-PCR以及Western blot检测TXN的mRNA以及蛋白水平的变化。从RT-PCR结果来看,视神经夹伤后,TXN mRNA水平明显下降,并且随着视神经夹伤时间的延长,TXN mRNA下降更加明显(图1),对RT-PCR结果进行定量分析后发现:在伤后1周,TXN mRNA只下降了32%,而在伤后2周、4周则分别下降了55%以及70%(图1)。Western blot检测视网膜组织中TXN蛋白的表达,结果显示在视神经夹伤后,TXN的蛋白水平亦出现明显下降(P<0.05),并随时间的延长而更明显,结果与RT-PCR一致(图1)。
2.2TSA诱导RGC-5细胞产生轴突并能显著地增加TXN的表达我们用500 nmol·L-1的TSA诱导RGC-5细胞24 h后,发现细胞的形态发生了明显的改变。在诱导前,RGC-5细胞表现为梭形,而在诱导后,细胞改变为星形,并产生与神经元轴突类似的结构(图2)。该结果表明RGC-5细胞可以作为轴突形成以及损伤的细胞研究模型。为了研究TXN在轴突形成中的功能,我们用RT-PCR检测在TSA诱导前后TXN mRNA水平的改变,对RT-PCR进行定量分析发现:在TSA诱导后,TXN mRNA水平上升了2倍(图2)。Western blot检测TSA诱导后RGC-5细胞中TXN蛋白水平,结果亦显示TXN蛋白在诱导后表达水平也显著增高(图2)。为了进一步研究TSA诱导时间对TXN表达量的影响,RGC-5细胞在诱导6 h、12 h、18 h、24 h后,分别检测TXN mRNA水平,发现随着诱导时间的延长,TXN mRNA水平增加更加显著,同时观察到随着诱导时间的延长,RGC-5细胞产生轴突的比例以及轴突的长度都有增长。该结果说明TXN可能参与了轴突的形成。

Figure 1 Expression of TXN at different time after ON injury.A:TXN mRNA level at different time after ON injury,the results showed that with the time of ON injury prolonged,TXN mRNA decreased more significantly;B:Histogram analysis of TXN mRNA level;C:TXN protein level at different time after ON injury,the result was consistent with the result of TXN mRNA level 大鼠视神经夹伤后不同时间段TXN的表达变化。A:TXN mRNA的改变,结果显示随着视神经夹伤后时间的延长,TXN mRNA下降更显著;B:TXN mRNA结果的柱状图分析;C:TXN蛋白水平的改变,与TXN mRNA结果一致
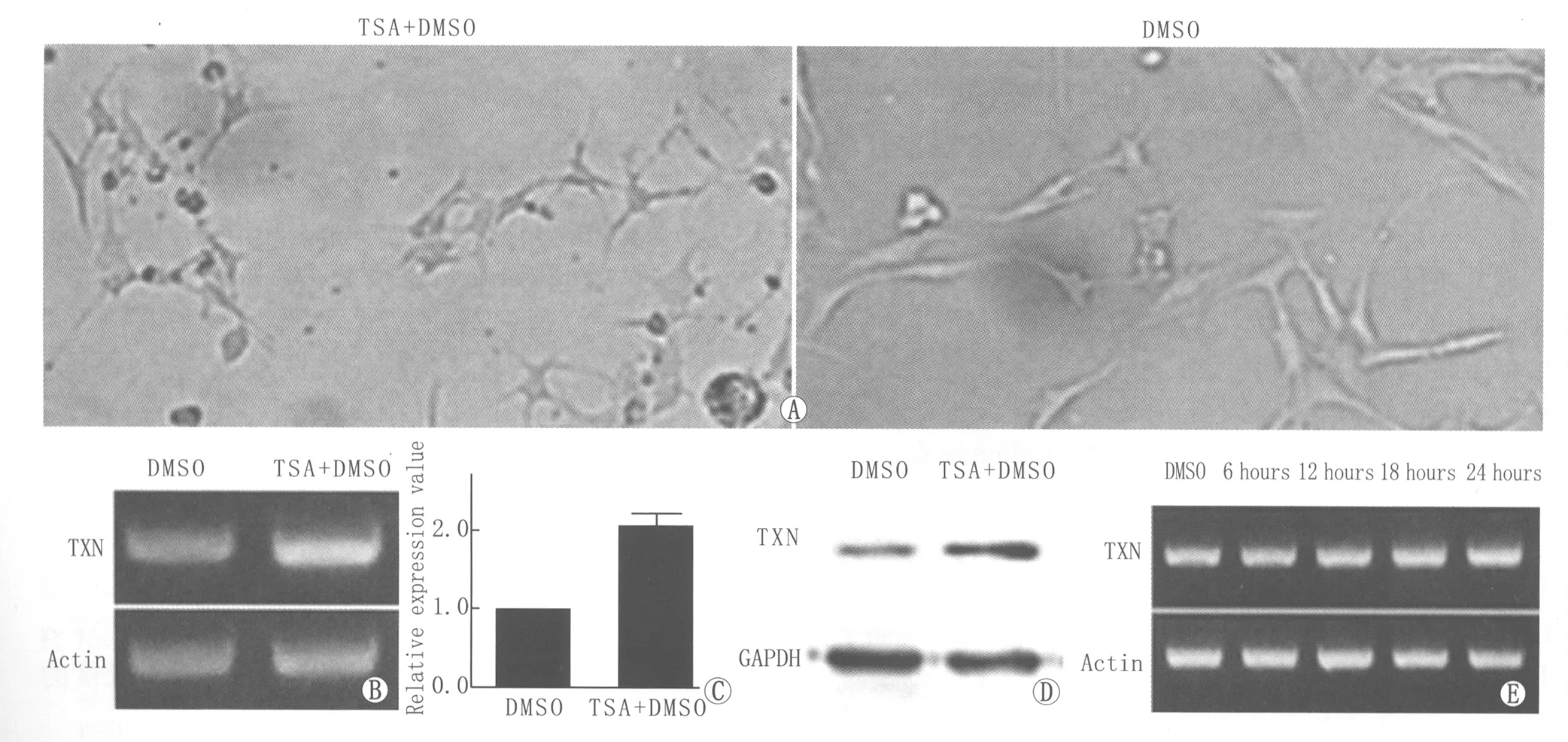
Figure 2 Expression of TXN increased when RGC-5 cells were induced to form neurite outgrowth by TSA.A:TSA changed the morphology of RGC-5 cells,which formed the neuron appearance with axon formation;B:TXN mRNA level increased when RGC-5 cells was induced by TSA;C:Histogram analysis of TXN mRNA level of;D:TXN protein level increased when RGC-5 cells was induced by TSA;E:TXN mRNA level increased when RGC-5 induced by TSA at different time TSA诱导RGC-5细胞产生神经轴突类似结构,TXN表达显著增加。A:TSA诱导RGC-5细胞形态改变,诱导后RGC-5细胞形态呈现神经元形态,且有轴突产生;B:TSA诱导RGC-5细胞TXN mRNA表达水平增加;C:TXN mRNA结果的柱状图分析;D:在TSA诱导条件下,TXN蛋白水平显著增加;E:TSA诱导不同时间后RGC-5细胞TXN mRNA表达变化
2.3TXN保护TNF-α诱导的轴突损伤为了验证TXN是否能保护轴突免受TNF-α诱导的损伤,我们在RGC-5细胞中转染p3xFLAG-CMV-7.1-TXN质粒,过表达TXN蛋白,对照组转染空载体,通过Western blot检测该质粒过表达结果见图3。转染12 h后,用500 nmol·L-1的TSA诱导RGC-5细胞24 h,再用0.5 μg的TNF-α刺激细胞4 h,统计产生轴突的细胞比例以及轴突的长度,结果见表1。

Figure 3 Over-expression of TXN protein in RGC-5 RGC-5细胞TXN蛋白过表达情况

表1 TXN过表达时RGC-5细胞轴突形成比例以及轴突长度Table 1 Proportion and length of axon with over-expression of TXN in RGC-5 cells(±s)
3 讨论
引起视功能损害或丧失的主要原因可归为3类:屈光性、血管性和神经性。其中神经性损害包括:青光眼视神经病变、缺血、外伤、肿瘤、糖尿病视网膜病变及脱髓鞘病变等引起的视神经(尤其是指RGC)的破坏和变性。由于神经损伤的不可逆性,视神经损伤性疾病目前是眼科领域最棘手和亟待解决的问题。近年来关于视功能的研究重点就在于疾病和损伤后如何促进中枢视觉联系的修复与再生。本研究发现在视神经受损的大鼠模型中,TXN在mRNA以及蛋白水平表达显著下降,而在RGC-5细胞的轴突形成中,TXN的表达明显增强,同时过表达TXN能有效地抑制TNF-α诱导的轴突损伤,因此我们认为TXN可能参与轴突形成以及保护,该研究将为视神经的再生提供理论依据以及可能的治疗手段。
由于原代培养神经元十分困难,而且不利于细胞转染,大大限制了轴突损伤的机制研究。有研究发现在TSA的诱导下,RGC-5细胞能呈现出神经元的形态,这为轴突的研究提供了一个良好的模型。应用该细胞模型,我们能很好地证明TXN在轴突形成与损伤中的作用。
虽然我们指出TXN可能参与轴突形成以及保护,但具体的分子机制仍不清楚。细胞骨架是轴突的主要组成结构,当眼压升高导致视神经损伤时,视神经中的F-actin的含量明显减少,而用药物抑制F-actin的解聚可以有效地保护视神经。说明F-actin的调控参与了轴突保护以及形成过程。而近年在内皮细胞的研究中发现TXN能与微丝骨架蛋白actin相互作用[10-11],在氧化压力下维持微丝骨架的稳定。并且有文献报道TXN在大脑神经元的轴突处有定位[12]。因此我们推测TXN定位在视神经处,通过与actin直接相互作用,从而调控了F-actin的聚合,最终保护轴突。以后我们将通过进一步的实验证明该假设。
1 Fischer D,Leibinger M.Promoting optic nerve regeneration[J].ProgRetinEyeRes,2012,31(6):688-701.
2 Dal Piaz F,Braca A,Belisario MA,De Tommasi N.Thioredoxin system modulation by plant and fungal secondary metabolites[J].CurrMedChem,2010,17(5):479-494.
3 Buchanan BB,Holmgren A,Jacquot JP,Scheibe R.Fifty years in the thioredoxin field and a bountiful harvest[J].BiochimBiophysActa,2012,1820(11):1822-1829.
4 Cejudo FJ,Ferrandez J,Cano B,Puerto-Galan L,Guinea M.The function of the NADPH thioredoxin reductase C-2-Cys peroxiredoxin system in plastid redox regulation and signalling[J].FebsLett,2012,586(18):2974-2980.
5 Holmgren A,Lu J.Thioredoxin and thioredoxin reductase:current research with special reference to human disease[J].BiochemBiophysResCommun,2010,396(1):120-124.
6 Watanabe R,Nakamura H,Masutani H,Yodoi J.Anti-oxidative,anti-cancer and anti-inflammatory actions by thioredoxin 1 and thioredoxin-binding protein-2[J].PharmacolTher,2010,127(3):261-270.
7 Nakamura H,Hoshino Y,Okuyama H,Matsuo Y,Yodoi J.Thioredoxin 1 delivery as new therapeutics[J].AdvDrugDelivRev,2009,61(4):303-309.
8 刁金美,冯国栋,钱新宏,焦西英,游思维.用于中枢神经系统Waller变性研究的新型大鼠视神经夹伤模型[J].神经解剖学杂志,2008,23(3):239-244.
9 Zheng J,Feng X,Hou L,Cui Y,Zhu L,Ma J,etal.Latanoprost promotes neurite outgrowth in differentiated RGC-5 cells via the PI3K-Akt-mTOR signaling pathway[J].CellMolNeurobiol,2011,31(4):597-604.
10 Zschauer TC,Kunze K,Jakob S,Haendeler J,Altschmied J.Oxidative stress-induced degradation of thioredoxin-1 and apoptosis is inhibited by thioredoxin-1-actin interaction in endothelial cells[J].ArteriosclerThrombVascBiol,2011,31(3):650-656.
11 Wang X,Ling S,Zhao D,Sun Q,Li Q,Wu F,etal.Redox regulation of actin by thioredoxin-1 is mediated by the interaction of the proteins via cysteine 62[J].AntioxidRedoxSignal,2010,13(5):565-573.
12 Lippoldt A,Padilla CA,Gerst H,Andbjer B,Richter E,Holmgren A,etal.Localization of thioredoxin in the rat brain and functional implications[J].JNeurosci,1995,15(10):6747-6756.
date:Jul 21,2013
Protective effects of thioredoxin on optic nerve axon damage
LIU Xiao-Wen,FU Xun-An
thioredoxin;axon formation;axon protection;optic nerve
ObjectiveTo investigate the protective effects of thioredoxin(TXN) on optic nerve (ON) crushed in rats,and provide effective treatment for the prevention of optic nerve injury.MethodsThe traumatic optic nerve model in rats were established,the normal rats acted as a control group.Respectively at 1 week,2 weeks,4 weeks after ON injury,the retina mRNA and protein from two groups were extracted.By RT-PCR and Western blot,the expression of TXN was detected.After stimulating RGC-5 with trichostatin A,the ratio and lengths of cell axons were counted and the expression of TXN was detected.Treating with DMSO acted as a control group.Under stimulation of TNF-α,the thioredoxin protein in RGC-5 cells were over-expressed and axon formation of RGC-5 cells were observed.ResultsCompared with the normal rats,TXN mRNA and protein levels were significantly decreased in ON crush model rats.At 1 week after injury,TXN expression decreased by 32%,while at 2 weeks and 4 weeks after injury,TXN expression was down by 55% and 70%,respectively,which indicated that the level of TXN decreased more with the extension of injury time.When RGC-5 cells were induced by TSA for 24 hours,(65±5)% of the cells could produce axon,whereas the control group did not detect the axon.TXN expression also increased after treating with TSA.After stimulation with TNF-α,the proportion of axon dropped to (30±4)%,axon length decreased from (100±6)μm to (74±6)μm,but over-expression of TXN in RGC-5 cells,the proportion could recover to (52±7)% and the axon length could recover to (92±8)μm.ConclusionAfter ON injury,TXN expression is significantly decreased.In the axon formation process,the expression of TXN increases significantly.Over-expression of TXN can inhibit axonal injury induced by external stimuli.These results indicate that TXN is involved in axon formation and can effectively protect the axons from injury.
刘晓文,女,1979年10月出生,湖北随州人,博士,主治医师。主要研究方向:青光眼和视网膜色素变性的分子遗传学研究。E-mail:liuxiaowen1979@126.com
AboutLIUXiao-Wen:Female,born in October,1979.Doctor degree.Attending doctor.E-mail:liuxiaowen1979@126.com
2013-07-21
430014 湖北省武汉市,武汉市中心医院眼科
付汛安,E-mail:fxayanke@sina.com
刘晓文,付汛安.硫氧还蛋白TXN对视神经轴突损伤的保护作用[J].眼科新进展,2014,34(7):636⁃639.
10.13389/j.cnki.rao.2014.0174
【实验研究】
修回日期:2013-12-20
本文编辑:董建军
Accepteddate:Dec 20,2013
From theDepartmentofOphthalmology,WuhanCentralHospital,Wuhan430014,HubeiProvince,China
Responsibleauthor:FU Xun-An,E-mail:fxayanke@sina.com
[RecAdvOphthalmol,2014,34(7):636-639]

