高迁移率族B1(HMGB-1)蛋白在鼠视网膜新生血管形成中的调控作用△
万志荔 赖史胜
【实验研究】
高迁移率族B1(HMGB-1)蛋白在鼠视网膜新生血管形成中的调控作用△
万志荔 赖史胜
高迁移率族B1蛋白;视网膜新生血管;基质胶;氧诱导视网膜病变;荧光造影视网膜铺片;Western-blot
目的 探讨高迁移率族B1(high mobility group box-1,HMGB-1)蛋白在鼠视网膜新生血管形成中的调控作用。方法 将基质胶(Matrigel)和HMGB-1混合物注入鼠龄为7 d(P7)的C57BL/6J健康小鼠左眼视网膜下,基质胶与PBS混合物注入右眼球作为对照组。注入10 d后对获得的视网膜组织切片进行HE染色,计数突破视网膜前膜的血管内皮细胞核数。选用C57BL/6J 健康新生鼠建立氧诱导视网膜病变(oxygen-induced retinopathy,OIR)动物模型,出生后第 7 天(P7)放入高氧环境中连续饲养5 d,然后置入正常空气中继续饲养;正常空气对照组小鼠则在空气中饲养。在P17采用DiI荧光造影视网膜铺片观察OIR模型组和正常空气对照组小鼠视网膜血管形态变化;同时采用Western-blot检测模型组和对照组小鼠玻璃体中HMGB-1蛋白的表达水平。结果 HMGB-1基质胶模型组与PBS基质胶对照组基质胶区域突破视网膜内界膜的血管内皮细胞核数分别为(42.19±1.76)个、(31.24±1.25)个,经过HMGB-1与基质胶混合物处理的眼球中新生血管水平显著高于对照组(t=-42.42,P=0.000)。DiI荧光造影视网膜铺片结果显示,OIR模型组鼠视网膜自视盘向中周部出现大片无灌注区,无灌注区周围出现新生血管丛;Western-blot分析显示,与正常空气对照组相比,OIR模型组鼠玻璃体中HMGB-1蛋白表达增加了78%±7%,出现了显著上调(t=-47.90,P=0.000)。结论 HMGB-1在视网膜新生血管形成中起重要的调控作用。
[眼科新进展,2014,34(12):1128-1131]
视网膜新生血管形成是糖尿病视网膜病变、视网膜中央静脉阻塞、年龄相关性黄斑变性等眼病的严重并发症,与其相伴的渗出、出血、增生等一系列病理改变可严重破坏眼的结构和功能,导致患者视力障碍[1-2]。针对这类血管新生性疾病,目前临床常用的玻璃体切割术、激光光凝、光动力疗法等都有一定的局限性,这是因为其未能完全消除刺激视网膜新生血管形成的因素,从而使新生血管反复生长。玻璃体腔注射Avastain、Lucentis等血管内皮生长因子(vascular endothelial growth factor,VEGF)拮抗剂虽能在一定程度上抑制视网膜新生血管的形成,但是阻断VEGF却不能完全抑制或消除视网膜血管新生的发生,这就意味着VEGF并不是唯一重要的促血管生成因子,可能还存在其他类型的促血管生成因子[3]。
高迁移率族B1(high mobility group box-1,HMGB-1)蛋白是一种相对分子质量为25 000的非组DNA结合蛋白,且是在进化中高度保守的细胞核蛋白[4]。它能使核小体稳定形成,并促进基因转录[5]。细胞死亡后,HMGB-1不再与细胞核紧密结合,从而会导致细胞中HMGB-1的被动释放。除此之外,HMGB-1可以由多种不同类型的细胞分泌,包括激活的单核细胞、巨噬细胞、成熟的树突状细胞、自然杀伤细胞以及血管内皮细胞[5]。有研究证实,细胞外的HMGB-1会激活模式识别受体Toll样受体4(toll-like receptor 4,TLR4)和糖基化终末产物受体(receptor for advanced glycation end,RAGE),触发炎症和伤害,从而促进组织的新生血管形成[6]。由于HMGB-1能够促进许多组织的新生血管形成,因此有必要检测HMGB-1是否会导致视网膜新生血管的形成,从而确定其是否为重要的视网膜促血管生成因子。本研究的目的是探讨HMGB-1在鼠视网膜新生血管形成中的调控作用,从而为治疗视网膜新生血管形成提供新的研究方向。
1 材料与方法
1.1 动物来源 42只C57BL/6J新生健康小鼠(雌雄不限,体质量25~30 g)购自南京君科生物工程有限公司,且在室内、标准温度和湿度环境下培养,12 h光照/黑暗周期,同时正常获得食物和水。
1.2 基质胶诱导新生血管模型 基质胶购自上海浩然生物技术有限公司,重组人HMGB-1购自北京义翘神州生物技术有限公司。先将处于PBS缓冲液中的重组人HMGB-1(1.25 μg)与基质胶(0.8 μL)混合,而只有PBS稀释的基质胶则作为阴性对照。然后分别在14只P7小鼠左眼视网膜下缓慢注入含有HMGB-1的基质胶(0.8 μL),在小鼠右眼视网膜下缓慢注入PBS稀释的基质胶(0.8 μL)作为阴性对照组,注射针保持在原位 1~2 min,以使凝胶固化。在鼠龄P17时处死小鼠,快速摘除眼球,4 ℃下固定于眼球固定液中24 h。常规脱水后,石蜡进行包埋,切片方向与角膜和视神经连线的视轴线平行,切片厚5 μm。然后进行HE染色(苏木精-伊红染色),排除含有视神经的切片,同时筛取包含有基质胶区域的切片,最终每只眼球随机取出满足要求的5张切片。光学显微镜下对每张切片基质胶区域内突破视网膜内界膜的血管内皮细胞核进行计数,每组分别计数70张切片并取其平均值。
1.3 氧诱导新生血管模型 采用文献[7]的方法建立氧诱导视网膜病变(oxygen-induced retinopathy,OIR)模型。首先将鼠龄为7 d(P7)的C57BL/6J小鼠28只随机分为两组:14只为正常空气对照组,正常环境中喂养;另外14只为模型组,连同母鼠一起放入密闭氧舱中,保持氧舱为常压,氧体积分数为75%,温度为23 ℃,每2 d替换母鼠。室内采用日光灯照明,光照周期为12 h光照/黑暗。5 d后(P12)将小鼠放回到正常环境中继续饲养。鼠龄17 d(P17)时OIR模型组和正常空气对照组小鼠被过量CO2杀死。
1.4 DiI荧光造影视网膜铺片观察OIR模型视网膜血管形态变化 对OIR模型进行DiI荧光造影视网膜铺片[8]:将正常对照组、OIR模型组P17小鼠分别称质量后用10 g·L-1戊巴比妥钠(30 mg·kg-1)腹腔内注射麻醉小鼠。麻药起效后打开胸腔暴露心脏,左心室注射1 mL PBS进行心脏灌注,并剪开右心耳。然后继续灌注3 mL DiI(工作浓度),当小鼠口鼻、耳尖、四肢末端、尾部变为粉红色时标志灌注成功。过量CO2处死动物,快速摘除眼球后置入40 g·L-1多聚甲醛溶液中,4 ℃下固定30 min。取出眼球放入盛有 PBS的玻璃平皿中,沿角巩膜缘环形剪开眼球,分离出视网膜,小心去除玻璃体(留作Western-blot分析),以视盘为中心放射状剪开视网膜呈四瓣,将载玻片放入PBS中,使视网膜贴附于载玻片上,铺平视网膜,吸干其周围水分。在视网膜表面滴20 g·L-1中性树胶,盖玻片封片。荧光显微镜下观察视网膜铺片,比较视网膜血管形态变化。
1.5 Western-blot分析 对OIR模型进行Western-blot分析。将分离出来的模型组和对照组小鼠玻璃体用33 G针刺穿,将流出来的玻璃体组织滴状液收集起来以获得玻璃体组织,容量为2.5 μL,然后转移至含有12.5 μL PBS溶液的试管中。4 ℃、1100 r·min-1离心15 min,得到上层清液。上层清液经过SDS-PAGE电泳后,将蛋白转印至PVDF膜上,并用含有50 g·L-1脱脂奶粉和1 g·L-1TBST的缓冲液在室温下阻断1 h。采用兔多克隆抗HMGB-1抗体(上海沪尚生物科技有限公司)进行孵育。经过一晚的一抗孵育后,使用TBST缓冲液冲洗3次(每次10 min),并用抗兔第二共轭辣根过氧化物酶抗体在室温下孵育1 h。再次使用TBST缓冲液冲洗3次(每次10 min)。继而用滤纸吸干 PVDF 膜表面水分,配制发光液,将其均匀滴在 PVDF 膜上。在暗室中压片、显影、定影。待胶片洗净、晾干后扫描,使用Image-Lab软件进行灰度分析,以正常空气对照组作为内对照,计算模型组HMGB-1的相对灰度值。

2 结果
2.1 2组小鼠突破视网膜内界膜的新生血管内皮细胞核计数比较 HMGB-1基质胶模型组与PBS基质胶对照组鼠视网膜基质胶区域都可见大量突破视网膜内界膜的新生血管内皮细胞核(图1),血管腔呈丛状、团状,视网膜结构紊乱,在视网膜各层都可观察到血管增生。HMGB-1基质胶模型组与PBS基质胶对照组基质胶区域突破视网膜内界膜的新生血管内皮细胞核数分别为(42.19±1.76)个、(31.24±1.25)个,差异有显著统计学意义(t=-42.42,P=0.000);与PBS基质胶对照组相比,HMGB-1基质胶模型组中的新生血管水平出现显著上升。
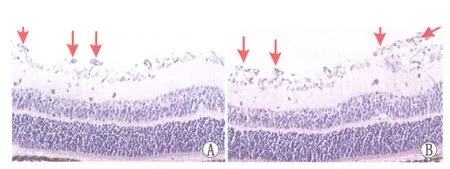
Figure 1 HE staining of retinal in matrigel area of two groups.A:Matrigel with PBS group;B:Matrigel with HMGB-1 group 2组基质胶区域视网膜组织HE染色分析。A:PBS基质胶对照组;B:HMGB-1基质胶模型组
2.2 OIR模型组与正常对照组小鼠视网膜血管形态比较 正常空气对照组:DiI荧光造影视网膜铺片结果显示P17小鼠的整个视网膜血管分布均匀,并未出现血管不规则扩张(图2A)。OIR模型组:DiI荧光造影视网膜铺片结果显示,P17小鼠视网膜自视盘向中周部出现大片无灌注区,无灌注区周围出现新生血管丛;视网膜大血管迂曲,出现不规则扩张(图2B)。
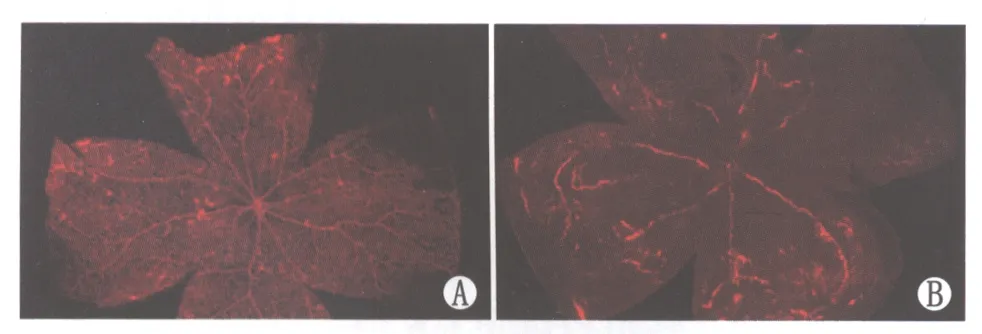
Figure 2 DiI fluorescence angiography of OIR model group and normal control group.A:Normal control group;B:OIR model group OIR模型组与正常空气对照组鼠DiI心脏灌注视网膜铺片。A:正常空气对照组;B:OIR模型组
2.3 OIR模型组与正常对照组小鼠视网膜玻璃体中HMGB-1蛋白的表达差异 Western-blot结果显示:P17获得的OIR模型组和正常空气对照组鼠玻璃体组织中HMGB-1蛋白的表达差异有显著统计学意义(图3)。与正常空气对照组相比,OIR模型组小鼠玻璃体中HMGB-1蛋白表达增加了78%±7%,出现了显著上调(t=-47.90,P=0.000)。

Figure 3 Western Blot and quantitative analysis of HMGB-1 expression in normal control group and ORI model group OIR模型组与正常对照组小鼠视网膜中HMGB-1蛋白表达的Western-blot分析和相对定量分析
3 讨论
HMGB-1作为一种DNA结合细胞核蛋白质,在细胞因子刺激后会主动释放,在坏死细胞死亡时会被动释放[5]。HMGB-1能够促进炎症反应,同时通过众多机制导致伤害[9],同时HMGB-1也能够在一些组织中促进血管新生[10]。本研究中我们同样发现,HMGB-1在视网膜新生血管形成中起重要的调控作用。有研究证实细胞外HMGB-1会导致组织的血管新生,为了验证HMGB-1是否会调节视网膜血管新生,我们首先采用基质胶模型检测HMGB-1在视网膜新生血管形成中的作用。基质胶作为一种可溶性的基底膜基质,包括层粘连蛋白、TGF-β、成纤维细胞生长因子、组织纤维酶原活化因子等各种生长因子,它能够有效促进血管新生[11]。本研究结果显示:HMGB-1基质胶模型组基质胶区域小鼠突破视网膜界内膜的新生血管内皮细胞核数显著高于PBS基质胶模型对照组,这就意味着与PBS基质胶对照组相比,HMGB-1基质胶模型组中的新生血管水平出现显著上升(t=-42.42,P=0.000)。为了进一步评估HMGB-1在血管新生中的作用,我们观察了OIR小鼠模型。通过对OIR模型组以及正常空气对照组鼠眼球进行DiI荧光造影视网膜铺片,以及对分离出来的玻璃体组织进行Western-blot分析,我们发现与正常对照组相比,OIR模型组小鼠视网膜出现大量新生血管。且OIR模型组鼠玻璃体中HMGB-1蛋白表达增加了78%±7%,出现了显著上调(t=-47.90,P=0.000)。这些结果显示HMGB-1在OIR模型的视网膜新生血管形成中起着重要的调控作用。同时结合基质胶诱导视网膜血管新生和OIR模型,我们可以得出结论:HMGB-1在视网膜新生血管形成中起促进作用。
迄今为止,有关HMGB-1对视网膜影响的研究主要集中在糖尿病视网膜病变上。El-Asrar等[5]发现,伴有活跃新生血管形成的增殖性糖尿病视网膜病变(proliferative diabetic retinopathy,PDR)患者玻璃体中HMGB-1的含量远高于无活跃血管新生PDR患者以及非糖尿病患者。同时,Biscetti等[12]发现在糖尿病鼠中,HMGB-1会以VEGF-A相关的方式导致视网膜局部贫血诱导的血管新生,这与我们的研究结论相一致。而Mohammad等[13]通过对正常鼠玻璃体中HMGB-1进行研究发现,HMGB-1的增加会导致RAGE、ERK1/2以及NF-κB等促炎生物标记物的上调,并引起闭合蛋白的下调[13],但是他们并没有检测由此引起的视网膜血管新生情况。结合El-Asrar等[5]和Biscetti等[12]对糖尿病中HMGB-1的研究以及本研究结果,我们认为与糖尿病鼠类似,在血管新生形成过程中,HMGB-1同样可能通过激活其他的细胞因子来启动视网膜中HMGB-1相关的血管新生。结合Mohammad等[13]的结论和本研究对基质胶和OIR模型的实验发现,我们可以推测出视网膜新生血管形成过程中HMGB-1的信号转导路径:首先HMGB-1蛋白的增加会加强其与RAGE受体之间的相互作用,导致ERK1/2的激活,从而进一步激活NF-κB的磷酸化。而NF-κB是众所周知的转录调节因子[14],其在视网膜炎症信号转导中起核心作用,由HMGB-1引起的NF-κB激活会导致炎症的发生,并降低闭合蛋白的含量,致使血-视网膜屏障功能的缺失,最终打破血-视网膜屏障,导致视网膜新生血管的形成。
在本研究中,我们探讨了HMGB-1在视网膜新生血管形成中所起的调控作用,结果发现HMGB-1在视网膜血管新生中起显著促进作用,HMGB-1的增加会促进视网膜新生血管的形成。该研究对全面阐述视网膜新生血管的发生机制和寻求有效的临床治疗方法有着重要的意义,从而可能为视网膜病理性新生血管性疾病的治疗提供新的候选基因。
1 Adlerereutz H,Markkanen H,Watanabe S.Plasma concentrationsof phyto-oestrogens in Japanese men[J].Lancet,1993,342(8881):1209-1210.
2 张含,刘哲丽.可溶性Tie2融合蛋白玻璃体腔注射对实验性视网膜血管新生和缺血性视网膜病变的影响[J].国际眼科杂志,2008,8(3):502-504.
3 Kovach JL,Schwartz SG,Hickey M,Puliafito CA.Thirty-two month follow-up of successful treatment of choroidal neovascularization from angioid streaks with intravitreal bevacizumab[J].OphthalmicSurgLasersImaging,2009,40(1):77-79.
4 Nehil M,Paquette J,Tokuyasu T,McCormick F.High mobility group box 1 promotes tumor cell migration through epigenetic silencing of semaphorin 3A[J].Oncogene,2014,33(44):5151-5162.
5 El-Asrar AM,Nawaz MI,Kangave D,Geboes K,Ola MS,Ahmad S,etal.High-mobility group box-1 and biomarkers of inflammation in the vitreous from patients with proliferative diabetic retinopathy[J].MolVis,2011,17(6):1829-1838.
6 Van Beijnum JR,Buurman WA,Griffioen AW.Convergence and amplification of toll-like receptor(TLR)and receptor for advanced glycation end products(RAGE)signaling pathways via high mobility group B1(HMGB1)[J].Angiogenesis,2008,11(1):91-99.
7 Vannay A,Dunai G,Bányász I,Szabó M,Vámos R,Treszl A,etal.Association of genetic polymorphisms of vascular endothelial growth factor and risk for proliferative retinopathy of prematurity[J].PediatrRes,2005,57(3):396-398.
8 Eltzschig HK,Kohler D,Eckle T,Kong T,Robson SC,Colgan SP.Central role of Sp1-regulated CD39 in hypoxia/ischemia protection[J].Blood,2009,113(1):224-232.
9 罗强,田培超,王怀立,乔晓辉.丙酮酸乙脂对脂多糖致幼年大鼠脑损伤高迁移率族蛋白B1水平的影响及意义[J].实用儿科临床杂志,2009,24(15):1182-1184.
10 Mitola S,Belleri M,Urbinati C,Coltrini D,Sparatore B,Pedrazzi M,etal.Cutting edge:extracellular high mobility group box-1 protein is a proangiogenic cytokine[J].JImmunol,2006,176(1):12-15.
11 杜春艳,卢强,李立品,杨洁,王春晖,田娟,等.大叶性肺炎患儿血清肿瘤坏死因子-α、白细胞介素-6、白细胞介素-8、白细胞介素-10和高迁移率族蛋白B1表达意义[J].中华实用儿科临床杂志,2014,29(16):1224-1227.
12 Biscetti F,Straface G,De Cristofaro R,Lancellotti S,Rizzo P,Arena V,etal.High mobility group box-1 protein promotes angiogenesis after peripheral ischemia in diabetic mice through a VEGF-dependent mechanism[J].Diabetes,2010,59(6):1496-1505.
13 Mohammad G,Siddiquei MM,Othman A,Al-Shabrawey M,Abu El-Asrar AM.High-mobility group box-1 protein activates inflammatory signaling pathway components and disrupts retinal vascular-barrier in the diabetic retina[J].ExpEyeRes,2013,107(1):101-109.
14 Luan ZG,Zhang H,Yang PT,Ma XC,Zhang C,Guo RX.HMGB1 activates nuclear factor-B signaling by RAGE and increases the production of TNF-κa in human umbilical vein endothelial cells[J].Immunobiology,2010,215(12):956-962.
date:Apr 12,2014
Mediation effects of high mobility group B1 protein on retinal neovascularization in mice
WAN Zhi-Li,LAI Shi-Sheng
high mobility group B1 protein;retinal neovascularization;matrigel;oxygen-induced retinopathy;fluorescence angiography;Western Blot
Objective To investigate the mediation effects of high mobility group B1 (HMGB-1)protein on retinal neovascularization in mice.Methods HMGB-1 in phosphate buffered saline (PBS)was mixed with matrigel,and matrigel diluted with PBS only was used as a control.The matrigel with HMGB-1 and PBS only was slowly injected to the subretinal of P7 C57BL/6J mice to form the matrigel induced model of neovascularization.And retinal neovascularization level of P17 matrigel induced model mice was quantified by counting the endothelial nuclei protruding into the vitreous cavity by HE staining.C57BL/6J mice were used to form the oxygen-induced retinopathy (OIR)model.Mice were exposed to 75% oxygen tension from P7 to P12.And then they were returned to normal air and maintained for another 5 days (P17).Normoxia control mice of age identical with the hyperoxia group were maintained at room air.Retinal neovascularization was observed by fluorescence angiography at P17.Western blot analysis was also used to determine protein levels of HMGB-1 in the retinal of mice at P17.Results The average endothelial cells which breaking through the inner limiting membrane in HMGB1 with matrigel group and PBS with matrigel group were 42.19±1.76,31.24±1.25,respectively.The level of neovascularization in the retina of HMGB-1 with matrigel group was higher than that of PBS with matrigel group (t=-42.42,P=0.000).The DiI fluorescence angiography of the mice showed that the non-perfusion area appeared from optic disc to peripheral portion in OIR model group,and a large scale of neovascular plexus appeared in this non-perfusion area.Western-blot analysis showed that the HMGB-1 protein expression in OIR model group had a 78%±7% increase compared with control animals (t=-47.90,P=0.000).Conclusion HMGB-1 plays an significant role in retinal neovascularization.
万志荔,赖史胜.高迁移率族B1(HMGB-1)蛋白在鼠视网膜新生血管形成中的调控作用[J].眼科新进展,2014,34(12):1128-1131.
10.13389/j.cnki.rao.2014.0313
万志荔,女,1979年出生,江西临川人,硕士,主治医师。主要从事眼科疾病临床早期诊断。联系电话:13970792856;E-mail:KW856@sina.com
About WAN Zhi-Li:Female,born in 1979.Master degree,attending doctor.Tel:13970792856;E-mail:KW856@sina.com
2014-04-12
修回日期:2014-06-19
本文编辑:方红玲
江西省教育厅科技计划项目(编号:GJJ13693)
341000 江西省赣州市,赣南医学院第一附属医院眼科
Accepted date:Jun 19,2014Foundation item:Supported by Science and Technology Planning Project of Jiangxi Province(No:GJJ13693)From theDepartmentofOphthalmology,theFirstAffiliatedHospitalofGannanMedicalCollege,Ganzhou341000,JiangxiProvince,China
[Rec Adv Ophthalmol,2014,34(12):1128-1131]

