结缔组织生长因子在人视网膜色素上皮细胞的增生、迁移和上皮细胞-间充质细胞转变中的作用△
田蓉 于颖 陈有信
【实验研究】
结缔组织生长因子在人视网膜色素上皮细胞的增生、迁移和上皮细胞-间充质细胞转变中的作用△
田蓉 于颖 陈有信
结缔组织生长因子;视网膜色素上皮细胞;增生;迁移;上皮细胞-间充质细胞转变;增生性玻璃体视网膜病变
目的 研究结缔组织生长因子(connective tissue growth factor,CTGF)在人视网膜色素上皮(retinal pigment epithelium,RPE)细胞的增生、迁移和上皮细胞-间充质细胞转变(epithelial mesenchymal transition,EMT)中的作用。方法 采用CCK-8细胞计数试剂盒测定400 ng·mL-1CTGF处理后的ARPE-19细胞以及稳定表达CTGF siRNA或对照siRNA的ARPE-19细胞的增生情况。采用细胞划痕实验评估CTGF RNAi对ARPE-19细胞迁移的影响,同时测定稳定表达CTGF siRNA或对照siRNA的ARPE-19细胞中CTGF、FN、MMP-2和α-SMA的表达水平以评估CTGF对于TGFβ1诱导的EMT作用。结果 400 ng·mL-1CTGF处理组APRE-19细胞与未接受CTGF处理组细胞之间以及CTGF siRNA处理组与阴性对照siRNA组之间的细胞倍增时间均存在显著差异(均为P<0.05)。正常培养ARPE-19细胞组修复划痕的时间(≤48 h)显著少于CTGF RNAi靶向干扰处理组(≥72 h)。以TGF-β1诱导EMT,CTGF siRNA处理组与阴性对照组比较,CTGF、α-SMA、FN和MMP-2表达均显著下调。此外,外源性CTGF可单独诱导ARPE-19细胞α-SMA表达增加。结论 CTGF能够促进ARPE-19细胞增生,而CTGF RNAi不但能够显著抑制其增生还可显著抑制由划痕实验引发的ARPE-19细胞的迁移。此外,CTGF可通过上调α-SMA表达水平而增强 ARPE-19细胞对于TGF-β1的反应,CTGF RNAi可使TGF-β1诱导的EMT减弱。
[眼科新进展,2014,34(12):1105-1109]
增生性玻璃体视网膜病变(proliferative vitreoretinopathy,PVR)是以视网膜前和视网膜下细胞增生为特征的病理生理过程,是导致孔源性视网膜脱离手术治疗失败最常见的原因[1]。多项研究表明PVR是一种过度的眼内创伤修复反应,视网膜色素上皮(retinal pigment epithelium,RPE)细胞在此过程中发挥关键作用[2-4]。由于受到视网膜脱离、血-视网膜屏障破坏或手术操作的刺激,处于细胞有丝分裂G0期的极化RPE细胞可重新进入细胞增生周期,激活的RPE细胞发生增生,移行至玻璃体内、视网膜前或视网膜下,并在这一过程中释放大量生长因子和细胞因子;同时RPE细胞自身也会发生上皮细胞-间充质细胞转变(epithelial mesenchymal transition,EMT),显示成纤维样细胞形态,合成并分泌细胞外基质(extracellular matrix,ECM),最终形成牵拉性增生膜,这是PVR发展的关键过程[5]。
生长因子是调控包括细胞增生、黏附、迁移和分化等多种生物学行为的多功能信号因子,PVR的发生与多种生长因子的表达变化密切相关[6-7]。转化生长因子β1(transforming growth factor beta 1,TGF-β1)是间质重构的关键因子,在PVR患者的玻璃体及视网膜下液中表达均显著增高,已有研究证实TGF-β1可在体外诱导RPE细胞发生EMT[8-11],其效应蛋白包括α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、基质金属蛋白酶-2(matrix metal protease-2,MMP-2)和纤连蛋白(fibronectin,FN)[12-13]。结缔组织生长因子(connective tissue growth factor,CTGF)作为许多促纤维化刺激因素的共同下游介导因子,在组织创伤修复和纤维化的过程中发挥重要作用,并已被证实表达于PVR的增生膜中[14-15],但对于 CTGF在PVR发生中的具体作用机制,尤其是对于RPE细胞调节作用的研究有限。本实验旨在研究CTGF在RPE细胞的增生、迁移和TGF-β1诱导的EMT中的作用,以期探索PVR发生的病理生理机制。
1 材料与方法
1.1 材料与试剂 ARPE-19细胞购自美国ATCC细胞库;CTGF 购自美国R&D公司;TGF-β1购自美国Cytolab公司;DMEM/F12培养基、胎牛血清、胰蛋白酶购自美国Gibco公司;青霉素和链霉素购自美国Invitrogen公司;二甲基亚砜购自美国Sigma公司;CCK-8细胞计数试剂盒购自日本Dojindo公司;BCA法蛋白质定量试剂盒购自美国Pierce公司;CTGF和FN抗体购自美国Santa Cruz公司;α-SMA抗体购自美国Sigma-Aldrich公司;MMP-2抗体购自美国Abcam公司;GAPDH抗体、辣根过氧化物酶标记的山羊抗小鼠抗体和兔抗山羊抗体购自北京中杉金桥公司。
1.2 方法
1.2.1 细胞培养 将ARPE-19细胞置于含有体积分数10%胎牛血清、100 mg·L-1青霉素和100 mg·L-1链霉素的DMEM/F12培养基中,在恒温37 ℃、含体积分数5%CO2的细胞培养箱中进行培养。
1.2.2 CTGF siRNA的设计与合成及ARPE-19细胞转染 根据RNA干扰序列设计原则,针对人CTGF转录本的特定靶点(靶点序列:GGGCCTCTTCTGTGACTTC)设计短发卡状siRNA(siCTGF)以及非特异性阴性对照siRNA(si NormalControl,siNC),交由上海吉凯基因化学技术有限公司合成并克隆至慢病毒载体颗粒中。转染前1 d将ARPE-19细胞传代至6孔板,转染前更换新鲜培养基,并加入聚凝胺使其终浓度为10 μg·mL-1。按照MOI=20加入相应数量的病毒颗粒,转染后6~8 h更换培养基。病毒转染48 h后,可收集ARPE-19细胞用于后续实验。
1.2.3 细胞增生实验 为测定CTGF对ARPE-19细胞增生的影响,取对数生长期的ARPE-19细胞,以2.5 g·L-1胰蛋白酶消化后计数,以2×103L-1的密度接种于96孔板,每组设3个复孔并设不含细胞的空白培养基组。过夜培养使细胞贴壁生长后,实验组以终浓度400 ng·mL-1CTGF、阴性对照组以400 ng·mL-1二甲基亚砜进行处理,于不同时间点分别加入CCK溶液(每孔10 μL),酶标仪测定培养1 d、2 d、3 d、4 d、5 d、6 d吸光度值评估细胞增生情况(检测波长450 nm,参考波长650 nm)。为检测CTGF RNAi对ARPE-19细胞增生的影响,分别以稳定表达CTGF siRNA和阴性对照siRNA的慢病毒颗粒转染ARPE-19细胞,转染后48 h将ARPE-19细胞接种于96孔板,待细胞贴壁生长后,采用上述方法测定细胞增生情况。所有数据以每组3个复孔的数据平均值±标准差表示,每项实验均重复3次。
1.2.4 细胞划痕实验 将对数生长期APRE-19细胞接种于6孔板中,培养至亚融合状态,实验前更换为含有体积分数0.5%胎牛血清的培养基并培养过夜。用200 μL移液器吸头在孔的中央进行细胞划痕,以1×PBS溶液冲洗2次,冲净刮掉的细胞,继续培养,在0 h、24 h、48 h、72 h分别于相差显微镜下拍照并记录。对照组为正常培养ARPE-19细胞,实验组为CTGF RNAi靶向干扰后ARPE-19细胞。
1.2.5 Western blot检测ARPE-19细胞EMT 为检测CTGF对ARPE-19细胞EMT的影响,分别以0 ng·mL-1、50 ng·mL-1、100 ng·mL-1、200 ng·mL-1CTGF处理ARPE-19细胞,按常规方法收集ARPE-19细胞,以1×SDS裂解细胞,使用BCA 法蛋白质定量试剂盒测定总蛋白浓度后,将提取物进行聚丙烯酰胺凝胶电泳。将电泳分离后的蛋白质转至硝酸纤维素膜上,以含脱脂奶粉的TBST溶液室温下封闭1 h,加入抗α-SMA抗体4 ℃孵育过夜,用1×TBST液冲洗3次,每次10 min;加入辣根过氧化物酶标记的二抗,室温孵育1 h,再用1×TBST液冲洗3次,每次20 min。加入ECL化学发光试剂,然后依次将X光片置于显影液和定影液中显色、照相后,各组以GAPDH作为内参照,采用图像分析系统进行灰度分析。为检测TGF-β1诱导APRE-19细胞EMT的作用,以5 ng·mL-1TGF-β1 处理ARPE-19细胞,按照上述方法采用Western blot在0 h、0.5 h、1 h、3 h、6 h、12 h、24 h分别检测CTGF、FN和α-SMA表达水平。为研究CTGF RNAi对 TGF-β1诱导ARPE-19细胞EMT的作用,用稳定表达CTGF siRNA和阴性对照siRNA的慢病毒颗粒转染ARPE-19细胞,以5 ng·mL-1TGF-β1 处理转染成功后细胞,按照上述方法采用Western blot分别检测CTGF、FN、MMP2和α-SMA表达水平。
2 结果
2.1 外源性CTGF促进APRE-19细胞增生的作用如图 1A所示,以400 ng·mL-1CTGF处理的 APRE-19细胞与未接受CTGF处理的细胞倍增时间存在显著差异(P<0.05),并且此差异随着培养时间延长而逐渐扩大。在培养6 d时这一差异最为明显,可以看到经400 ng·mL-1CTGF处理的 APRE-19细胞数量接近于对照组的2倍,这表明外源性CTGF能够促进APRE-19细胞增生。
2.2 CTGF在维持APRE-19细胞正常增生中的作用 如图1B所示,CTGF siRNA组与阴性对照siRNA组的细胞倍增时间存在显著差异(P<0.05),并且此差异随着培养时间延长而逐渐扩大。在培养6 d时这一差异最为明显,阴性对照siRNA处理组的APRE-19细胞数量大于CTGF siRNA处理组。表明内源性CTGF表达沉默可抑制APRE-19细胞增生,CTGF是APRE-19细胞正常增生所必需的细胞因子。
2.3 细胞划痕实验 如图2所示,对照组修复划痕的时间(≤48 h)显著少于实验组(≥72 h),说明对照组细胞移行愈合率高于实验组,表明CTGF是ARPE-19细胞迁移所必需的细胞因子之一。
2.4 CTGF RNAi对TGF-β1诱导的APRE-19细胞EMT的作用 如图3所示,ARPE-19细胞对于TGF-β1刺激能诱发良好的EMT反应,效应蛋白α-SMA和FN的表达均随时间延长逐渐上调,同时TGF-β1刺激细胞后可使CTGF表达上调。如图3所示,当CTGF RNAi靶向干扰ARPE-19细胞后,以TGF-β1诱导EMT,CTGF siRNA处理组与阴性对照组比较,CTGF、α-SMA、FN和MMP-2表达均显著下调,表明其EMT受到抑制。此外,外源性CTGF在没有TGF-β1刺激的情况下也能够单独诱导α-SMA表达增加(图 3),表明CTGF是调控α-SMA表达的上游因子之一。尽管CTGF 独立于TGF-β1 的作用仍待研究,这些实验结果表明CTGF可通过调节下游效应蛋白α-SMA的表达,在TGF-β1诱导APRE-19细胞EMT这一信号通路中发挥关键调控作用。
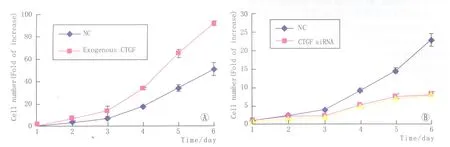
Figure 1 Proliferation of APRE-19 cells treated with exogenous CTGF or CTGF siRNA.A:Effects of exogenous CTGF on the proliferation of ARPE-19 cells;B:Effects of CTGF siRNA on the proliferation of ARPE-19 cells 外源性CTGF和CTGF siRNA对ARPE-19细胞增生的作用。A:外源性CTGF对ARPE-19细胞增生的作用;B:CTGF siRNA对ARPE-19细胞增生的作用

Figure 2 Migration of ARPE-19 cells treated with CTGF siRNA in wound healing response CTGF siRNA对ARPE-19细胞移行的作用,虚线所示为细胞划痕边缘
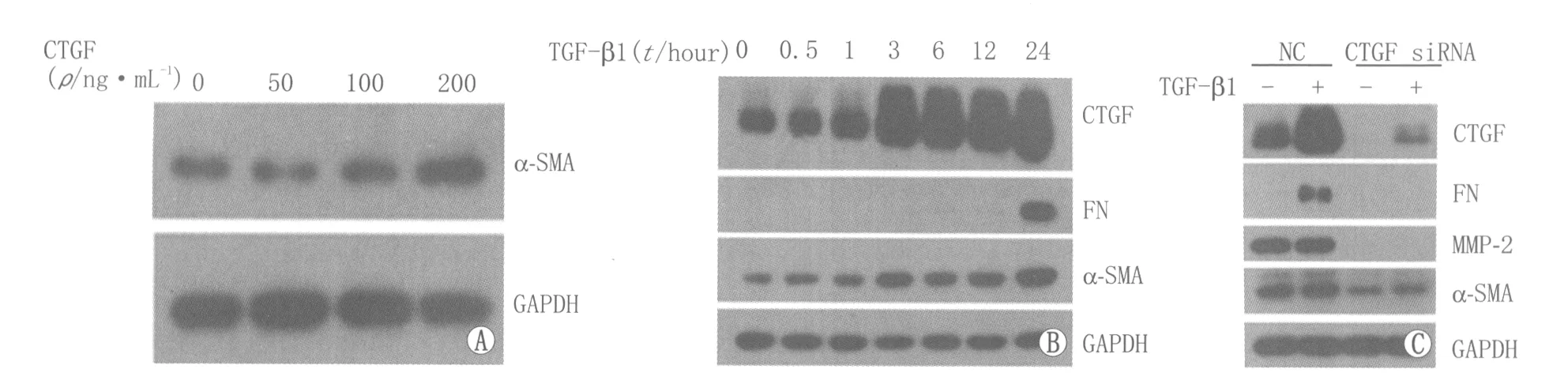
Figure 3 Response of ARPE-19 cells to TGF-β1 induced EMT.A:Exogenous CTGF induced the increase of α-SMA;B:ARPE-19 cells were responsive to EMT stimulation conferred by TGF-β1;C:Effects of CTGF siRNA on the response of ARPE-19 cells to TGF-β1-induced EMT ARPE-19细胞对于TGF-β1诱导 EMT的反应。A:外源性CTGF使α-SMA 表达上调;B:TGF-β1刺激ARPE-19细胞EMT;C:CTGF siRNA对TGF-β1刺激ARPE-19细胞EMT的作用
3 讨论
视网膜下液和视网膜玻璃体牵拉形成是PVR发展过程中的两个重要里程碑[16]。在这一过程中,RPE细胞层暴露于玻璃体生长因子和细胞因子,进而发生增生、迁移和EMT,失去细胞极性和细胞间连接,继而移行到玻璃体内并构成牵拉性纤维膜的主要成分[2]。因此,研究生长因子和细胞因子对于RPE细胞的作用是探索PVR病理生理机制的关键。CTGF,也被称作CCN2,属于即刻早期基因CCN家族[17]。在一些眼部纤维化相关疾病如增生性糖尿病视网膜病变、PVR、黄斑前膜和黄斑裂孔中,已证实玻璃体内CTGF浓度与纤维化的产生和发展程度高度相关[18]。进一步的临床研究、动物模型研究和体外细胞研究均表明,CTGF是病理性玻璃体纤维膜形成的重要因素[14-15,19]。
眼部纤维性损伤时CTGF表达水平会显著上升[20],其来源有:局部细胞合成和(或)由于血-视网膜屏障破坏导致的血清渗漏。为了研究以上两个来源的CTGF的作用,我们采用CTGF RNAi沉默CTGF表达或采用外源性CTGF处理ARPE-19细胞,发现CTGF RNAi可以显著抑制ARPE-19细胞的增生和迁移(图1-图2),同时外源性CTGF可促进ARPE-19细胞增生(图 1A)。这些结果表明RPE细胞内可能存在维持对于生长刺激反应的CTGF阈值。
在正常生理情况下,与相邻的神经视网膜的连接使成熟RPE细胞保持静止状态[21],CTGF也相应处于低水平,与CTGF RNAi细胞中观察到的情况类似(图1B)。在PVR早期,视网膜脱离和局部损伤引起RPE细胞增生,同时可能通过局部细胞间连接破坏进而破坏了CTGF表达抑制[14]。在这一阶段,局部自分泌和(或)旁分泌CTGF是激活RPE细胞增生的先决条件。在PVR晚期阶段随着玻璃体液的进一步聚集,RPE细胞将暴露于更高浓度CTGF并进入快速增生阶段,与我们使用外源性CTGF处理后的细胞情况相似(图1A)。可见CTGF不仅是RPE细胞重新进入细胞增生周期所必需的细胞因子,同时也是维持其增生所必需的。
已有研究表明,CCN2基因敲除可以使FN和TGF-β1诱导的鼠胚胎成纤维细胞(mouse embryonic fibroblasts,MEF)的细胞黏附信号通路激活受到抑制,并且CCN2+/+MEF的细胞迁移能力高于CCN2-/-MEF[22],表明CTGF/CCN2在细胞黏附和迁移中发挥重要作用,这一研究结果也在胚胎发育、创伤愈合、组织修复和纤维增生等研究中被证实[23-25]。对于PVR来说,孔源性视网膜脱离后RPE细胞暴露于玻璃体液,RPE细胞失去细胞间连接可使细胞增生和迁移被激活,并向成纤维样细胞转化[26]。α-SMA是最常用的活化成纤维细胞的标记物,我们观察到外源性CTGF能够单独诱导ARPE-19细胞α-SMA 表达上调(图3A),而由TGF-β1诱导的α-SMA 表达上调可被CTGF RNAi所抑制,表明CTGF 在TGF-β1诱导的APRE-19细胞EMT信号通路中发挥关键作用。已有研究证实存在很多TGF-β1非依赖性CTGF/CCN2活动通路,在体外CCN蛋白可通过直接结合ECM成分和细胞表面来促进上皮细胞生长、迁移和黏附[27],这可能是外源性CTGF能够单独诱导ARPE-19细胞α-SMA 表达上调的原因。FN是促进TGF-β1诱导EMT的关键ECM成分,CTGF RNAi使ARPE-19细胞FN表达下降;MMP2是TGF-β1诱导ECM重塑的信号通路中的另一个效应蛋白,能降解明胶、VI型胶原、V型胶原和弹性蛋白等ECM,参与调节细胞移行和ECM重塑,CTGF RNAi靶向干扰后也发生表达下降,这进一步加强了对ARPE-19细胞增生和EMT的抑制。这些结果进一步表明CTGF是ARPE-19细胞迁移和EMT的关键调控因子,在PVR牵拉性纤维增生膜的形成中发挥重要作用。此外,TGF-β1刺激细胞后可使CTGF表达上调,这与先前研究认为CTGF是TGF-β1信号通路下游因子的结论相符[28]。
综上所述,本研究对CTGF在体外ARPE-19细胞的增生、迁移和EMT中的作用进行了初步探索,为了更好地阐明PVR的病理生理机制,还需要在动物模型中对CTGF的作用、功能及调控机制作进一步研究。
1 Garweg JG,Tappeiner C,Halberstadt M.Pathophysiology of proliferativevitreoretinopathy in retinal detachment[J].SurvOphthalmol,2013,58(4):321-329.
2 Kim IK,Arroyo JG.Mechanisms in proliferative vitreoretinopathy[J].OphthalmolClinNorthAm,2002,15(1):81-86.
3 Krivosheina OI,Zapuskalov IV.Onset and progression of proliferative vitreoretinopathy as viewed from the system approach[J].VestnOftalmol,2004,120(4):44-46.
4 Telander DG,Morales SA,Mareninov S,Forward K,Gordon LK.Epithelial membrane protein-2(EMP2)and experimental proliferative vitreoretinopathy(PVR)[J].CurrEyeRes,2011,36(6):546-552.
5 赵红梅,于靖,盛敏杰,陈铁卉.胰岛素样生长因子结合蛋白-6对RPE细胞增殖和迁移的影响[J].眼科新进展,2012,32(3):208-210.
6 Lei H,Velez G,Hovland P,Hirose T,Gilbertson D,Kazlauskas A.Growth factors outside the PDGF family drive experimental PVR[J].InvestOphthalmolVisSci,2009,50(7):3394-3403.
7 Weller M,Wiedemann P,Heimann K.Proliferative vitreoretinopathy--is it anything more than wound healing at the wrong place[J] ?IntOphthalmol,1990,14(2):105-117.
8 Li H,Wang H,Wang F,Gu Q,Xu X.Snail involves in the transforming growth factor β1-mediated epithelial-mesenchymal transition of retinal pigment epithelial cells[J].PLoSOne,2011,6(8):e23322.
9 Lee SC,Kwon OW,Seong GJ,Kim SH,Ahn JE,Kay ED.Epitheliomesenchymal transdifferentiation of cultured RPE cells[J].OphthalmicRes,2001,33(2):80-86.
10 Bochaton-Piallat ML,Kapetanios AD,Donati G,Redard M,Gabbiani G,Pournaras CJ.TGF-beta1,TGF-beta receptor II and ED-A fibronectin expression in myofibroblast of vitreoretinopathy[J].InvestOphthalmolVisSci,2000,41(8):2336-2342.
11 Hoerster R,Muether PS,Vierkotten S,Hermann MM,Kirchhof B,Fauser S.Upregulation of TGF-β1 in experimental proliferative vitreoretinopathy is accompanied by epithelial to mesenchymal transition[J].GraefesArchClinExpOphthalmol,2014,252(1):11-16.
12 Wehrle-Haller B,Imhof BA.Actin,microtubules and focal adhesion dynamics during cell migration[J].IntJBiochemCellBiol,2003,35(1):39-50.
13 Zeisberg M,Neilson EG.Biomarkers for epithelial-mesenchymal transitions[J].JClinInvest,2009,119(6):1429-1437.
14 Cui JZ,Chiu A,Maberley D,Ma P,Samad A,Matsubara JA.Stage specificity of novel growth factor expression during development of proliferative vitreoretinopathy[J].Eye(Lond),2007,21(2):200-208.
15 Hinton DR,He S,Jin ML,Barron E,Ryan SJ.Novel growth factors involved in the pathogenesis of proliferative vitreoretinopathy[J].Eye(Lond),2002,16(4):422-428.
16 Nagasaki H,Shinagawa K.Risk factors for proliferative vitreoretinopathy[J].CurrOpinOphthalmol,1995,6(3):70-75.
17 Holbourn KP,Acharya KR,Perbal B.The CCN family of proteins:structure-function relationships[J].TrendsBiochemSci,2008,33(10):461-473.
18 Kuiper EJ,de Smet MD,van Meurs JC,Tan HS,Tanck MW,Oliver N,etal.Association of connective tissue growth factor with fibrosis in vitreoretinal disorders in the human eye[J].ArchOphthalmol,2006,124(10):1457-1462.
19 Burns WC,Twigg SM,Forbes JM,Pete J,Tikellis C,Thallas-Bonke V,etal.Connective tissue growth factor plays an important role in advanced glycation end product-induced tubular epithelial-to-mesenchymal transition:implications for diabetic renal disease[J].JAmSocNephrol,2006,17(9):2484-2494.
20 Lee EH,Joo CK.Role of transforming growth factor-beta in transdifferentiation and fibrosis of lens epithelial cells[J].InvestOphthalmolVisSci,1999,40(9):2025-2032.
21 Adams T,Shahabi G,Hoh-Kam J,Jeffery G.Held under arrest:Many mature albino RPE cells display polyploidal features consistent with abnormal cell cycle retention[J].ExpEyeRes,2010,90(2):368-372.
22 Kennedy L,Liu S,Shi-Wen X,Chen Y,Eastwood M,Sabetkar M,etal.CCN2 is necessary for the function of mouse embryonic fibroblasts[J].ExpCellRes,2007,313(5):952-964.
23 Ivkovic S,Yoon BS,Popoff SN,Safadi FF,Libuda DE,Stephenson RC,etal.Connective tissue growth factor coordinates chondrogenesis and angiogenesis during skeletal development[J].Development,2003,130(12):2779-2791.
24 Kisseleva T,Brenner DA.Mechanisms of fibrogenesis[J].ExpBiolMed(Maywood),2008,233(2):109-122.
25 Leask A,Abraham DJ.The role of connective tissue growth factor,a multifunctional matricellular protein,in fibroblast biology[J].BiochemCellBiol,2003,81(6):355-363.
26 Han QH,Hui YN,Du HJ,Zhang WJ,Ma JX,Wang SY.Migration of retinal pigment epithelial cellsinvitromodulated by monocyte chemotactic protein-1:enhancement and inhibition[J].GraefesArchClinExpOphthalmol,2001,239(7):531-538.
27 Rachfal AW,Brigstock DR.Connective tissue growth factor(CTGF/CCN2)in hepatic fibrosis[J].HepatolRes,2003,26(1):1-9.
28 Abreu JG,Ketpura NI,Reversade B,De Robertis EM.Connective-tissue growth factor(CTGF)modulates cell signalling by BMP and TGF-beta[J].NatCellBiol,2002,4(8):599-604.
date:Jul 4,2014
Accepted date:Sep 5,2014Foundation item:Fund for General Program of National Natural Science Foundation of China(No:30772374)From theDepartmentofOphthalmology,PekingUnionMedicalCollegeHospital,ChineseAcademyofMedicalScience,Beijing100730,China
Responsible author:CHEN You-Xin,E-mail:chenyouxinpumch@163.com
Roles of connective tissue growth factor in proliferation,migration and epithelial-mesenchymal transition of human retinal pigment epithelial cells
TIAN Rong,YU Ying,CHEN You-Xin
connective tissue growth factor;retinal pigment epithelial cells;proliferation;migration;epithelial-mesenchymal transition;proliferative vitreoretinopathy
Objective To explore the roles of connective tissue growth factor (CTGF)in the proliferation,migration and epithelial-mesenchymal transition (EMT)of human retinal pigment epithelial (RPE)cells.Methods Cell proliferation of ARPE-19 cells treated with 400 ng·mL-1CTGF and ARPE-19 cells stably expressing CTGF siRNA or control siRNA were measured with a CCK-8 cell counting kit.A scratch wound healing assay was performed to evaluate the effect of CTGF RNAi on the migration of ARPE-19 cells.Meanwhile,the levels of CTGF,fibronectin (FN),matrix metal protease-2 (MMP-2),and α-smooth muscle actin (α-SMA)in ARPE-19 cells stably expressing CTGF siRNA or control siRNA were determined to assess the role of CTGF in TGF-β1 induced EMT.Results There was a significant difference in the increase fold of cell numbers between ARPE-19 cells with and without CTGF treatment,and between ARPE-19 cells treated with CTGF siRNA or control siRNA (allP<0.05).The speed of recovering the scratch in ARPE-19 control cells (≤48 hours)was higher than that in cells treated with CTGF siRNA (≥72 hours).Compared with ARPE-19 cells treated by control siRNA,the EMT induced by TGF-β1 was inhibited in cells treated with CTGF siRNA,represented by the significant down regulation of CTGF,α-SMA,FN,and MMP-2.In addition,exogenous CTGF could induce the expression of α-SMA without TGF-β1 signal in ARPE-19 cells.Conclusion CTGF can promote the proliferation of ARPE-19 cells,while CTGF RNAi significantly inhibit not only the proliferation but also the wound-healing induced migration of ARPE-19 cells.In addition,the responses of ARPE-19 cells to TGF-β1 are enhanced by CTGF by elevating the level of α-SMA,while CTGF RNAi neutralize the effects of TGF-β1 on ARPE-19 cells to induce EMT.
田蓉,于颖,陈有信.结缔组织生长因子在人视网膜色素上皮细胞的增生、迁移和上皮细胞-间充质细胞转变中的作用[J].眼科新进展,2014,34(12):1105-1109.
10.13389/j.cnki.rao.2014.0307
田蓉,女,1987年4月出生,山西太原人,博士,主要从事眼底病相关研究。联系电话:010-69156354(O);E-mail:tianrong870411@163.com
About TIAN Rong:Female,born in April,1987.Doctor degree.Tel:+86-10-69156354(O);E-mail:tianrong870411@163.com
2014-07-04
修回日期:2014-09-05
本文编辑:付中静
国家自然科学基金面上项目基金资助(编号:30772374)
100730 北京市,中国医学科学院北京协和医院眼科
陈有信,E-mail:chenyouxinpumch@163.com
[Rec Adv Ophthalmol,2014,34(12):1105-1109]

