液相芯片检测高湿环境对大鼠T淋巴细胞因子表达的影响
宋富强,郭文琼,李 昆,杨 芸,郭 鑫,李 薇,呼永河
·论著·
液相芯片检测高湿环境对大鼠T淋巴细胞因子表达的影响
宋富强,郭文琼,李 昆,杨 芸,郭 鑫,李 薇,呼永河
目的 液相芯片技术检测大鼠血清中细胞因子的表达,探讨高湿环境对大鼠细胞因子的影响。方法 32只SD大鼠随机分为两组,高湿组与正常组,每组16只大鼠。采用人工气候箱模拟高湿环境,条件设置为温度25 ℃、相对湿度90%~95%。高湿组大鼠每天置于箱中10 h,其余时间与正常组一样饲养于常温常湿的清洁环境(温度25 ℃,相对湿度45%~50%),连续20 d。动物模型制作完成后,取大鼠腹主动脉血,分离血清,应用Luminex200检测9种细胞因子的表达。结果 与正常组比较,高湿组IL-1α、IL-1β、IL-2、IL-6、IL-10血清水平显著升高(P<0.05或P<0.01),IFNγ明显下降(P<0.01),TNFα、EGF、VEGF血清水平变化不明显(P>0.05)。结论 高湿可引起大鼠血清细胞因子的改变,Th1/Th2类细胞因子平衡被打破,使大鼠的免疫自稳状态发生变化。
高湿;细胞因子;液相芯片;大鼠
高湿作为一种特殊的环境气候条件,对机体可产生多方面的影响,诱发机体产生多种病理生理的改变[1-2]。细胞因子(cytokine)主要作为细胞间信号传递分子,介导和调节免疫应答及炎症反应等,但高湿对机体血清细胞因子表达的影响少有报道。近年研究发现,Th1类和Th2类淋巴细胞的平衡在细胞因子网络中具有重要作用,可作为反映机体免疫功能的重要指标[3-4]。只有当Th1/Th2类淋巴细胞达到相对平衡,才能维持机体正常的免疫状态和正常生理活动。液相芯片技术是集流式细胞、激光、数字信号处理及传统化学技术为一体的新型生物分子检测技术,最大特点是通量大、灵活性好[5]。本课题应用液相芯片技术,就高湿环境对大鼠血清细胞因子的影响做一初步研究,为研究高湿对机体功能影响的指标寻找实验基础。
1 材料与方法
1.1 实验动物 32只3~4月龄清洁级健康雄性SD大鼠,由成都达硕生物科技有限公司提供,实验动物许可证号:scxk(川)2008-24,体重(180±10)g,饲养于清洁环境。
1.2 仪器及试剂 RXZ-1000A-zl多段编程人工气候箱(宁波江南仪器厂), Sorvell ST16R台式冷冻离心机,SANYO MDF-U53V -80 ℃低温冰箱,细胞因子检测试剂盒(RECYTMAG-65K Kit,Millipore公司),Luminex200液相芯片分析系统(美国Luminex公司)。
1.3 动物模型制作 32只SD大鼠随机分为两组,高湿组与正常组,每组16只大鼠。采用人工气候箱模拟高湿环境,条件设置为温度25 ℃、相对湿度90%~95%,高湿组大鼠每天置于箱中10 h,其余时间与常温常湿正常组一样饲养于清洁环境(温度25 ℃,相对湿度45%~50%),连续处理20 d。
1.4 标本收集和检测 高湿模型建立后,乙醚麻醉,取大鼠腹主动脉血2 ml,离心(3000 r/min,10 min)分离血清,分装后-80 ℃保存待测。每个样品取25 μl,采用Luminex200液相芯片系统测定各组血清样本中9种细胞因子,分别为IL-1α、IL-1β、IL-2、IL-6、IL-10、VEGF、EGF、IFNα、IFN-γ。
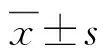
2 结果
从表1可见,与正常组比较,高湿组IL-1α、IL-1β、IL-2、IL-6、IL-10血清水平显著升高(P<0.05或P<0.01),IFNγ明显下降(P<0.01),而TNFα、EGF、VEGF血清水平变化不明显(P>0.05)。
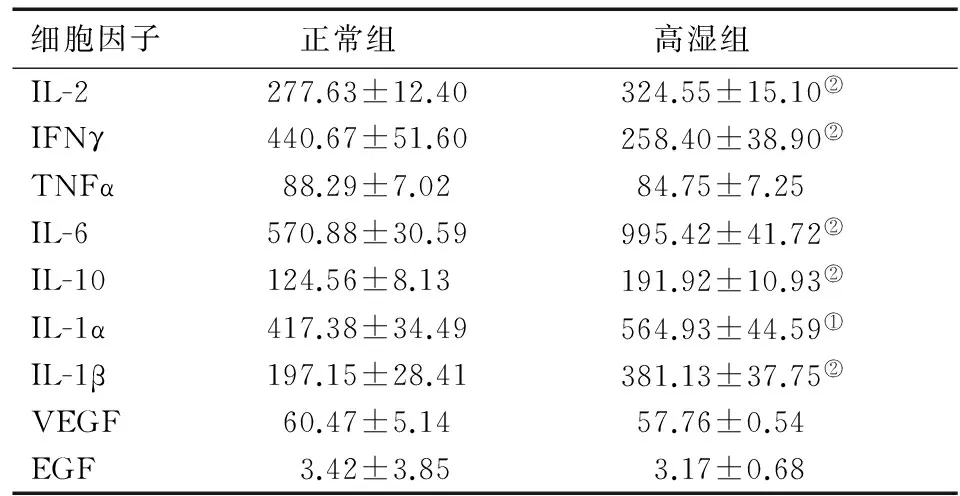
表1 两组细胞因子的比较(n=16)
注:与正常组比较,①P<0.05,②P<0.01
3 讨论
液相芯片技术与现有的临床诊断方法比较具有明显的优势,如样本用量少、特异性敏感性强、高通量等。目前该技术在临床和科研上得到推广[6],尤其在检测细胞因子方面应用广泛,成为多因子分析研究的趋势[7]。本实验应用该技术探讨了高湿对大鼠血清细胞因子表达的影响,结果重复性好,灵敏度高,为下一步趋化因子的研究打下基础。
根据所产生的细胞因子的功能不同,辅助性T淋巴细胞(TH)可分为Th1和Th2细胞。Th1细胞产生IL-2、IFN-γ、TNF-α等细胞因子,主要介导细胞免疫应答,增强宿主对病毒与胞内病原体感染的免疫性和防御功能;Th2细胞产生IL-6、IL-10、IL-4等,主要功能为介导体液免疫应答和促进B细胞发育,与感染的进展、持续性和慢性化有关。正常状态下,机体中的Th1/Th2细胞处于相对平衡的状态,一旦Th1/Th2 之间的平衡状态被打破,很可能造成人体细胞因子网络的动态平衡被破坏,进而引起许多疾病的产生和发展[8]。本实验结果发现,高湿组IL-6、IL-10显著升高,而Th1类细胞因子除IL-2显著升高与IFN-γ降低外,TNF-α没有明显变化,提示在高湿环境下,Th2类细胞因子免疫反应较强,而Th1类细胞因子免疫反应较弱,两者的平衡出现变化,造成机体免疫自平衡失调,这与Carlini等[9]的研究结果一致。他们通过研究大鼠IL-2、IL-8水平变化探讨湿邪致病与细胞免疫功能的关系,发现外湿组的IL-2和IL-8水平较常温常湿组显著升高,提示外湿与机体的免疫激活和炎症反应密切有关。以上结果说明高湿对大鼠的免疫功能有一定影响,可导致大鼠免疫功能紊乱,Th1/Th2可以做为探讨高湿对大鼠免疫功能影响的检测指标之一。
IL-1是体内炎性级联反应的始动因子,IL-1产生后可上调E-选择素和细胞间黏附分子-1(intracelluar adhension molecule-1)等黏附分子的表达水平,使中性粒细胞浸润量急剧增加,后者又通过释放细胞毒性产物、氧自由基以及阻塞微血管等机制而导致细胞损伤、凋亡。本实验发现,高湿处理大鼠后体内的IL-1α、IL-1β均出现显著升高,提示高湿可导致大鼠易感染性,进而产生炎性疾病,如类风湿性关节炎等[10]。而IL-10做为一种多潜能炎症抑制因子,在正常状态中低表达,高湿环境可诱导IL-10表达升高,可能是由于大鼠体内自身的免疫抵抗能力所致,为抵抗高湿对机体产生一定的炎性反应起到保护作用。另外表皮生长因子(EGF)和血管内皮生长因子(VEGF)在本实验中没有观察到显著性的变化,初步说明高湿对大鼠体内的生长因子的表达影响较小,也有可能是本实验样本量不够大、高湿作用时间不够长所致。
综上所述,高湿环境可引起大鼠血清细胞因子的改变,Th1/Th2平衡被打破,使大鼠的免疫自稳状态发生变化,炎症因子IL-1、IL-6显著升高,大鼠易被感染,对生长因子类细胞因子影响不明显。下一步本课题将加大样本量和高湿作用时间,同时研究高湿对大鼠血清中相关趋化因子表达的影响,进一步说明高湿对机体细胞因子网络的影响。
[1] 陈刚,张六通.外湿模型大鼠胃肠激素变化的研究[J].中国现代医生,2007,45(10):87-88.
[2] 章敏,陈刚,张六通,等.外湿模型大鼠肠道菌群及其黏附性研究[J].中医研究,2007,20(9):9-11.
[3] Postal M,Peliçari KO,Sinicato NA,et al.Th1/Th2 cytokine profile in childhood-onset systemic lupus erythematosus[J].Cytokine,2013,61(3):785-791.
[5] 谢冲,王国民.Luminex液相芯片的发展及应用[J].复旦学报,2010,37(2):241-244.
[6] 张保强,张晓.Luminex液态芯片在临床及科研中的应用[J].当代医学,2012,18(4):18-20.
[7] Djoba Siawaya JF,Roberts T,Babb C,et al.An evaluation of commercial fluorescent bead-based luminex cytokine assays[J].PLoS One,2008,3(7):e2535.
[8] 姚金晶,陈宜涛.Th1/Th2平衡调节与疾病发生的研究进展[J].现代生物医学进展,2009,9(13):2597-2600.
[9] Carlini Fan Hardi,张诗军.基于IL-2、IL-8水平变化的湿邪致病机理研究[J].中国中医药咨讯,2010,2(1):10-11.
[10] 刘健,万磊,盛长健,等.佐剂性关节炎大鼠肺功能变化与Th1/Th2细胞、调节性T细胞的相关性研究[J].细胞与分子免疫学杂志,2011,27(1):56-60.
Liquid phase chip inspection of the effects of humidity environment on the expression of T lymphocyte in rats
Song Fuqiang1,Guo Wenqiong2,Li Kun1,Yang Yun1,Guo Xin1,Li Wei1,Hu Yonghe1
1.Central Lab,General Hospital of Chengdu Military Command,Chengdu,Sichuan,610083,China;2.School of Nursing,Chengdu Medical College,Chengdu,Sichuan,610083,China
Objective To detect the expression of T lymphocyte in rats' blood serum by liquid phase chip technology,and to discuss the influence of high humidity environment on rats' body functions.Methods Thirty two SD rats were randomly divided into high humidity and normal groups with 16 ones in each group.Climatic cabinet was used to simulate the high humidity environment.The temperature was 25 ℃,and the relative humidity was 90%-95% RH.The rats of the high humidity group were placed in the cabinet for 10 h everyday.In the rest of the day,they were feed in the same clean environment as the normal group with common temperature and humidity(temperature of 25 ℃ and relative humidity of 45%-50% RH)continuously for 20 days.After the establishment of the animal model,the blood samples were obtained from the abdominal aorta of the rats in order to isolate the serum.Luminex200 system was used to detect the expression of nine cytokines.Results Compared with the indexes of the normal group,the levels of serum IL-1α,IL-1β,IL-2,IL-6,and IL-10 in the high humidity group significantly increased(P<0.05 orP<0.01);FNγ obviously decreased(P<0.01);the TNFα,EGF,and VEGF did not change significantly(P>0.05).Conclusion High humidity can change the expression of serum cytokines in rats.The Th1/Th2 cytokine balance is broken,which results in the changes of the rats' immune homeostasis status.
high humidity;cytokine;liquid phase chip;rat
全军医学科技“十二五”重点项目(BWS11J067)
610083 成都,成都军区总医院中心实验室(宋富强,李 昆,杨 芸,郭 鑫,李 薇,呼永河);成都医学院护理学院(郭文琼)
呼永河,电话:028-86570206;E-mail:huyonghe@vip.126.com
R 229
A
1004-0188(2014)01-0001-03
10.3969/j.issn.1004-0188.2014.01.001
2013-11-21)

