高海拔地区FISH法检测乳腺癌HER2基因的方法改进
潘鑫艳,蔡 琳,黎贵芸,杨长绍,杨举伦,王 丽
高海拔地区FISH法检测乳腺癌HER2基因的方法改进
潘鑫艳,蔡 琳,黎贵芸,杨长绍,杨举伦,王 丽
目的 在高海拔地区改良并简化乳腺癌HER2 FISH法检测的预处理步骤,节省实验时间,扩大FISH检测试剂盒的临床应用。方法 以10例HER2免疫组化染色结果为++以上的乳腺癌标本为研究对象,采用美国PanPath公司的HER2 FISH检测试剂盒,将其中的预处理步骤改良为高压煮沸处理,比较常规法与改良法对HER2基因扩增结果的影响。结果 两种方法检测乳腺癌HER2基因的阳性率无统计学差异,并且均能使细胞间质完全消化,细胞或重叠或孤立,细胞核中红绿信号清晰。结论 改良FISH法可以替代常规预处理步骤,简化了步骤,节省了时间,扩大了FISH检测试剂盒的临床应用。
乳腺癌;FISH技术;HER2基因
乳腺癌是女性常见的恶性肿瘤之一,发病率呈逐年上升的趋势,在我国有些城市已跃居女性恶性肿瘤的第一位[1]。人表皮生长因子受体-2(HER2)在乳腺癌患者的高水平表达,对临床治疗方案的选择有指导作用,尤其是针对单克隆抗体赫塞汀(Herceptin)的临床应用[2]。目前,应用FISH技术检测乳腺癌患者HER2基因扩增是美国FDA承认的能进行Herceptin治疗的金标准[3]。
FISH法检测步骤中,加探针之前的石蜡切片消化处理较繁琐,处理时间过长,若能采用改良FISH法,简化对切片进行处理的繁琐步骤,达到不影响FISH结果的判读,又能得到省时、省力、省试剂的效果,必将会促进FISH检测在临床的应用。本研究采用常规FISH法和改良FISH法对10例浸润性乳腺癌HER2基因进行FISH检测,比较这两种方法检测HER2基因的阳性率以及红绿信号强度、结果判读之间的差异。
1 材料与方法
1.1 验地气候条件 本实验在海拔1890 m、大气压80.6 kPa、水的沸点为93.4 ℃的昆明地区进行。
1.2 材料与设备 选取本科2012~2013年的浸润性乳腺癌免疫组化HER2染色阳性++以上的石蜡组织标本10例,连续4 μm切片2张,于60 ℃烤2~4 h,室温保存。美国PanPath公司生产的FISH检测试剂盒,购自北京中杉公司。Olympus BX51显微镜。
1.3 标本处理
1.3.1 常规FISH法 参照PanPath HER2试剂盒说明书进行:(1)脱蜡至无水酒精2次,甲醇孵育5 min,空气干燥。(2)预处理:①0.003%~85%甲酸溶液室温孵育20 min后,0.01M HCl清洗3 min;②70%、90%、100%酒精连续酸性系列脱水后空气干燥10 min;③80 ℃预热的处理液NaSCN中孵育10 min,0.01M HCl清洗3 min,重复步骤②;④37 ℃预热的酸性蛋白水解酶工作液孵育8 min,0.01M HCl清洗3 min,重复步骤②;⑤Post-fix solution室温孵育15 min;⑥PBS室温漂洗15 min;(3)去离子水漂洗5 min;(4)70%、90%、100%酒精中性脱水后空气干燥。(5)探针变性杂交:加探针,80 ℃变性5 min,37 ℃杂交过夜(16 h 以上)。(6)洗涤及漂洗:PBS中去除盖玻片,PanWash3洗涤及PBS漂洗,梯度酒精脱水,避光干燥10 min,在每张切片上滴加10 μl 二脒基苯基吲哚(DAPI),盖上盖玻片;避光放置15 min,镜下观察。
1.3.2 改良FISH法 将上述“(2)预处理”改为高压煮沸,并对高压煮沸的时间进行摸索,分别设为4、6、8 min。具体步骤如下:(1)脱蜡至无水酒精,空气干燥。(2)去离子水中高压煮沸:高压锅大量喷气时开始计时4~8 min,室温晾干;37 ℃预热的酸性蛋白水解酶工作液孵育8 min;(3)去离子水漂洗5 min;(4)70%、90%、100%酒精中性脱水后空气干燥。后续步骤同常规FISH法。
1.4 观察指标及判断标准 细胞消化:细胞间质消化彻底,可见清晰、重叠或孤立的细胞核,细胞间质几乎不存在;细胞间质消化不足时,可见细胞间质存在,细胞核之间无明显界限;细胞间质消化过度,细胞间质完全不存在,细胞核呈空洞现象。
结果判读:同一显微镜100×物镜下随机计数20个乳腺癌细胞核中的双色信号:(1)若HER2基因扩增(红色信号)与17号染色体信号(绿色信号)的比值<1.8,提示HER2基因无扩增;(2)若该比值>2.0,提示HER2基因阳性扩增;(3)若比值为1.8~2.0,则需要再计算20个细胞核中的信号或由另一个分析者重新计数,如仍为临界值,则应直接注明或重复进行FISH检测;(4)若红色信号成簇,两个绿色信号,提示HER2基因阳性并成簇扩增,其中17号染色体为二倍体;(5)若红色信号成簇,多个绿色信号,提示HER2基因阳性并成簇扩增,其中17号染色体为多倍体。
2 结果
乳腺癌细胞核DAPI染成蓝色,红色荧光为HER2基因,17号染色体着丝粒序列标记绿色荧光。
2.1 常规FISH法检测乳腺癌HER2扩增结果(图1) 10例标本中,7例发生HER2基因扩增,阳性率为70%。可见细胞间质消化彻底,容易计数单个细胞及其红绿信号,但预处理步骤需要4~5 h完成。
2.2 改良FISH法检测乳腺癌HER2扩增结果(图2)
2.2.1 不同高压时间对组织消化的影响 高压锅大量喷气时开始计时,若高压煮沸时间为4 min时,细胞间质消化不完全(图2a);高压煮沸时间为6 min时,细胞间质消化彻底(图2b);高压煮沸时间为8 min,细胞间质消化过度(图2c)。
2.2.2 改良FISH法检测乳腺癌HER2扩增结果(图3) 用改良法(将预处理步骤改为高压煮沸6 min)检测上述10例标本,结果显示:7例标本发生HER2基因扩增,阳性率为70%,并且该7例标本与常规FISH法的阳性标本一致,处理过程只需要1.5 h,大大缩短了实验时间,节省了试剂。
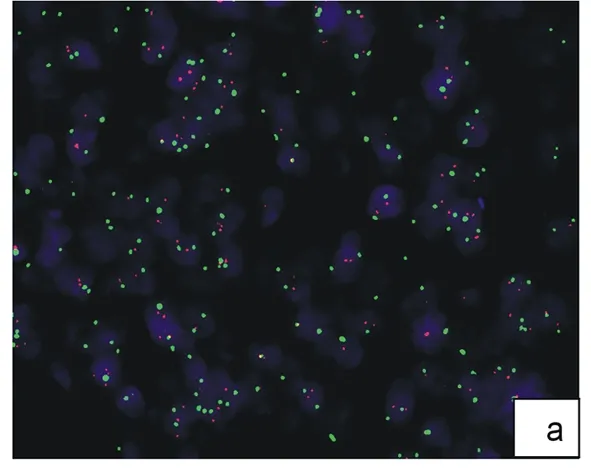

图1 乳腺癌HER2基因FISH常规法检测结果
a:17号染色体为2倍体,HER2基因无扩增;b:17号染色体为2倍体,HER2基因扩增
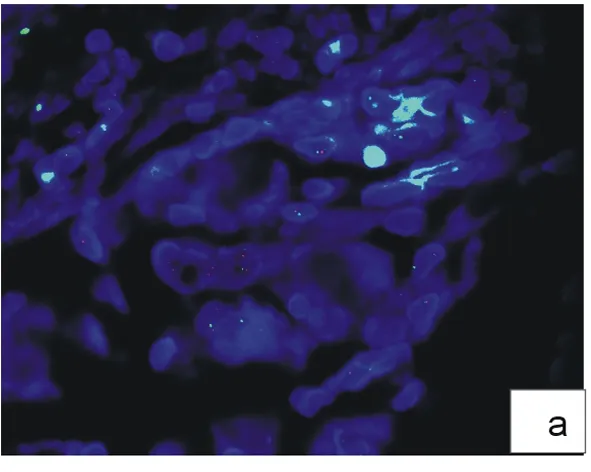

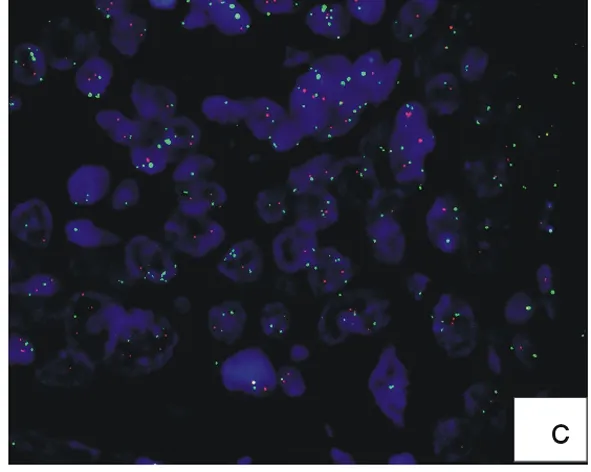
图2 不同高压煮沸时间检测结果
a:细胞间质消化不完全;b:细胞间质消化彻底;c:细胞消化过度
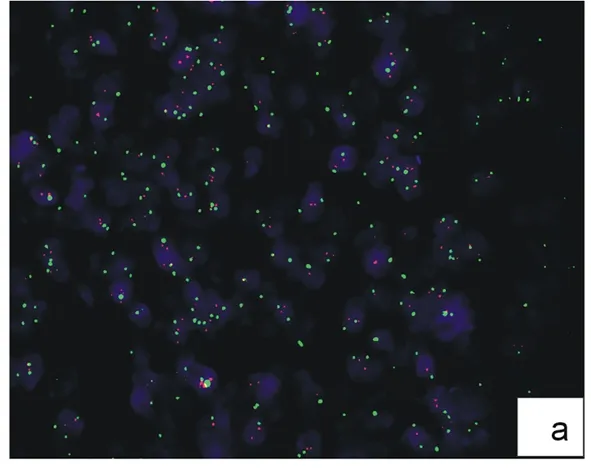
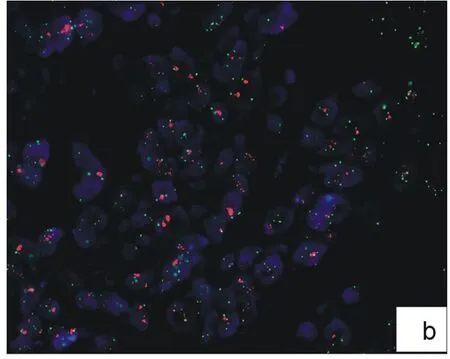
图3 乳腺癌HER2基因FISH改良法检测结果
a:17号染色体为2倍体,HER2基因无扩增;b:17号染色体为多倍体,HER2基因扩增
3 讨论
乳腺癌患者中,约有20%~30%的HER2基因的扩增和(或)蛋白过表达,与乳腺癌的复发、转移、不良预后密切相关,对临床治疗也有一定的指导意义[4]。该基因过表达提示乳腺癌恶性程度高,有转移倾向,通过检测HER2水平可对患者预后进行评判,为治疗方案的选择提供依据。美国食品和药品管理局(FDA)认可的HER2基因检测方法有IHC法、FISH和CISH法,而FISH技术能准确地反映HER2基因状态,被誉为“金标准”[3,5]。
FISH技术会受到诸多因素的影响,但最主要的影响因素却是组织固定和切片的前期处理[6]。王跃华等[7]对PanPath公司的试剂盒常规预处理与已成熟用于显色原位杂交(chromogenic in situ hybridization,CISH)法(改良法)进行了比较,结果发现常规法优于改良法,改良法细胞间质消化不完全,虽然细胞核中红绿信号清晰,但不易计数单个无重叠细胞,但却表明简化预处理步骤具有可行性。 FISH法检测过程中,石蜡切片预处理步骤较繁琐(见“1.3.1 常规FISH法”),处理时间长,整个过程需要4~5 h,浪费了大量时间。为了既能简化FISH检测试剂盒的复杂的预处理步骤,又能获得稳定和准确的实验结果,达到省时、省力、省试剂的效果。本研究用去离子水煮沸的方法代替常规FISH法步骤(2)的全部处理。考虑昆明大气压低,水的沸点低,仅为93.4 ℃,煮沸效果与海平面地区应有差异[8]。市售家用压力锅的公称压力均为80 kPa,昆明地区的大气压强约为80.6 kPa,其喷气时水的温度为111.8 ℃,在大气压强为100 kPa的地区(海平面),80 kPa压力锅喷气时水温为113.7 ℃,二者相差仅1.9 ℃。如果用单纯煮沸加热或微波煮沸加热,则昆明地区与海平面水的沸点相差6.6 ℃(100 vs.93.4)[8]。因此,本研究采用高压煮沸代替普通煮沸,并摸索最佳煮沸时间,才能达到预期效果。
本实验结果显示:常规FISH法检测10例浸润性乳腺癌免疫组化HER2染色阳性++以上的石蜡组织标本的阳性率与改良FISH法相同。改良FISH法处理的乳腺癌石蜡组织细胞间质被完全消化,只留下单个的细胞或重叠或孤立,在荧光显微镜下清晰可见单个细胞,计数大小一致、无重叠、核边界完整、DAPI染色均一、信号清晰的细胞核比较容易,与常规FISH法处理的结果无差异,完全可以代替常规FISH法来检测乳腺癌HER2基因。而且改良FISH法步骤简单易操作,只需在去离子水中高压煮沸6 min(高压锅大量喷气时开始计时),蛋白酶消化时间缩短至1 h ,就可以进行后续的探针与变性,在实际工作中节省了时间,也增加了FISH检测HER2试剂盒在高海拔地区的应用范围。从原理上分析,高压煮沸的处理方法同样可以代替其他公司的FISH检测试剂盒中的普通煮沸法,但由于不同高海拔地区的大气压强不同,各地应摸索适合自己实验室的高压煮沸时间。在低海拔地区通常采用普通煮沸法,煮沸时间需要15~30 min,而采用高压煮沸方法来代替,可以将时间缩短到几分钟,甚至比在高海拔地区需要的时间更短,可减少实验时间,提高工作效率。
[1] 上海市疾病预防控制中心.2006 年上海市市区恶性肿瘤发病率[J].肿瘤,2009,29(9):918.
[2] 孔令非,薛赵,许宋崔.乳腺癌人表皮生长因子受体-2基因扩增的意义[J].当代医学,2012,18(31):8-10.
[3] 梁茱,李晓娟,蔡俊宏,等.荧光原位杂交检测乳腺癌Her-2基因的表达及其意义[J].中国热带医学,2011,11(8):940-944.
[4] Arafah M,Kfoury HK,Zaidi SN.HER2/neu immunostaining in invasive breast cancer:analysis of false positive factors[J].Oman Medical Journal,2010,25(4):261-263.
[5] 刘彤华.表皮生长因子受体家族与靶向性抗癌治疗[J].中华病理学杂志,2006,35(7):577-579.
[6] 赵继红,卢义生,王晓文,等.荧光原位杂交技术检测乳腺癌HER2 基因状态的影响因素[J].中国热带医学,2009,9(4):640-641.
[7] 王跃华,白玮,李丽,等.荧光原位杂交法检测HER2基因状态过程中两种切片预处理方法的对比[J].肿瘤研究与临床,2008,20(12):841-842.
[8] 杨举伦,宋蜀伶,李霞,等.高海拔地区不同抗原修复方法对免疫组化染色结果的影响[J].解放军医学杂志,2005,30(12):1115-1117.
Improvement in the detection of HER2 gene in breast cancer by fluorescence in situ hybridization at high altitude
Pan Xinyan,Cai Lin,Li Guiyun,Yang Changshao,Yang Julun,Wang Li
Department of Pathology,Kunming General Hospital of Chengdu Military Command,Kunming,Yunnan,650032,China
Objective To improve and simplify the pretreatment procedure of fluorescent in situ hybridization(FISH)technique in the detection of HER2 gene in breast cancer tissues at high altitude,and to save the experiment time and promote the clinical application of FISH detection kit.Methods Ten breast cancer samples which had the HER2 immunohistochemistry staining results of ++ were selected as the subjects.FISH kits from American PanPath company were used to change the pretreatment procedure into high-pressure boiling.Comparison was made in the effects of conventional and modified methods on the amplification of HER2 gene.Results There was no significant difference in the positive rate of HER2 gene detected by the two methods which both could make the intercellular substance digestion completely,the cells overlapped or isolated,and the red and green signal in the cell nucleus clear.Conclusion The modified FISH method can take the place of the common pretreatment,simplify the procedure,save the time,and promote the clinical application of the FISH detection kit.
breast cancer;fluorescence in situ hybridization;HER2 gene
国家自然科学基金项目(81201759);云南省应用基础研究项目(2012FB210)
650032 昆明,成都军区昆明总医院病理科
王 丽,E-mail:2001wl@163.com
R 737.9
A
1004-0188(2014)01-0017-04
10.3969/j.issn.1004-0188.2014.01.007
2013-09-12)

