新兴污染物对污泥厌氧发酵的影响及其厌氧降解研究进展
王晓,严媛媛,2,张萍,周琪
(1 同济大学环境科学与工程学院污染控制与资源化研究国家重点实验室,上海 200092;2 江苏盐城环保产业 工程研发服务中心,江苏 盐城 224051;3 江苏省射阳县环境监察大队,江苏 射阳 224300)
随着社会经济的发展,表面活性剂、药物及个人护理品(PPCPs)、雌激素、全氟化合物(PFCs)、邻苯二甲酸酯和纳米材料(NPs)等物质得到广泛应用。通常条件下,上述物质大多有毒有害且难降解,可以通过污水排放等方式进入环境尤其是水体环境,并对其产生危害,被称为新兴污染物。
我国污水处理率逐年提高,但污水生物处理过程中产生的污泥(主要包括初沉污泥和剩余污泥)也大量增加。如果污泥处理处置不当,排放后会对环境造成严重的二次污染。目前,污泥的处理处置方式主要有焚烧、填埋等。但是,在国家节能减排政策影响下,污泥处理处置技术正逐步转向以产甲烷、产氢、产酸等为代表的厌氧发酵资源化利用方向。我国分别于2009年和2010年发布的《城镇污水处理厂污泥处理处置及污染防治技术政策(试行)》和《城镇污水处理厂污泥处理处置污染防治最佳可行技术指南(试行)》,均将厌氧发酵联合土地利用作为污泥处理处置优先选择的技术路线。众所周知,污泥主要由蛋白质、碳水化合物、脂类等物质组成,这些物质既是污染物,又是可以利用的资源。污泥资源化利用不但可以生产出具有较高附加值的产品,如甲烷、有机酸等,而且能够实现污泥的减量化,降低环境污染[1-3]。同时,污泥厌氧发酵残渣也富含N、P 等多种营养成分,可用于土壤改良、园林绿化甚至农用。
然而,在污水生物处理过程中,进入污水处理厂的大部分新兴污染物由于其疏水性而被大量吸附到污泥表面,当对污泥进行厌氧发酵处理时,这些有毒有害且难降解的新兴污染物可能对厌氧发酵过程产生影响。更为重要的是,新兴污染物在污泥厌氧发酵过程中的降解效果与污泥后续土地利用的前景密切相关。因此,在污泥处理处置过程中,掌握新兴污染物对污泥厌氧发酵的影响及其影响机理,研究其在厌氧发酵过程中的降解行为对污泥高效处理与安全处置具有重要的现实意义。
因此,本文在充分了解污泥中新兴污染物污染现状的基础上,总结了其对厌氧发酵产生的影响、影响机理和自身降解情况,以期为污泥高效厌氧发酵处理及安全土地利用提供理论依据与数据支持。
1 新兴污染物在污泥中的污染现状
目前,污水处理厂产生的污泥中普遍存在新兴污染物[4-5],已监测到各类典型新兴污染物的最高浓度如图1 所示。污泥中的表面活性剂主要有阴离子表面活性剂(LAS)、阳离子表面活性剂(QAC)和非离子表面活性剂NPEOs,在污泥的诸多新兴污染物中,阴离子表面活性剂LAS 因被广泛应用而浓度最高,达30000mg/kg 干污泥,远远超过欧盟建议用于土地利用的污泥中LAS 的最大浓度限值2600 mg/kg 干物质[6-7]。其次,阳离子表面活性剂季铵盐类化合物QAC 含量也达mg/kg 干污泥水平,特别是非离子表面活性剂壬基酚聚氧乙烯NPEOs 甚至高达g/kg 干污泥水平[8-9],其在污水处理过程中会迅速代谢产生壬基酚(NP)、单乙氧基壬基酚(NP1EO)、双乙氧基壬基酚(NP2EO)等[10]。
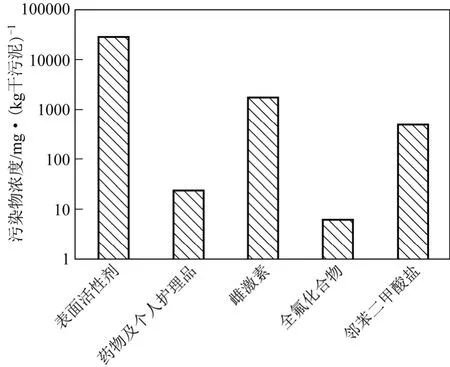
图1 典型新兴污染物最高浓度比较
关于药物及个人护理品,包括抗生素类、激素、抗微生物剂、合成麝香等,由于其持续生产以及对人类健康和生态环境潜在的危害,已引起越来越多的关注[11]。据报道,污泥中抗生素类药物浓度可达21μg/kg 干污泥[12-13]。进一步调查发现,30 种常用药物在我国各地污泥样品中均存在,含量最高为氧氟沙星,高达24760μg/kg 干污泥,其次为土霉素和诺氟沙星,均为5280μg/kg 干污泥,再次为酮洛芬,为4458μg/kg 干污泥[14]。此外,其他药物及个人护理品中激素、抗菌类药物、合成麝香和防晒霜在污泥中含量分别为372ng/kg 干污泥、5088.2ng/kg 干污泥、17000ng/kg 干污泥和24700ng/kg 干污泥[15-18]。
通常,雌激素分为天然和人工合成两大类。据报道,污泥中天然雌激素[雌酮(E1)、17β-雌二醇(E2)、雌三醇(E3)和17α-炔雌醇(EE2)]的浓度达μg/kg 干污泥水平。污泥中人工合成雌激素壬基酚(NP)含量则达几十到几千mg/kg 干污泥水平,有研究称其在污泥中含量为53~1385mg/kg 干污泥,更早的研究显示NP 的含量达1840mg/kg 干 污泥[9,19]。
全氟化合物(PFCs)是一类新型难降解有机污染物,广泛应用于表面活性剂、工业涂层剂、添加剂等,可通过多种途径进入水体并长期稳定存在。全氟辛酸(PFOA)和全氟辛烷磺酸(PFOS)作为全氟有机化合物的代表,是引起环境污染的主要全氟化合物。有调查研究表明,西班牙污水处理厂污泥中PFCs 浓度为0.28~5.20μg/kg 干污泥,德国则为20.7~38.6μg/kg 干污泥,新加坡高达884.36μg/kg干污泥[20-21]。然而,中国污水处理厂污泥中PFCs含量远大于上述国家,比如上海、沈阳和厦门污水厂污泥中PFCs 分别为926μg/kg 干污泥、3132μg/kg干污泥和6622μg/kg 干污泥[22]。
邻苯二甲酸酯主要用于聚氯乙烯材料,令聚氯乙烯由硬塑胶变为有弹性的塑胶,起到增塑剂的作用,二-(2-乙基己基)邻苯二甲酸酯(DEHP)是最常见的一种。有报道称,污泥中邻苯二甲酸酯的含量为29.4~506.3mg/kg 干污泥,其中DEHP 的平均浓度就达18~490mg/kg 干污泥,其他邻苯二甲酸酯如二甲基邻苯二甲酸酯(DMP)、二乙基邻苯二甲酸酯(DEP)、正丁基邻苯二甲酸酯(DBP)、丁基苯酯(BBP)的浓度分别为1.4~2.7mg/kg 干污泥、1.1~2.8mg/kg 干污泥、0.6~4.6mg/kg 干污泥、2.8~6.2mg/kg 干污泥[23]。
近年来,随着纳米技术的发展,纳米材料被广泛应用于材料、机械、化工、计算机、半导体、光学、纺织、石油、汽车、家电、化妆品、环境保护以及医药卫生等领域,工程纳米材料的生产量也日益增加,预计到2020年,全球的工程纳米材料年产量将达到58kt,仅欧洲国家在2010年纳米Ag 的释放量就达410t。对纳米Ag 的已有研究表明,污水厂中90%以上的纳米颗粒最终被吸附于活性污泥中而得以去除,即纳米颗粒的最终去向是污水厂的剩余污泥[24-26]。由于纳米材料尺寸大小不一,测试难度较大,目前还没有关于污泥中纳米材料污染的具体数据。
2 新兴污染物对污泥厌氧发酵的影响及其降解
通常条件下,生物气(甲烷、氢气)产量、挥发性脂肪酸(VFAs)的积累、挥发性悬浮固体(VSS)去除率的变化等被作为新兴污染物对污泥厌氧发酵影响的评价参数[27-31],新兴污染物对污泥厌氧发酵的影响主要体现在对上述一个或多个参数的影响。在污泥厌氧发酵过程中,新兴污染物同时将发生不同程度的降解(表1),并受该化合物的物理化学特性、生物降解的难易程度、自身浓度、共代谢效应等影响[28,32]。
2.1 表面活性剂
有研究者在探究表面活性剂对污泥厌氧发酵的影响时发现,LAS 浓度低于10mg/L 时有助于厌氧发酵产甲烷,更高浓度则会抑制产甲烷菌的活性,并且其毒性随烷基链长度的增加而增加,且丁酸和丙酸菌对LAS 比产甲烷菌更敏感[31,33],表面活性剂吸附到污泥表面,使其表面张力降低,有机质更易吸附到污泥表面,其生物降解速度加快,进而提高污泥厌氧发酵产甲烷能力,但表面活性剂浓度较高时,会对产甲烷菌的活性产生抑制,使甲烷产量下降[31]。与LAS 相反,QAC 对产甲烷菌的抑制作用则随烷基链长度增加而减小,且其浓度达到25mg/L 时即会抑制产甲烷菌活性[34]。与上述两种表面活性剂不同的是,1~20mg/L 的NPEOs 对厌氧发酵产甲烷均无明显抑制作用[35]。
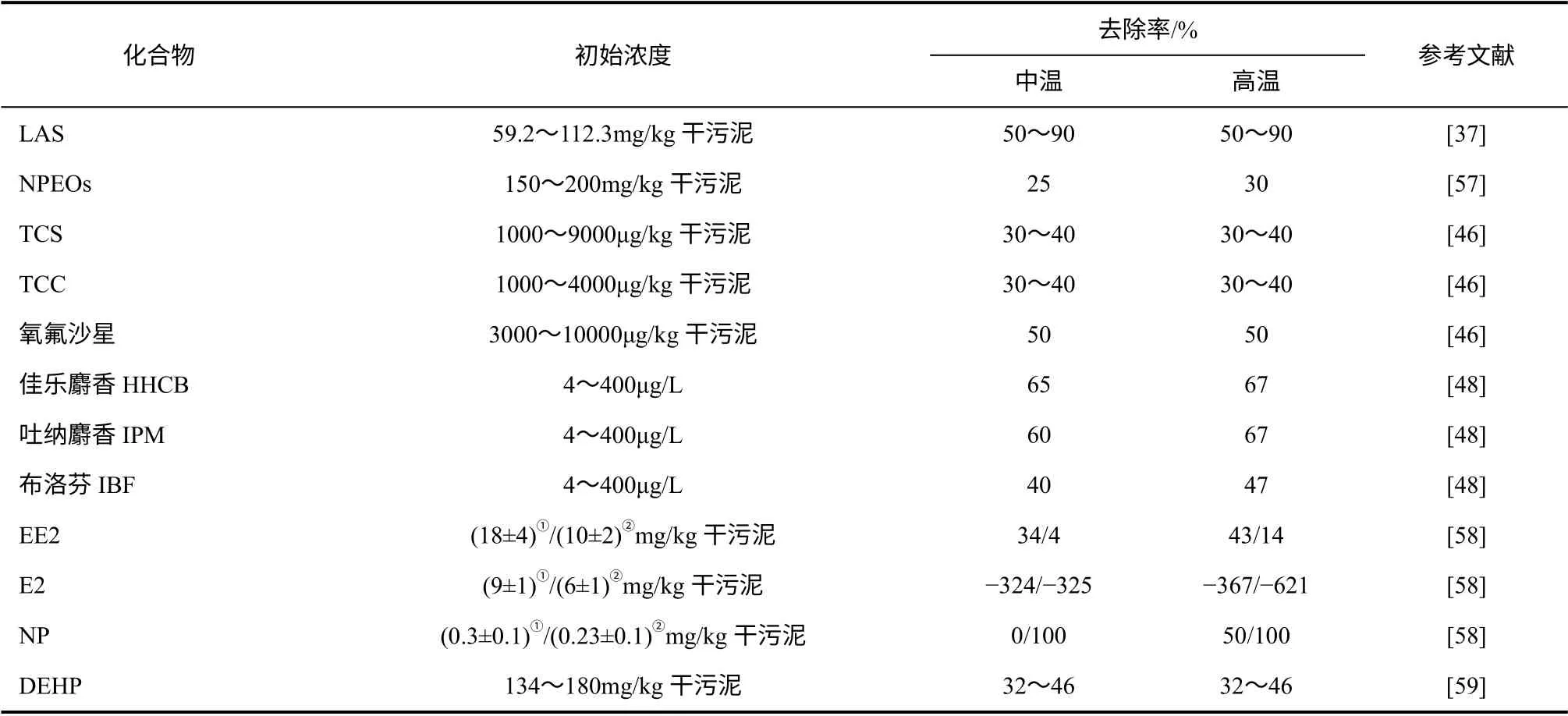
表1 不同新兴污染物在污泥中降解效果
基于表面活性剂在污泥中的污染现状及其对厌氧发酵的影响,厌氧发酵条件下表面活性剂的降解也备受关注。有研究表明,LAS 在厌氧发酵条件下可降解,且在其浓度不抑制微生物活性情况下,LAS的去除率可达80%。进一步研究发现,中温和高温条件下LAS 的去除率无明显不同,且其在无外部共基质时降解效率更高,表明厌氧微生物可将此类化合物作为部分碳源和能源利用[33,36-38]。含有烷基和苄基等取代基的QAC 在厌氧条件下则不会发生降解,可能是由于烷基和苄基等取代基的高还原性所致。然而,一些酯类QAC 在其浓度不抑制产甲烷菌活性情况下能够被产甲烷菌利用并最终可转化为甲烷、二氧化碳和氨[31,39]。NPEOs 在厌氧条件下的转化则始于亲水部分,乙氧基链缩短,直至转化为NP1EO、NP2EO 和NP,同时,厌氧发酵停留时间、温度等参数也会对其降解产生影响[40-41]。
2.2 药物及个人护理品
对药物及个人护理品对污泥厌氧发酵影响的研究表明,不同化合物的抑制方式和浓度各有不同。如红霉素在浓度低于250mg/L 时对生物产甲烷无抑制作用,而其他一些抗生素如强力霉素、泰乐菌素、链霉素和新霉素等会对生物产甲烷过程产生抑制作用,并对丙酸和丁酸降解菌的活性产生抑制[42]。金霉素、多黏菌素、氯霉素对产甲烷菌的半数抑制浓度IC50分别为12.1mg/L、6.2mg/L、329.9mg/L,链霉素、土霉素、甲砜霉素等对产甲烷也有影响,80mg/L 的甲砜霉素将使甲烷产量减少45%,60mg/L的链霉素将使甲烷产量减少25%,低于250mg/L 的土霉素则对产甲烷过程无显著影 响[43]。有学者研究普萘洛尔、氯贝酸、卡马西平等6 种药品(400mg/L 范围内)对产甲烷菌的影响时发现,高于10mg/L 的卡马西平对厌氧发酵无影响,30mg/L的普萘洛尔和高于400mg/L 的氯贝酸及磺胺甲唑将使产甲烷菌活性降低50%,不同药物及个人护理品对厌氧发酵的抑制浓度不同,且与化合物吸附在厌氧发酵污泥上的亲和力有关,药物及个人护理品吸附在污泥上,与产甲烷菌细胞膜接触,进而抑制产甲烷菌活性[44-45]。
关于污泥中药物及个人护理品类新兴污染物的降解方面,对48 种PPCPs 在污泥厌氧发酵中的变化和降解效果进行研究发现,厌氧发酵过程中磺胺甲唑和甲氧苄啶几乎可完全被去除(>90%),氧氟沙星可部分被去除(约30%~50%),但卡马西平并没有被去除[46]。还有研究表明,厌氧发酵过程中麝香去除率为50%,更有甚者可达60%~70%[46-48],但也有研究表明这些物质在厌氧发酵过程中很少或几乎没有被去除,如双氯芬酸,其在污泥厌氧发酵中就很难降解[47,49]。另一种用于治疗高血压、心绞痛等的药物比索洛尔,其在161 天长期实验中去除率仅有14%,然而萘普生则可在14 天内完全去除,并转化为甲萘普生[49]。同时,关于选择性5-羟色胺再摄取抑制剂在污泥厌氧发酵中降解的研究表明,帕罗西汀、西酞普兰、氟西汀、氟伏沙明、舍曲林降解率分别为85%、98%、32%、 53%、38%,且帕罗西汀和西酞普兰在24 天内几乎被完全降解[50]。总之,虽然药物及个人护理品在环境中的含量水平相对较低,能够通过生物降解等去除,但这仅针对于小部分易降解组分而言,而那些难降解部分将在环境中持久性存在,并且其来源稳定,种类繁多,浓度基本上能够在环境中保持稳定,也很可能在环境中产生协同作用或者与其他污染物共同作用而产生风险[51]。
2.3 雌激素
污泥中的雌激素主要包括E1、E2、EE2、NP等。目前,还未有关于雌激素对污泥厌氧发酵影响的研究报道,但关于雌激素在污泥厌氧发酵过程中的降解已有一些研究。对污泥中雌激素在中温和高温厌氧条件下降解的研究表明,常温下,初沉污泥中类固醇类雌激素(包括E1、E2、E3、EE2 等)去除效率高于50%,而混合污泥(初沉污泥和剩余污泥)中此类物质在中温和高温条件下的去除率则有所降低[52]。此外,由于共代谢的刺激,共存的易生物降解基质有利于厌氧消化过程中雌激素的降 解[53]。关于人工合成雌激素在厌氧发酵过程中的降解也有一些研究,以雌激素NP 为例,有研究发现NP 在厌氧发酵条件下可以降解,而且随着温度的上升厌氧降解效果得到进一步强化,但也有研究表明其在污泥厌氧发酵条件下含量几乎没有变化甚至有所上升[53-54],表明进水中某些物质形成的前体在生物处理过程中转化为此类物质,如NPEOs、NP1EO 和NP2EO 均可在厌氧发酵条件下转化为NP[54]。同样,其他雌激素在污泥厌氧发酵过程中去除效果的结论不尽相同,也可能是因为污泥成分复杂使其分析相对困难,同时雌激素在污水和污泥中的转化机理也尚不清楚[19,55-56]。
2.4 全氟化合物
全氟化合物是一类新型难降解有机污染物。文献中有关全氟化合物对污泥厌氧发酵过程影响的研究仍极少报道。在仅有的报道中发现,污泥厌氧发酵过程中,100mg/L 的全氟化合物对污泥厌氧发酵产甲烷有轻微影响,但与控制组无明显区别,这可能与全氟化合物更具亲水性使其不易吸附在污泥表面有关[60]。
污泥中全氟化合物在厌氧条件下的降解已有一些研究,在采用质量平衡对污水处理厂中PFCs 厌氧条件下降解的研究中发现,全氟癸磺酸钠(PFDS)等PFCs 的含量无变化,在同一研究中发现PFOA等含量则有所增加,表明在厌氧发酵过程中存在其前体的转化[61]。还有对污泥中PFOS 和PFOA 在厌氧条件下降解的研究发现,其并未发生变化[62]。进一步研究证实,在产甲烷、硝酸盐还原、铁还原、硫酸盐还原条件下的长期厌氧发酵过程中,PFCs也未发生降解[60]。通过以上研究可以看出,在厌氧发酵过程中,污泥中的PFCs 并不会发生降解。分析其中原因发现,尽管还原脱氟是热力学的有利反应,微生物可以利用脱氟还原反应产生的能量增殖,但由于C—F 键的稳定性而使全氟化合物降解受到阻碍[63]。
2.5 邻苯二甲酸酯
有关污泥中邻苯二甲酸酯类物质对厌氧发酵影响的研究也鲜有报道。在相关研究中发现,DEHP对厌氧发酵产甲烷有不利影响,邻苯二甲酸酯的浓度为60mg/L 时,甲烷产量明显减少,还有研究表明,当DEHP 的浓度由25mg/L 增加到200mg/L 时,甲烷产量由48%下降到6%,表明DEHP 对产甲烷菌的抑制作用随浓度的增加而增大,但挥发性脂肪酸的产量则无明显变化,进一步表明邻苯二甲酸酯对污泥厌氧发酵的影响主要是在产甲烷阶段,而对产酸阶段无显著影响[64-65]。
关于污泥厌氧发酵系统中邻苯二甲酸酯的降解方面,相关研究显示,在厌氧批式反应器中DMP、DBP 和DEP 均可在一周内被降解, BBP 在两周内也可降解75%,二-正辛基邻苯二甲酸酯(DOP)则很难被降解[66],同样,采用微生物降解厌氧发酵污泥中的邻苯二甲酸酯也得到了类似结论,90%的DMP 和DBP 可被降解,相同条件下,DOP 的降解相对缓慢[67]。污泥中的DEHP,作为典型邻苯二甲酸酯的代表,在污水处理厂的污泥厌氧发酵过程中的降解率仅为32%,低于其他邻苯二甲酸酯[59,64]。进一步探究污泥厌氧发酵过程停留时间、温度等关键参数对邻苯二甲酸酯降解的影响时发现,其降解受到工艺参数的显著影响,在高温和高污泥龄条件下DEHP 的降解效果相对较好,且邻苯二甲酸酯的降解与烷基链的长短有关,烷基链越长,越难降解,其中DEP、DBP 和DEHP 的降解符合一级动力学 方程[52,64,66-68]。
2.6 纳米材料
纳米颗粒的大量生产和广泛应用将不可避免地导致部分纳米颗粒释放到外界环境中,随着生活污水和工业废水被排放到污水处理厂,被吸附到污泥表面,并在污泥后续处置进行土地利用时进入土壤。与其他新兴污染物相似,这些纳米材料被大量吸附到污泥中,预计会对厌氧发酵产生影响。近期有研究发现,污泥厌氧发酵过程存在纳米ZnO 时,将对产甲烷产生抑制,30mg/gTS(总悬浮固体含量)和150mg/gTS 的纳米 ZnO 可使甲烷产量分别下降18.3%和75.1%,且纳米ZnO 颗粒的浓度越高,对产甲烷古菌的影响越大。在厌氧发酵过程中,纳米ZnO 释放的Zn2+可抑制污泥水解和产甲烷过程,导致微生物细胞活力显著下降,从而进一步降低微生物利用污泥产甲烷的效率,这也是纳米ZnO 导致污泥发酵甲烷产量减少的最根本原因[69]。
同样,纳米CeO2对污泥厌氧发酵产甲烷也会产生抑制作用,640mg/L 的纳米CeO2在中温和高温条件下均可使甲烷产量减少90%,特别指出,纳米CeO2中温下半数效应浓度EC50值为260mg/L,高温下EC50值小于320mg/L,其对酸化过程的影响也尤为显著,在5~150mg 纳米CeO2/gVS(挥发性悬浮固体含量)中,絮状污泥的短链脂肪酸产量将减少15%~19%,颗粒状污泥在150mg 纳米CeO2/gVS中短链脂肪酸产量将减少35%,在采用1500mg/L的纳米Cu 及CuO、纳米Zn 及ZnO、纳米Fe 及Fe2O3等对乙酸营养型和氢营养型产甲烷菌活性影响的研究发现,只有纳米Cu 和纳米ZnO 对两类产甲烷菌活性均有高度抑制作用,纳米CuO 仅对乙酸营养性产甲烷菌表现出高度抑制作用,产甲烷菌对其他高浓度纳米粒子则表现出高耐受力。更有研究表明,纳米TiO2甚至对甲烷产量有促进作用,1100mg/L的纳米 TiO2在高温条件下可使甲烷产量增加10%[70-72]。纳米Al2O3和纳米SiO2等纳米材料在厌氧发酵过程中对厌氧微生物活性及其种群结构没有显著影响,从而不会影响生物气产生量[30,73-74]。金属纳米材料释放的可溶性金属离子可对污泥厌氧发酵产生抑制[72]。不同物理化学性质的纳米材料会对污泥厌氧发酵过程产生截然不同的影响,如纳米Ag在污水处理厂迁移转化过程中容易形成Ag2S,毒性减小,相关原因有待进一步研究[75]。
目前关于污泥中纳米材料在厌氧发酵过程中去除的研究仍少有报道,主要是与所报道的纳米材料几乎全部为难降解材料有关。在仅有的关于纳米材料在污泥发酵过程中变化的研究也均与纳米材料与其他物质发生反应有关。比如,关于纳米ZnO 在污泥后续处置过程中迁移转化的研究发现,Zn 的形态将发生变化,无论是污泥中可溶性Zn 或后续添加的纳米Zn在所有处置过程均迅速转化为硫化物[76]。同时,纳米Ag 在厌氧发酵条件下也会与污泥中的S结合,最终形成硫化物[75]。
3 结 语
本文从污泥中6 类新兴污染物在污泥中的存在现状、对污泥厌氧发酵的影响及相关机理和其自身的降解现状进行了阐述。可以看出,新兴污染物在污泥中浓度从μg/kg(雌激素、PPCPs、PFCs)到g/kg(LAS)水平变化。当然,不同新兴污染物对污泥厌氧发酵的抑制浓度和抑制方式不同,吸附在污泥表面的新兴污染物导致污泥厌氧发酵系统中微生物细胞活力降低,抑制厌氧发酵系统酶的活性,进而抑制污泥厌氧发酵的水解、产酸、产甲烷阶段。新兴污染物自身降解也受该化合物的物理化学特性、生物降解的难易程度、污泥特性等影响,同时需要对一些毒性大、危害大的新兴污染物如NP、PFCs 等物质优先控制,并找出其易降解途径。
目前,这些新兴污染物在不同领域的应用仍不断增加,特别是纳米材料等,其对环境的潜在危害也在不断增加,含有此类新兴污染物的污泥在土地利用时对生态环境的危害一定程度上限制了污泥的土地利用,关于其中的影响机理还需要进一步探究,以利于后续的污泥的土地资源化利用。同时也需对含有这些有机污染物的污泥进行土地利用时产生的生态影响及其影响浓度限制作更深一步的研究。研究开发对难降解新兴污染物如全氟化合物、纳米材料等的降解方法及途径也仍是人们所关注的。
[1] Zhang D,Chen Y G,Zhao Y X,et al. A new process for efficiently producing methane from waste activated sludge:Alkaline pretreatment of sludge followed by treatment of fermentation liquid in an EGSB reactor[J]. Environmental Science & Technology,2011,45(2):803-808.
[2] Feng L Y,Chen Y G,Zheng X. Enhancement of waste activated sludge protein conversion and volatile fatty acids accumulation during waste activated sludge anaerobic fermentation by carbohydrate substrate addition:The effect of pH[J]. Environmental Science & Technology,2009,43(12):4373-4380.
[3] Appels L,Lauwers J,Gins G,et al. Parameter identification and modeling of the biochemical methane potential of waste activated sludge[J]. Environmental Science & Technology,2011,45(9):4173-4178.
[4] Diaz-Cruz M S,Garcia-Galan M J,Guerra P,et al. Analysis of selected emerging contaminants in sewage sludge[J]. Trac-Trends in Analytical Chemistry,2009,28(11):1263-1275.
[5] Clarke B O,Smith S R. Review of ‘emerging’ organic contaminants in biosolids and assessment of international research priorities for the agricultural use of biosolids[J]. Environment International,2011,37(1):226-247.
[6] Schowanek D,David H,Francaviglia R,et al. Probabilistic risk assessment for linear alkylbenzene sulfonate (LAS) in sewage sludge used on agricultural soil[J]. Regulatory Toxicology and Pharmacology,2007,49(3):245-259.
[7] Jensen J,Smith S R,Krogh P H,et al. European risk assessment of LAS in agricultural soil revisited:Species sensitivity distribution and risk estimates[J]. Chemosphere,2007,69(6):880-892.
[8] Ismail Z Z,Tezel U,Pavlostathis S G. Sorption of quaternary ammonium compounds to municipal sludge[J]. Water Research,2010,44(7):2303-2313.
[9] Santos J L,del Mar Gonzalez M,Aparicio I,et al. Monitoring of di-(2-ethylhexyl) phthalate,nonylphenol,nonylphenol ethoxylates,and polychlorinated biphenyls in anaerobic and aerobic sewage sludge by gas chromatography-mass spectrometry[J]. International Journal of Environmental Analytical Chemistry,2007,87(13-14):1033-1042.
[10] Birkett J W,Lester J N. Endocrine Disrupters in Wastewater and Sludge Treatment Processes[M]. Florida,USA:CRC Press,2002.
[11] Liu J L,Wong M H. Pharmaceuticals and personal care products (PPCPs):A review on environmental contamination in China[J]. Environment International,2013,59:208-224.
[12] Gao L H,Shi Y L,Li W H,et al. Occurrence of antibiotics in eight sewage treatment plants in Beijing,China[J]. Chemosphere,2012,86(6):665-671.
[13] Xu W H,Zhang G,Li X D,et al. Occurrence and elimination of antibiotics at four sewage treatment plants in the Pearl River Delta (PRD),South China[J]. Water Research,2007,41(19):4526-4534.
[14] Chen Y S,Yu G,Cao Q M,et al. Occurrence and environmental implications of pharmaceuticals in Chinese municipal sewage sludge[J]. Chemosphere,2013,93(9):1765-1772.
[15] Liu S,Ying G G,Zhao J L,et al. Trace analysis of 28 steroids in surface water,wastewater and sludge samples by rapid resolution liquid chromatography-electrospray ionization tandem mass spectrometry[J]. Journal of Chromatography A,2011,1218(10):1367-1378.
[16] Yu Y Y,Huang Q X,Cui J L,et al. Determination of pharmaceuticals,steroid hormones,and endocrine-disrupting personal care products in sewage sludge by ultra-high-performance liquid chromatography-tandem mass spectrometry[J]. Analytical and Bioanalytical Chemistry,2011,399(2):891-902.
[17] Zhou H D,Huang X,Gao M J,et al. Distribution and elimination of polycyclic musks in three sewage treatment plants of Beijing,China[J]. Journal of Environmental Sciences-China,2009,21(5):561-567.
[18] Ruan T,Liu R Z,Fu Q,et al. Concentrations and composition profiles of benzotriazole UV stabilizers in municipal sewage sludge in China[J]. Environmental Science & Technology,2012,46(4):2071-2079.
[19] Citulski J A,Farahbakhsh K. Fate of endocrine-active compounds during municipal biosolids treatment:A review[J]. Environmental Science & Technology,2010,44(22):8367-8376.
[20] Kupper T,de Alencastro L F,Gatsigazi R,et al. Concentrations and specific loads of brominated flame retardants in sewage sludge[J]. Chemosphere,2008,71(6):1173-1180.
[21] Yu J,Hu J Y,Tanaka S,et al. Perfluorooctane sulfonate (PFOS) and perfluorooctanoic acid (PFOA) in sewage treatment plants[J]. Water Research,2009,43(9):2399-2408.
[22] Guo R, Zhou Q F , Cai Y Q , et al. Determination of perfluorooctanesulfonate and perfluorooctanoic acid in sewage sludge samples using liquid chromatography/quadrupole time-of-flight mass spectrometry[J]. Talanta,2008,75(5):1394-1399.
[23] Çifci D İ,Kınacı C,Arikan O A. Occurrence of phthalates in sewage sludge from three wastewater treatment plants in Istanbul,Turkey[J]. CLEAN-Soil,Air,Water,2013,41(9):851-855.
[24] Maynard A D. Nanotechnology:A research strategy for addressing risk[R]. Woodrow Wilson International Center for Scholars,2006.
[25] Kiser M A,Ryu H,Jang H,et al. Biosorption of nanoparticles to heterotrophic wastewater biomass[J]. Water Research,2010,44(14):4105-4114.
[26] Blaser S A,Scheringer M,MacLeod M,et al. Estimation of cumulative aquatic exposure and risk due to silver:Contribution of nano-functionalized plastics and textiles[J]. Science of the Total Environment,2008,390(2):396-409.
[27] Gruden C L,Dow S M,Hernandez M T. Fate and toxicity of aircraft deicing fluid additives through anaerobic digestion[J]. Water Environment Research,2001,73(1):72-79.
[28] Stasinakis A S. Review on the fate of emerging contaminants during sludge anaerobic digestion[J]. Bioresource Technology,2012,121:432-440.
[29] Watson M K,Tezel U,Pavlostathis S G. Biotransformation of alkanoylcholines under methanogenic conditions[J]. Water Research,2012,46(9):2947-2956.
[30] Yang Y,Chen Q,Wall J D,et al. Potential nanosilver impact on anaerobic digestion at moderate silver concentrations[J]. Water Research,2012,46(4):1176-1184.
[31] Garcia M T,Campos E,Sánchez-Leal J, et al. Effect of linear alkylbenzene sulphonates (LAS) on the anaerobic digestion of sewage sludge[J]. Water Research,2006,40(15):2958-2964.
[32] Janex-Habibi M L,Huyard A,Esperanza M,et al. Reduction of endocrine disruptor emissions in the environment:The benefit of wastewater treatment[J]. Water Research,2009,43(6):1565-1576.
[33] Angelidaki I,Torng L,Waul C M,et al. Anaerobic bioprocessing of sewage sludge,focusing on degradation of linear alkylbenzene sulfonates (LAS)[J]. Water Science & Technology,2004,49(10):115-122.
[34] Garcia M T,Campos E,Sanchez-Leal J,et al. Effect of the alkyl chain length on the anaerobic biodegradability and toxicity of quaternary ammonium based surfactants[J]. Chemosphere,1999,38(15):3473-3483.
[35] Bozkurt H,Sanin F D. Toxicity of nonylphenol diethoxylate in lab-scale anaerobic digesters[J]. Chemosphere,2014,104:69-75.
[36] García M,Campos E,Ribosa I,et al. Anaerobic digestion of linear alkyl benzene sulfonates:Biodegradation kinetics and metabolite analysis[J]. Chemosphere,2005,60(11):1636-1643.
[37] Carballa M T,Manterola G,Larrea L,et al. Influence of ozone pre-treatment on sludge anaerobic digestion:Removal of pharmaceutical and personal care products[J]. Chemosphere,2007,67(7):1444-1452.
[38] Sanz J L,Culubret E,de Ferrer J,et al. Anaerobic biodegradation of linear alkylbenzene sulfonate (LAS) in upflow anaerobic sludge blanket (UASB) reactors[J]. Biodegradation,2003,14(1):57-64.
[39] Garcıa M T,Campos E,Sanchez-Leal J,et al. Anaerobic degradation and toxicity of commercial cationic surfactants in anaerobic screening tests[J]. Chemosphere,2000,41(5):705-710.
[40] Lu J,Jin Q,He Y L,et al. Anaerobic degradation behavior of nonylphenol polyethoxylates in sludge[J]. Chemosphere,2008,71(2):345-351.
[41] Patureau D,Delgenes N,Delgenes J P. Impact of sewage sludge treatment processes on the removal of the endocrine disrupters nonylphenol ethoxylates[J]. Chemosphere,2008,72(4):586-591.
[42] Sanz J L,Rodriguez N R,Amils á R. The action of antibiotics on the anaerobic digestion process[J]. Applied Microbiology and Biotechnology,1996,46(5-6):587-592.
[43] Lallai A,Mura G,Onnis N. The effects of certain antibiotics on biogas production in the anaerobic digestion of pig waste slurry[J]. Bioresource Technology,2002,82(2):205-208.
[44] Fountoulakis M,Drillia P,Stamatelatou K,et al. Toxic effect of pharmaceuticals on methanogenesis[J]. Water Science & Technology,2004,50(5):335-340.
[45] Stamatelatou K,Frouda C,Fountoulakis M S,et al. Pharmaceuticals and health care products in wastewater effluents:The example of carbamazepine[J]. Water Supply,2003,3(4):131-137.
[46] Narumiya M,Nakada N,Yamashita N,et al. Phase distribution and removal of pharmaceuticals and personal care products during anaerobic sludge digestion[J]. Journal of Hazardous Materials,2013,260:305-312.
[47] Kupper T,Plagellat C,Brändli R C,et al. Fate and removal of polycyclic musks,UV filters and biocides during wastewater treatment[J]. Water Research,2006,40(14):2603-2612.
[48] Carballa M,Omil F,Alder A C,et al. Comparison between the conventional anaerobic digestion of sewage sludge and its combination with a chemical or thermal pre-treatment concerning the removal of pharmaceuticals and personal care products[J]. Water Science and Technology,2006,53(8):109-118.
[49] Lahti M,Oikari A. Microbial transformation of pharmaceuticals naproxen,bisoprolol,and diclofenac in aerobic and anaerobic environments[J]. Archives of Environmental Contamination and Toxicology,2011,61(2):202-210.
[50] Bergersen O,Hanssen K Ø,Vasskog T. Anaerobic treatment of sewage sludge containing selective serotonin reuptake inhibitors[J]. Bioresource Technology,2012,117:325-332.
[51] 罗景阳,冯雷雨,陈银广. 污泥中典型新兴有机污染物的污染现状及对污泥土地利用的影响[J]. 化工进展,2012,31(8):1820-1827.
[52] El-Hadj T B,Dosta J,Mata-lvarez J. Biodegradation of PAH and DEHP micro-pollutants in mesophilic and thermophilic anaerobic sewage sludge digestion[J]. Water Science & Technology,2006,53(8):99-107.
[53] Chang B V,Chiang F,Yuan S Y. Anaerobic degradation of nonylphenol in sludge[J]. Chemosphere,2005,59(10):1415-1420.
[54] Hernandez-Raquet G,Soef A,Delgenès N,et al. Removal of the endocrine disrupter nonylphenol and its estrogenic activity in sludge treatment processes[J]. Water Research,2007,41(12):2643-2651.
[55] Esperanza M,Suidan M T,Marfil-Vega R,et al. Fate of sex hormones in two pilot-scale municipal wastewater treatment plants :conventional treatment[J]. Chemosphere,2007,66(8):1535-1544.
[56] De Mes T,Kujawa-Roeleveld K,Zeeman G,et al. Anaerobic biodegradation of estrogens-hard to digest[J]. Water Sci. Technol.,2008,57(8):1177-1182.
[57] Patureau D,Delgenes N,Delgenes J P. Impact of sewage sludge treatment processes on the removal of the endocrine disrupters nonylphenol ethoxylates[J]. Chemosphere,2008,72(4):586-591.
[58] Paterakis N,Chiu T Y,Koh Y K K,et al. The effectiveness of anaerobic digestion in removing estrogens and nonylphenol ethoxylates[J]. Journal of Hazardous Materials,2012,199:88-95.
[59] Marttinen S K,Kettunen R H,Sormunen K M,et al. Removal of bis(2-ethylhexyl) phthalate at a sewage treatment plant[J]. Water Research,2003,37(6):1385-1393.
[60] Liou JS C,Szostek B,DeRito C M,et al. Investigating the biodegradability of perfluorooctanoic acid[J]. Chemosphere,2010,80(2):176-183.
[61] Schultz M M,Higgins C P,Huset C A,et al. Fluorochemical mass flows in a municipal wastewater treatment facility[J]. Environmental Science & Technology,2006,40(23):7350-7357.
[62] Schroder H F. Determination of fluorinated surfactants and their metabolites in sewage sludge samples by liquid chromatography with mass spectrometry and tandem mass spectrometry after pressurised liquid extraction and separation on fluorine-modified reversed-phase sorbents[J]. Journal of Chromatography A,2003,1020(1):131-151.
[63] Parsons J R,Sáez M,Dolfing J,et al. Biodegradation of perfluorinated compounds[J]. Reviews of Environmental Contamination and Toxicology,2008,196:53-71.
[64] Gavala H N , Alatriste-Mondragon F , Iranpour R , et al. Biodegradation of phthalate esters during the mesophilic anaerobic digestion of sludge[J]. Chemosphere,2003,52(4):673-682.
[65] Battersby N S,Wilson V. Evaluation of a serum bottle technique for assessing the anaerobic biodegradability of organic chemicals under methanogenic conditions[J]. Chemosphere,1988,17(12):2441-2460.
[66] Shelton D R,Boyd S A,Tiedje J M. Anaerobic biodegradation of phthalic acid esters in sludge[J]. Environmental Science & Technology,1984,18(2):93-97.
[67] Wang Jianlong,Chen Lujun,Shi Hanchang,et al. Microbial degradation of phthalic acid esters under anaerobic digestion of sludge[J]. Chemosphere,2000,41(8):1245-1248.
[68] Huang M Z,Ma Y W,Wang Y,et al. The fate of di-n-butyl phthalate in a laboratory-scale anaerobic/anoxic/oxic wastewater treatment process[J]. Bioresource Technology,2010,101(20):7767-7772.
[69] Mu H,Chen Y G. Long-term effect of ZnO nanoparticles on waste activated sludge anaerobic digestion[J]. Water Research,2011,45(17):5612-5620.
[70] García A,Delgado L,Torà J A,et al. Effect of cerium dioxide,titanium dioxide,silver,and gold nanoparticles on the activity of microbial communities intended in wastewater treatment[J]. Journal of Hazardous Materials,2012,199:64-72.
[71] Ma J Y,Quan X C,Si X R,et al. Responses of anaerobic granule and flocculent sludge to ceria nanoparticles and toxic mechanisms[J]. Bioresource Technology,2013,149:346-352.
[72] Gonzalez-Estrella J,Sierra-Alvarez R,Field J A. Toxicity assessment of inorganic nanoparticles to acetoclastic and hydrogenotrophic methanogenic activity in anaerobic granular sludge[J]. Journal of Hazardous Materials,2013,260:278-285.
[73] Nyberg L,Turco R F,Nies L. Assessing the impact of nanomaterials on anaerobic microbial communities[J]. Environmental Science & Technology,2008,42(6):1938-1943.
[74] Mu H,Chen Y G,Xiao N D. Effects of metal oxide nanoparticles (TiO2,Al2O3,SiO2and ZnO) on waste activated sludge anaerobic digestion[J]. Bioresource Technology,2011,102(22):10305-10311.
[75] Kaegi R,Voegelin A,Sinnet B,et al. Behavior of metallic silver nanoparticles in a pilot wastewater treatment plant[J]. Environmental Science & Technology,2011,45(9):3902-3908.
[76] Lombi E,Donner E,Tavakkoli E,et al. Fate of zinc oxide nanoparticles during anaerobic digestion of wastewater and post-treatment processing of sewage sludge[J]. Environmental Science & Technology,2012,46(16):9089-9096.

