肾上腺素刺激试验在糖原累积症Ⅰ型及Ⅲ型分型中的诊断价值
简 珊,王 薇,魏 珉,邱正庆
中国医学科学院 北京协和医学院 北京协和医院儿科, 北京 100730
·论 著·
肾上腺素刺激试验在糖原累积症Ⅰ型及Ⅲ型分型中的诊断价值
简 珊,王 薇,魏 珉,邱正庆
中国医学科学院 北京协和医学院 北京协和医院儿科, 北京 100730
目的 探讨肾上腺素刺激试验在糖原累积症(glycogen storage disease, GSD)Ⅰ型、Ⅲ型分型中的诊断价值。方法 回顾性分析北京协和医院1991年3月至2012年2月收治的经基因确诊的GSD Ⅰ型及Ⅲ型患者的临床资料,所有患者均完成空腹及餐后肾上腺素刺激试验。以基因诊断结果为金标准,分析空腹及餐后肾上腺素刺激试验对GSD Ⅰ型及Ⅲ型分型的诊断价值。结果 144例GSD患者中,男88例,女56例,平均年龄(5.77±4.58)岁;Ⅰa型68例,Ⅰb型20例,Ⅲ型56例。144例患者空腹刺激试验血糖均未明显增高。餐后刺激试验血糖明显升高44例,其中Ⅰ型8例,Ⅲ型36例,两组有效应患者的比例差异有统计学意义(P<0.01)。餐后肾上腺素刺激试验诊断GSDⅠ型的敏感度和特异度分别为90.9%和64.3%;诊断Ⅲ型的敏感度和特异度分别为64.3%和90.9%。年龄≤2.5岁较>2.5岁患者餐后刺激试验有效应者的比例差异有统计学意义(P<0.05)。年龄越大,肾上腺素刺激试验诊断敏感度和特异度越高。肾上腺素刺激试验诊断年龄>2.5岁的Ⅰ型患者的敏感度和特异度分别为95.4%和77.1%,诊断年龄>2.5岁的Ⅲ型患者的敏感度和特异度分别为77.1%和95.4%。结论 肾上腺素刺激试验对GSD Ⅰ型和Ⅲ型的临床分型仍具有一定意义,尤其2.5岁以上的GSD患者结果可靠性更高。
糖原累积症;肾上腺素刺激试验;基因诊断
MedJPUMCH,2014,5(4):389-392
糖原累积症(glycogen storage disease,GSD)是一组先天性酶缺陷所导致的糖代谢障碍性疾病。目前有13个亚型,大多为常染色体隐性遗传。临床上以肝脏明显增大伴空腹低血糖为主要表现的GSD患者主要为GSD Ⅰa型、GSD Ⅰb型及GSD Ⅲ型。各型发病率不详,GSDⅠ型在欧洲国家年发病率约1∶100 000[1]。这3型均可生后即起病,且早期临床表现很相似,但晚期并发症各不相同。相对而言,GSD Ⅰ型并发症更多。若GSD Ⅰ型及Ⅲ型患者尽早进行饮食干预, 有针对性地随诊以便早期发现并诊治并发症,可达到与正常人相似的生长发育水平和生活质量。因此,疾病早期诊断尤为重要。
目前,临床上常用的GSD分型实验方法主要有肾上腺素刺激试验和基因诊断等。北京协和医院自20世纪80年代初以来,一直将肾上腺素刺激试验用于临床上GSD的初步分型诊断。近年来,基因诊断越来越多地应用于临床。为了探讨在基因诊断逐渐广泛开展的新时期,经典的肾上腺素刺激试验在GSD Ⅰ型及Ⅲ型分型诊断中的应用价值,本研究对北京协和医院经基因确诊的GSD患者的临床资料进行回顾性分析。
资料和方法
临床资料
回顾性纳入北京协和医院1991年3月至2012年2月收治的GSD Ⅰ型及Ⅲ型住院患者。所有患者均符合GSD Ⅰ型及Ⅲ型的临床诊断标准,即个矮、幼稚面容、空腹低血糖、肝大、高血脂等;且均完成基因诊断、空腹及餐后肾上腺素刺激试验。收集患者临床资料,包括年龄、性别、基因诊断、空腹及餐后肾上腺素刺激试验结果等。
基因诊断方法
在取得受试者和/或家长的知情同意后,收集患者外周血,常规提取基因组DNA,PCR扩增G6PC、G6PT和AGL基因编码区并纯化后直接测序,检出2个致病突变,获得基因确诊[2]。
空腹及餐后肾上腺素刺激试验方法
在空腹或餐后2 h时首次测血糖,即予肾上腺素0.02 mg/kg皮下注射,给药1 h后复测血糖。如给药后血糖较前升高≥2.5 mmol/L,则为血糖明显升高,即为有效应,表示肝脏糖原可被分解为葡萄糖;如血糖较前未升高或升高<2.5 mmol/L,则为血糖未明显升高,即无效应,表示肝脏糖原不能被分解为葡萄糖。正常人空腹和餐后予肾上腺素刺激均可使血糖明显升高。GSD Ⅰ型及Ⅲ型患者空腹给药后均无效应,而餐后的反应则不同。空腹给药后无效应,而餐后有效应,表示肝脏糖原在空腹时不能被分解,而餐后可被分解为葡萄糖,支持GSD Ⅲ型;空腹及餐后给药后均无效应,表示肝脏糖原无论空腹及餐后均不能被分解为葡萄糖,支持GSDⅠ型。
评价方法
以基因诊断结果作为金标准,分析空腹及餐后肾上腺素刺激试验对GSDⅠ型及Ⅲ型分型的诊断价值,以及年龄等因素对GSD患者空腹及餐后肾上腺素刺激试验结果的影响。
统计学处理
采用SPSS 11.5统计软件进行数据分析。计数资料的组间比较采用卡方检验。P<0.05表示差异有统计学意义。
结 果
患者一般情况
共144例患者纳入研究,其中男性88例,女性56例;年龄0.42~25.83岁,平均年龄(5.77±4.58)岁。根据基因分析结果,GSD Ⅰ 型88例,其中GSD Ⅰ a型68例,GSD Ⅰ b 型20例;GSD Ⅲ 型56例。GSD Ⅰ 型和Ⅲ 型患者的一般情况差异无统计学意义(P>0.05)。
不同分型患者肾上腺素刺激试验结果
144例患者空腹刺激试验血糖均未明显增高,符合GSD的临床特点。GSD Ⅰ型及Ⅲ型患者的餐后刺激试验有效应患者的比例差异有统计学意义(P<0.01)。餐后肾上腺素刺激试验诊断GSD Ⅰ型的敏感度和特异度分别为90.9%和64.3%;诊断Ⅲ型的敏感度和特异度分别为64.3%和90.9%。GSD Ⅰa型及GSD Ⅰb型的餐后肾上腺素刺激试验结果差异无统计学意义(P>0.05)(表1)。
不同年龄患者肾上腺素刺激试验分型诊断结果
随着年龄增长,肾上腺素刺激试验用于GSD Ⅰ 型和Ⅲ 型分型诊断的敏感度和特异度呈增高趋势(图1)。GSD Ⅰ型或Ⅲ型年龄≤2.5岁较>2.5岁患者餐后刺激试验有效应者的比例差异有统计学意义(P<0.05)(表2)。肾上腺素刺激试验诊断年龄≤2.5岁的GSDⅠ型患者的敏感度和特异度分别为78.3%和42.9%;诊断年龄>2.5岁的Ⅰ型患者的敏感度和特异度分别为95.4%和77.1%。肾上腺素刺激试验诊断年龄≤2.5岁的GSD Ⅲ型患者的敏感度和特异度分别为42.9%和78.3%;诊断年龄>2.5岁的Ⅲ型患者的敏感度和特异度分别为77.1%和95.4%。
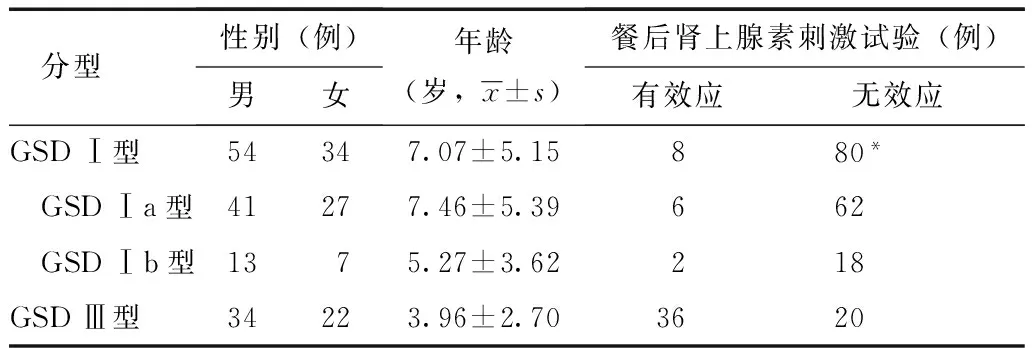
表 1 不同分型GSD患者的一般情况及餐后肾上腺素 刺激试验结果
GSD:糖原累积症;与GSD Ⅲ型比较,*P<0.01

图 1 年龄对GSD Ⅰ型(A)和Ⅲ型(B)患者餐后肾上腺素刺激试验敏感度和特异度的影响GSD:同表1

表 2 GSD Ⅰ型和Ⅲ型≤2.5岁患者及>2.5岁患者的餐后 肾上腺素刺激试验结果
GSD:同表1;与同一分型>2.5岁患者比较,*P<0.05
讨 论
我国临床上以肝脏明显增大伴空腹低血糖为主要表现的GSD患者中,GSD Ⅰ a型最常见,占65%;GSD Ⅲ型次之,占30%;而GSD Ⅰ b型约占5%[2]。这3型均可生后即起病,且早期临床表现很相似,均可表现为个矮、幼稚面容、肝大、低血糖、高血脂等,但晚期并发症各不相同。GSD Ⅰ a型可出现进行性肾脏损害、痛风、肺动脉高压、肝腺瘤、肝癌、骨质疏松等[3];GSD Ⅰ b型除GSD Ⅰ a型表现外,还可出现周期性或持续性粒细胞减少症伴反复感染、炎症性肠病等[4];GSD Ⅲ 型则可出现肌酶升高、进行性肌无力、心脏增大和心电图异常等[5]。治疗上,GSD Ⅰ 型更强调维持血糖、血脂、血尿酸和乳酸的稳定[6];GSD Ⅲ 型则重视高蛋白饮食[7]。如能早期诊断并及时干预,GSD Ⅰ型及Ⅲ型患者可达到与正常人相似的生长发育水平和生活质量。因此,疾病早期诊断尤为重要。
肾上腺素刺激试验是一项在临床上长期使用的经典分型试验,其简便、价廉、无创,患者接受度高。糖原是由葡萄糖构成的高分子多糖,主要贮存在肝脏和肌肉中作为备用能量[8]。摄入体内的葡萄糖在糖原合成酶等多种酶的作用下,以α- 1,4-糖苷键连接成直链,每隔3~5个葡萄糖残基由α- 1,6-糖苷键连接分枝,如是扩展,最终构成树状结构的大分子。糖原分解时需要磷酸化酶、脱枝酶等多种酶催化。磷酸化酶仅限作用于直链的α- 1,4-糖苷键,而当分枝点前仅存4个葡萄糖残基时须有脱枝酶将其中3个残基转移至其他直链以保证磷酸化酶继续作用,同时,脱枝酶解除α- 1,6-糖苷键连接的一个葡萄糖分子。如此反复,糖原完全分解为6-磷酸葡萄糖。6-磷酸葡萄糖再由葡萄糖-6-磷酸酶水解,最终得到葡萄糖。正常情况下,肾上腺素在体内和α受体、β受体结合后,促使肝脏中的糖原分解,加速葡萄糖的产生与输出,进入血液循环,以提高血糖水平;并且肾上腺素可部分降低外周组织对葡萄糖摄取的作用,相对升高血糖。
GSD Ⅰa型和GSD Ⅰb型患者均存在葡萄糖- 6-磷酸酶缺陷。在这种情况下,无论空腹或餐后情况下,由糖原分解或糖原异生最后产生的6-磷酸葡萄糖都不能分解得到葡萄糖。因此,即使给予肾上腺素刺激,患者血糖都不会明显增高。GSD Ⅲ型患者存在分枝酶缺陷,糖原分解不能正常进行,致使α- 1,6-糖苷键连接点增多及糖原分子结构异常,但并不影响α- 1,4-糖苷键的分解。空腹时,无可供分解的α- 1,4-糖苷键,即使给予肾上腺素刺激,血糖不会明显增高。而进食后, 新合成的糖原存在可供分解的α- 1,4-糖苷键,故给予肾上腺素刺激后,血糖可明显增高。从理论上看,肾上腺素刺激试验可以间接地反映体内肝脏糖原分解是否出现了问题,但并不能明确糖原分解过程中是哪一种酶出现了缺陷。
在基因突变分析方法建立前,肝脏或肌肉活检进行相关酶活性的测定是国际上GSD诊断的“金标准”。但因该方法有创,实验操作复杂、影响因素多,特别是在我国临床上还没有开展肝组织酶活性的测定,因此其使用受到很大限制。近年来,基因分析开始用于GSD的确诊。GSD Ⅰa、GSD Ⅰb和GSD Ⅲ型分别由葡萄糖- 6-磷酸酶G6PC基因、葡萄糖- 6-磷酸转移酶G6PT基因、葡萄糖脱枝酶AGL基因等突变所致。提取GSD患者外周血DNA,经PCR扩增G6PC、G6PT和AGL基因编码区并纯化后直接测序,如发现2个致病突变,即可作出基因诊断。该方法无创安全,可用于患者确诊、携带者的检出和产前诊断,是GSD Ⅰ型和Ⅲ型确诊的可靠方法之一,但技术要求及费用均较高,耗时较长,人群普及受限。
本研究对肾上腺素刺激试验在GSD Ⅰ型、Ⅲ型分型诊断中的价值进行了探讨,结果显示经典的肾上腺素刺激试验用于GSD Ⅰ型和Ⅲ型的分型诊断仍具有一定价值。分析年龄对试验结果的影响,发现年龄越大,肾上腺素刺激试验诊断GSD的敏感度和特异度越高。年龄≤2.5岁患者餐后刺激试验的结果较>2.5岁患者的结果差异有统计学意义。笔者考虑这可能与年龄大于2.5岁的患者对肾上腺素等升血糖激素反应更稳定有关。另外,人体参与血糖代谢的其他内分泌激素还包括糖皮质激素、生长激素、甲状腺素、胰高血糖素等,也会影响刺激试验的结果。
综上,目前临床上常用的GSD分型方法除临床表现外,主要有肾上腺素刺激试验和基因诊断等。近10年来,GSD的基因诊断技术得到迅速发展,有逐渐取代肾上腺素刺激试验等功能试验之势。但肾上腺素刺激试验对GSD Ⅰ型和Ⅲ型的临床分型仍具有一定意义,适用于没有条件进行基因及相关组织活检作相关酶活性诊断的医院,且2.5岁以上的GSD患者的肾上腺素刺激试验结果可靠性更高。
致谢:北京协和医院儿科各位医务人员、患者及其家长的支持和配合
[1]Froissart R, Piraud M, Boudjemline AM,et al. Glucose- 6-phosphatase deficiency[J]. Orphanet J Rare Dis,2011,6:27.
[2]邱正庆,魏珉.中国人常见糖原累积症111例基因分型研究.中华医学会第五次全国儿科中青年学术交流大会[C].济南:中华医学会,2008.
[3]Rake JP, Visser G, Labrune P, et al. Glycogen storage disease type Ⅰ: diagnosis, management, clinical course and outcome.Results of the European Study on Glycogen Storage Disease Type l (ESGSD I)[J].Eur J Pediatr,2002,161:20- 34.
[4]Visser G,Rake JP,Labrune P,et al. Consensus guidelines for management of glycogen storage disease type 1b-European Study on Glycogen Storage Disease Type 1[J]. Eur J Pediatr, 2002,161:S120-S123.
[5]Austin SL,Proia AD,Spencer-Manzon MJ,et al. Cardiac pathology in glycogen storage disease type Ⅲ[J].JIMD Rep, 2012,6:65- 72.
[6]Rake JP,Visser G,Labrune P,et al. Guidelines for management of glycogen storage disease type Ⅰ-European Study on Glycogen Storage Disease Type Ⅰ (ESGSD Ⅰ)[J]. Eur J Pediatr, 2002,161:S112-S119.
[7]Kishnani PS,Austin SL,Arn P,et al. Glycogen storage disease type Ⅲ diagnosis and management guidelines[J].Genet Med,2010,12:446- 463.
[8]胡亚美,江载芳.诸福棠实用儿科学[M].7版.北京:人民卫生出版社,2002:2125- 2133.
Diagnostic Value of Epinephrine Stimulation Test in Distinguishing Type Ⅰ and Type Ⅲ Glycogen Storage Diseases
JIAN Shan, WANG Wei, WEI Min, QIU Zheng-qing
Department of Pediatrics,Peking Union Medical College Hospital,Chinese Academy of Medical Sciences &Peking Union Medical College,Beijing 100730,China
QIU Zheng-qing Tel: 010-69156276,E-mail:zhengqingqiu33@aliyun.com
Objective To analyze the value of epinephrine stimulation test in distinguishing type Ⅰ and type Ⅲ glycogen storage diseases (GSD). Methods The clinical data of genetically diagnosed type Ⅰ and Ⅲ GSD patients from March 1991 to February 2012 in Peking Union Medical College Hospital were retrospectively analyzed. All the patients finished fasting and postprandial epinephrine stimulation test. The diagnostic value of fasting and postprandial epinephrine stimulation test was evaluated against gene diagnosis as the gold standard. Results Totally, 144 GSD patients(88 males and 56 females) with an average age of (5.77±4.58)years were included. There were 68 cases of GSD type Ⅰa, 20 cases of GSD type Ⅰb, and 56 cases of GSD type Ⅲ. Fasting epinephrine stimulation test showed no significant increase in blood glucose level in all the 144 patients, while postprandial epinephrine stimulation test exhibited that blood glucose level significantly increased in 44 cases, including 8 cases of type Ⅰ and 36 cases of type Ⅲ, with significant difference in the percentage of patients effective to the test between the two types (P<0.01). The sensitivity and specificity of postprandial epinephrine stimulation test in diagnosing GSD type Ⅰ were 90.9% and 64.3%, respectively, and those in diagnosing GSD type Ⅲ were 64.3% and 90.9%, respectively. The sensitivity and specificity in patients ≤2.5 years old were significantly lower than those in patients >2.5 years old (P<0.01). In patients >2.5 years, the sensitivity and specificity of epinephrine stimulation test were 95.4% and 77.1% in GSD Ⅰ, and 77.1% and 95.4% in GSD type Ⅲ. Conclusion Epinephrine stimulation test still can be helpful in distinguishing GSD type Ⅰ and GSD type Ⅲ, especially liable in patients > 2.5 years old.
glycogen storage disease;epinephrine stimulation test;gene diagnosis
邱正庆 电话:010-69156276,E-mail:zhengqingqiu33@aliyun.com
R725.8
A
1674-9081(2014)04-0389-04
10.3969/j.issn.1674-9081.2014.04.007
2014- 08- 14)

