三油酸甘油酯酯交换制取脂肪酸甲酯和碳酸甘油酯的热力学分析
王丽娇,冯树波,2
(1. 河北科技大学 化学与制药工程学院,河北 石家庄 050018;2. 河北省药物化工工程技术研究中心,河北 石家庄 050018)
三油酸甘油酯酯交换制取脂肪酸甲酯和碳酸甘油酯的热力学分析
王丽娇1,冯树波1,2
(1. 河北科技大学 化学与制药工程学院,河北 石家庄 050018;2. 河北省药物化工工程技术研究中心,河北 石家庄 050018)
采用Aspen Plus模拟软件和Benson基团贡献法对大豆油中的三油酸甘油酯和碳酸二甲酯进行酯交换制取碳酸二甘油酯和碳酸二甘油酯水解制取碳酸甘油酯的两个反应过程进行了热力学计算,给出了298.15~1 000 K的反应焓变、反应熵变、反应吉布斯自由能变及平衡常数。第一反应过程包括4步反应,计算数据显示,在第一反应过程中,生成碳酸二甘油酯的反应为整个反应过程的控制步骤,该反应在400 K时才可自发进行。由此推断,三油酸甘油酯与碳酸二甲酯的酯交换反应应在400 K以上进行。碳酸二甘油酯水解生成碳酸甘油酯的第二反应过程为放热反应,低温有利于平衡转化率的提高。
碳酸二甲酯;三油酸甘油酯;酯交换;热力学分析;碳酸甘油酯;脂肪酸甲酯
在资源有限的今天,生物柴油(主要成分为脂肪酸甲酯)已成为部分替代化石燃料的新能源。生物柴油通常是由食用油或非食用油(如大豆油[1]、棕榈油[2]、菜籽油[3]等)通过酯交换反应制得,具有无毒、生物降解率高、降解速率快等特点,且燃烧产生的微粒量明显少于无硫柴油燃烧产生的颗粒量,是一种清洁能源[4-8]。
生物柴油的制备方法有物理法和化学法两种,其中物理法制备的生物柴油存在积碳、润滑油污染等问题,故一般采用化学法。目前,化学法制备生物柴油主要是碱催化法,即在碱存在下,甲醇与油脂进行酯交换得到产品和甘油[9-10]。副产品甘油需进一步提纯才可使用,但现在甘油的分离和提纯存在很大的技术难题,在生产过程中,一些粗甘油弃之不用,造成严重的环境问题[10]。近年来,有研究者用碳酸二甲酯(DMC)代替甲醇作为酯交换剂来制备生物柴油。该工艺不仅绿色、无毒、健康,而且不产生甘油,合成的产物可直接用作燃料,不需分离,相关研究正在进行[5]。以DMC为酯交换剂的另一个优势是联产的碳酸甘油酯可用于制备聚碳酸酯[11]。Fabbri等[12]用DMC和大豆油进行酯交换制备生物柴油,收率达到99.5%。目前,用DMC与油脂反应合成生物柴油已是国内外的研究热点。
热力学分析是化学反应进行的可能性和进行程度的重要判据。由于DMC与大豆油中的三油酸甘油酯(TG)的反应历程涉及多个反应,因此反应条件的控制尤其重要。但目前有关DMC与TG反应的热力学分析尚未见报道。
本工作采用Aspen Plus模拟软件和Benson基团贡献法[13-15]对DMC与TG反应制取脂肪酸甲酯和碳酸甘油酯的过程进行了热力学分析,以期对实验研究和工业化生产提供参考和依据。
1 反应机理
根据文献[2]报道的结果初步推断,DMC与TG的酯交换反应包括两个反应过程:第一个反应过程为DMC与TG反应制得碳酸二甘油酯,该过程包括4步反应,反应方程式见式(1)~(4);第二个反应过程为在碱性催化剂作用下,碳酸二甘油酯水解制得碳酸甘油酯,反应方程式见式(5)。
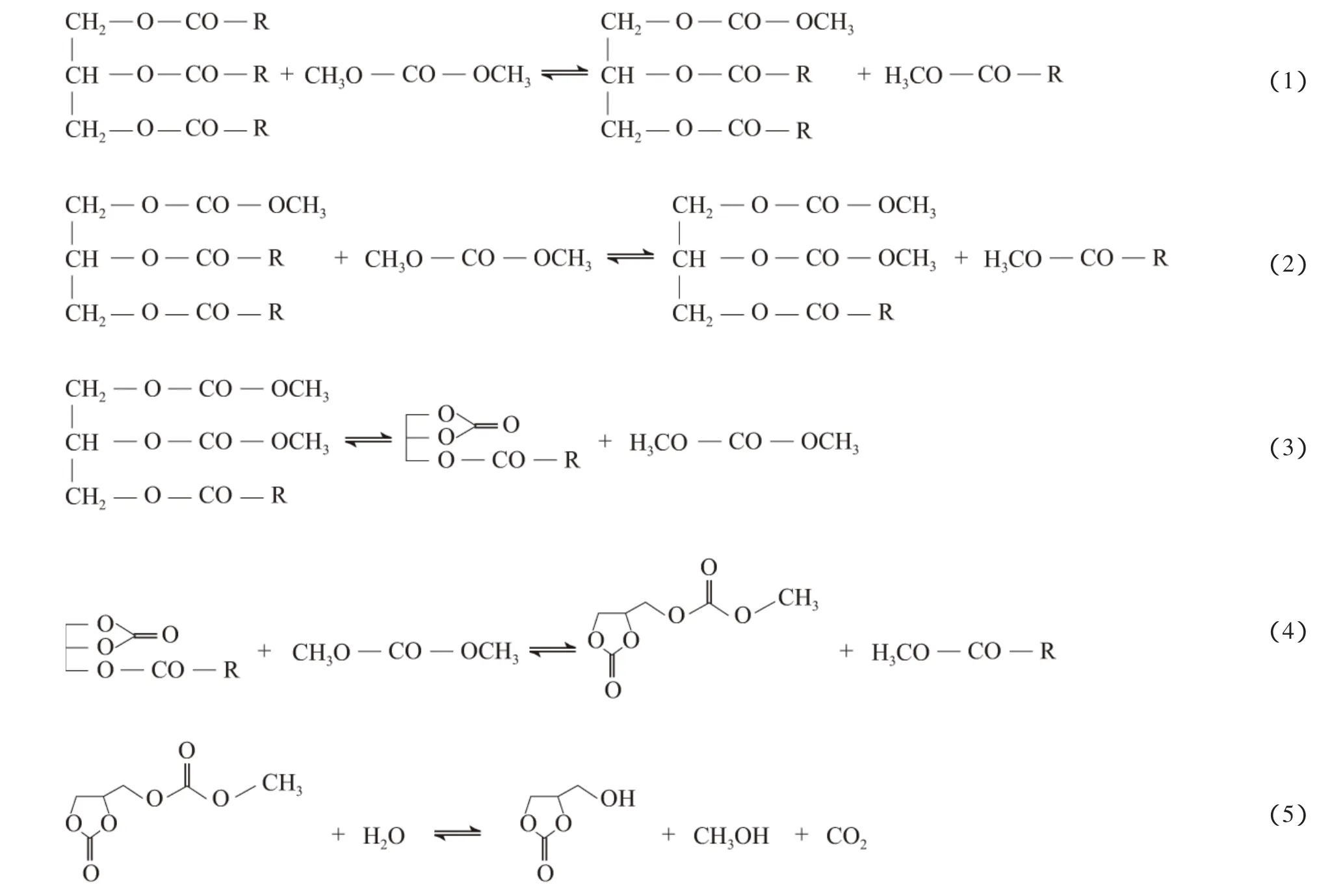
从反应机理判断,为避免TG与酯交换反应的中间产物发生水解反应,应严格控制水含量。
2 热力学计算
采用Aspen Plus模拟软件得到该反应体系中各物质的标准摩尔生成焓(ΔfHm⊖)和标准摩尔生成吉布斯自由能(ΔfGm⊖),计算结果见表1。
Benson基团贡献法是目前比较准确地估算热力学数据的方法,它不仅考虑了基团本身的特性而且考虑了与基团相连的最近邻位基团和各种异构现象的影响,准确度较高[16]。通过Benson基团贡献法查得各基团在不同温度下对恒压摩尔热容(Cpm)的贡献值(Cpmi),计算结果见表2,并用式(6)计算各物质在不同温度下的Cpm。

式中,Ni为基团的数目。
表1 各物质的和Table 1 Standard molar enthalpy of formation() and standard molar Gibbs free energy of formation() of different components

表1 各物质的和Table 1 Standard molar enthalpy of formation() and standard molar Gibbs free energy of formation() of different components
DMC:dimethyl carbonate;TG:triolein;FAMEs:fatty acid methyl esters;GC:glycerol carbonate;MG:glyceryl monooleate;GDC:glycerol dimethyl carbonate;DG:dioleoyl glycerol;RO:intermediate product.
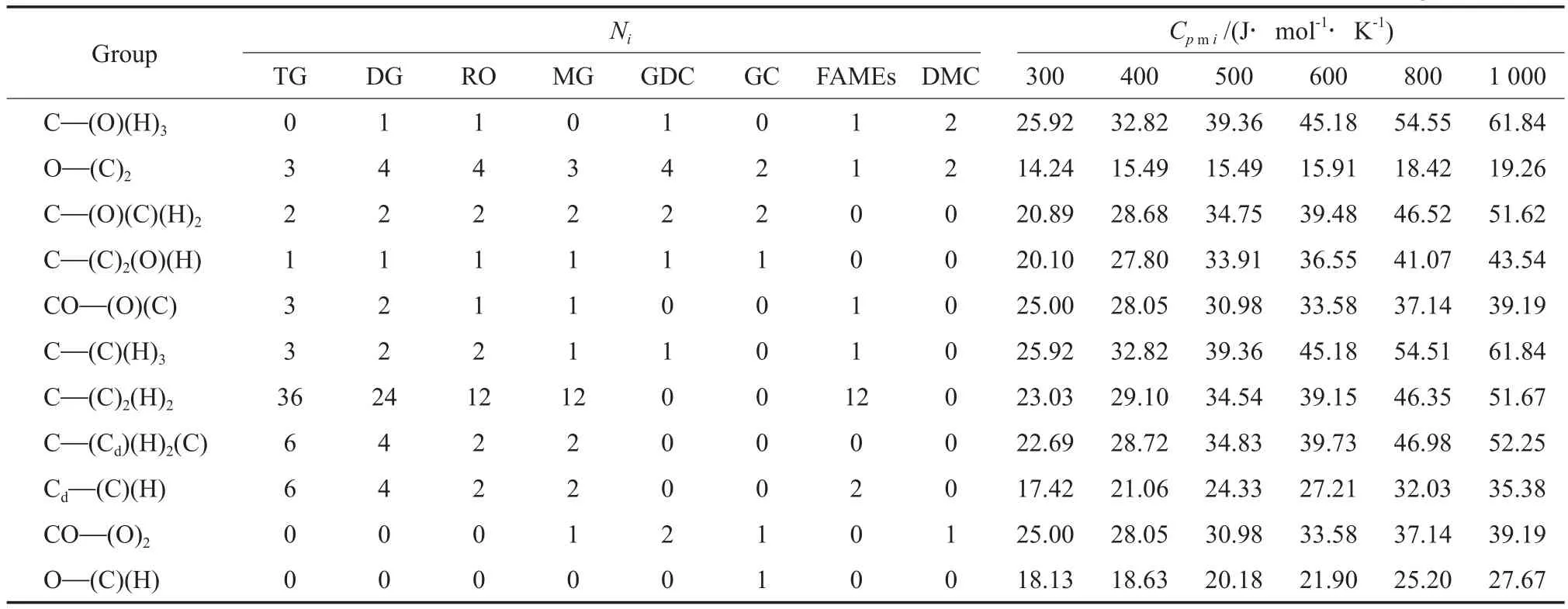
表2 各物质所含的Ni及各基团的Cpmi[16]Table 2 Group numbers(Ni) in the components and contribution of different groups to molar heat capacity at constant pressure(Cpmi)[16]
根据表2中的数据可得各物质在相应温度下的Cpm,再利用多项回归方法得到各物质的Cpm随温度变化的回归方程[15],结果见式(7)~(13)。

根据Cpm和式(16)、式(17)的关系,计算各物质在不同温度下ΔfHm⊖的和标准摩尔生成熵(ΔfSm⊖),再利用式(18)计算得到不同温度下的ΔfGm⊖。
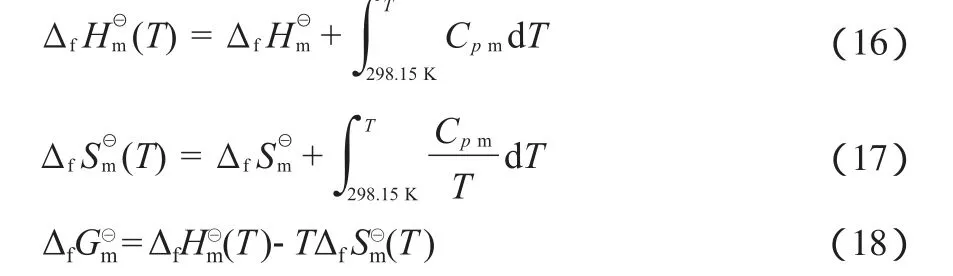
利用式(19)~(22)可计算得到这5个反应在不同温度下的标准摩尔反应焓(ΔrHm⊖)、标准摩尔反应熵(ΔrSm⊖)和标准摩尔反应吉布斯自由能(ΔrGm⊖),再通过式(20)得到各反应的平衡常数(K⊖)。
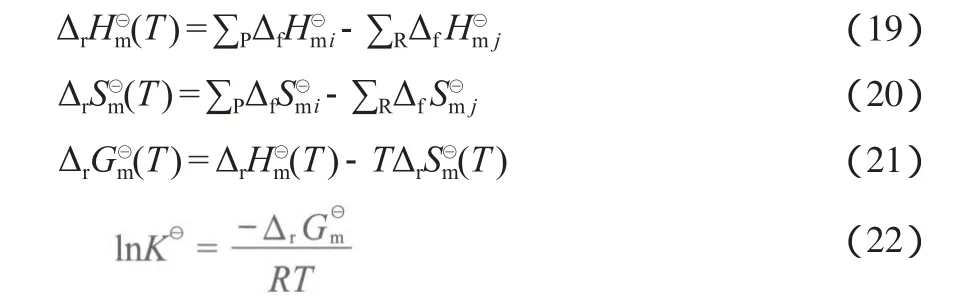
3 结果与讨论
表3 各反应在不同温度下的Table 3 Standard molar enthalpy(), standard molar entropy() and standard molar Gibbs free energy() of the reactions at different temperature
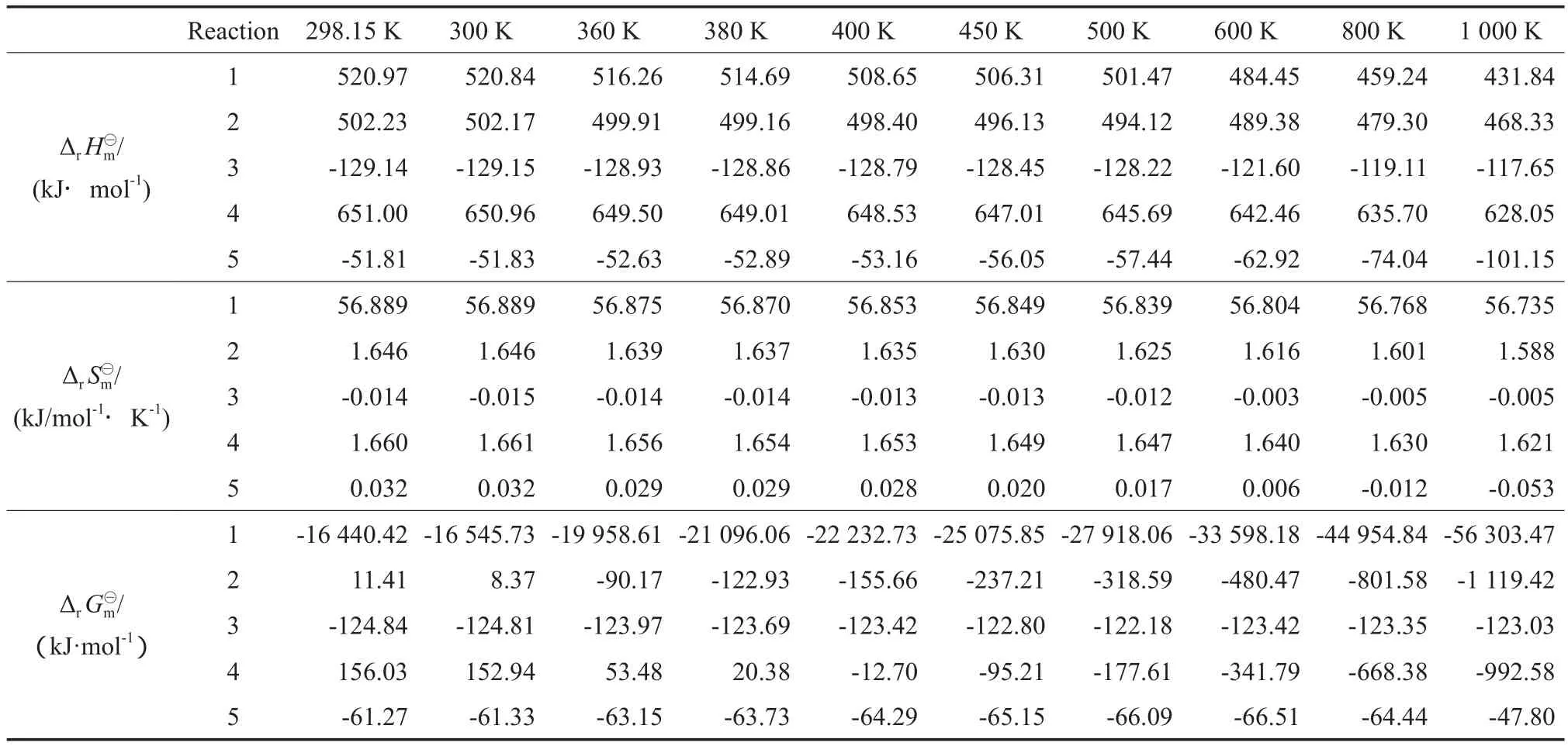
表3 各反应在不同温度下的Table 3 Standard molar enthalpy(), standard molar entropy() and standard molar Gibbs free energy() of the reactions at different temperature
各反应在不同温度下的K⊖见表4。反应(1)的lgK⊖随温度的变化见图1。反应(2)~(5)的lgK⊖随温度的变化见图2。由表4、图1和图2可见,反应(1)的平衡常数很大,说明反应(1)很容易充分进行,平衡转化率很高,不是整个反应的控制步骤。反应(2)和(4)的平衡常数随温度的升高快速增大,当温度接近1 000 K时增幅减缓。从热力学角度看,升高温度可使这两个反应进行完全。相比之下,反应(3)和(5)的平衡常数随温度的升高有缓慢下降趋势,但降幅较小。热力学计算数据表明,生成碳酸二甘油酯的反应(4)为整个反应过程的控制步骤,该反应在400 K下才可自发进行。因此,DMC与TG酯交换反应的操作温度应高于400 K。综合考虑,选取温度高于400 K较适宜。
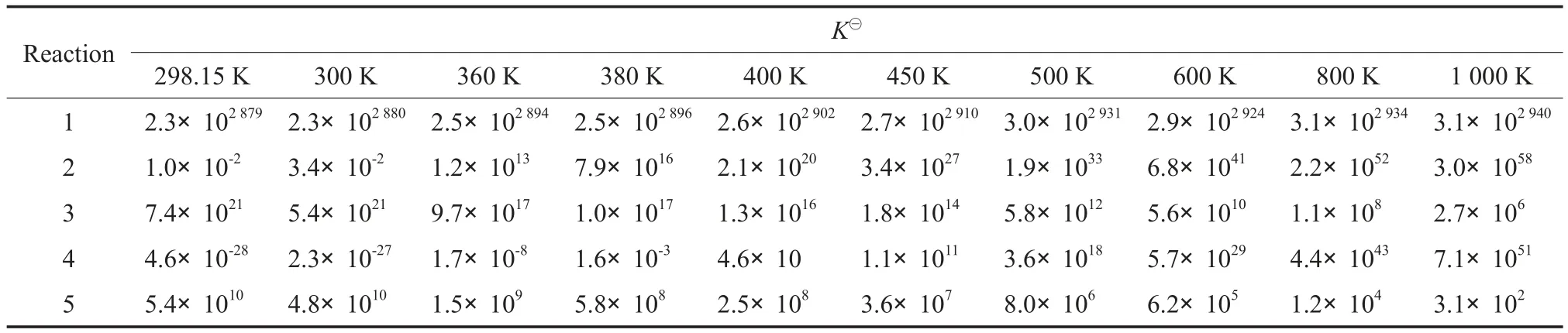
表4 各反应在不同温度下的K⊖Table 4 Equilibrium constant(K⊖) of the reactions at different temperature
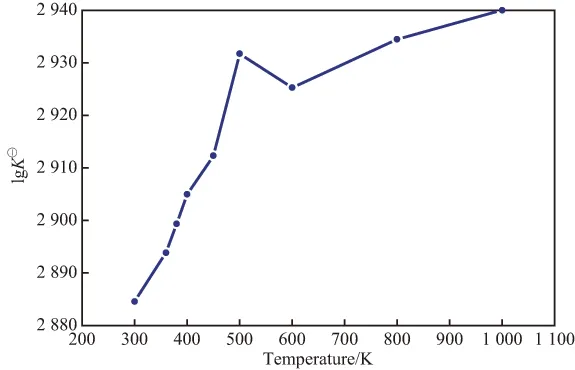
图1 反应(1)的lgK⊖随温度的变化Fig.1 Change of lgK⊖of reaction (1) with temperature.

图2 反应(2)~(5)的lgK⊖随温度的变化Fig.2 Changes of lgK⊖of reactions (2)-(5) with temperature.
4 结论
1)DMC与TG的酯交换反应包括DMC与TG反应制得碳酸二甘油酯和在碱性催化剂作用下,碳酸二甘油酯水解制得碳酸甘油酯两个过程。热力学计算数据表明,生成碳酸二甘油酯的反应(4)为整个反应过程的控制步骤,该反应在400 K下才可自发进行。因此,DMC与TG酯交换反应的操作温度应高于400 K。
2)采用Benson基团贡献法估算了反应体系中各组分的Cpm,并用于DMC与TG酯交换过程的热力学计算,根据所得结果预测适宜的操作温度。
符 号 说 明


[1]张云. 固体碱催化大豆油和甲醇酯交换反应制备生物柴油的研究[D]. 天津:天津大学,2007.
[2]Zhang Liping,Sheng Boyang,Zhong Xin,et al. Kinetics of Transesterification of Palm Oil and Dimethyl Carbonate for Biodiesel Production at the Catalysis of Heterogeneous Base Catalyst[J]. Bioresour Technol,2010,101(21):8144 -8150.
[3]Kurle Y M,Islam M R,Benson T J. Process Development and Simulation of Glycerol-Free Biofuel from Canola Oil and Dimethyl Carbonate[J]. Fuel Process Technol,2013,114:49 - 57.
[4]Boehman A L,Morris D,Szybist J,et al. The Impact of the Bulk Modulus of Diesel Fuels on Fuel Injection Timing[J]. Energy Fuels,2004,18(6):1877 - 1882.
[5]Marchetti J M,Miguel V U,Errazu A F. Possible Methods for Biodiesel Production[J]. Renew Sust Energ Rev,2007,11(6):1300 - 1311.
[6]Xin Jiayu,Imahara H,Saka S. Oxidation Stability of Biodiesel Fuel as Prepared by Supercritical Methanol[J]. Fuel,2008,87(10/11):1807 - 1813.
[7]燕来荣. 我国生物柴油的发展状况及产业化前景[J]. 客车技术与研究,2009(3):1 - 3.
[8]Talebian-Kiakalaieh A,Amin N A S,Mazaheri H. A Review on Novel Processes of Biodiesel Production from Waste Cooking Oil[J]. Appl Energy,2013,104:683 - 710.
[9]Ilham Z,Saka S. Two-Step Supercritical Dimethyl Carbonate Method for Biodiesel Production from Jatropha Curcas Oil[J]. Bioresour Technol,2010,101(8):2735 - 2740.
[10]苏有勇,王华,包桂蓉,等. 生物柴油副产物粗甘油精制工艺的研究[J]. 中国油脂,2008,33(12):58 - 60.
[11]樊一帆,黄辉,张国飞,等. 碳酸二甲酯在生物柴油合成中的应用[J]. 宁波工程学院学报,2012(4):77 - 80,94.
[12]Fabbri D,Bevoni V,Notari M,et al. Properties of a Potential Biofuel Obtained from Soybean Oil by Transmethylation with Dimethyl Carbonate[J]. Fuel,2007,86(5):690 -697.
[13]王丽苹,萧斌,王公应. 碳酸酯与1,4-丁二醇酯交换合成聚碳酸酯二醇的热力学分析[J]. 石油化工,2009,38(9):961 - 965.
[14]尹安远,戴维林,范康年. 草酸二甲酯催化加氢合成乙二醇过程的热力学计算与分析[J]. 石油化工,2008,37(1):62 - 66.
[15]杨浩,王建红,乔聪震. 柠檬酸与正丁醇合成柠檬酸三丁酯的热力学分析[J]. 石油化工,2011,40(2):171 - 174.
[16]王松汉. 石油化工设计手册:第1卷[M]. 北京:化学工业出版社,2002:452 - 459.
(编辑 李明辉)
Thermodynamic Analysis for Preparing Biodiesel and Glycerol Carbonate from Triolein with Dimethyl Carbonate by Transesterification
Wang Lijiao1,Feng Shubo1,2
College of Chemical and Pharmaceutical Engineering, Hebei University of Science and Technology, Shijiazhuang Hebei 050018,China;2.Hebei Research Center of Pharmaceutical and Chemical Engineering, Shijiazhuang Hebei 050018,China)
The thermodynamic analysis for the transesterification of triolein with dimethyl carbonate and the hydrolysis of the intermediate product,diglycerol carbonate,for preparing fatty acid methyl esters and glycerol carbonate was conducted by using Aspen plus software and Benson group contribution. The enthalpy changes,entropy changes,Gibbs free energy changes and equilibrium constants of the reactions at 298.15-1 000 K were obtained. The transesterification of triolein with dimethyl carbonate was carried out by four successive steps. The calculation of the equilibrium constants showed that the fourth step reaction for forming diglycerol carbonate can spontaneously occur at 400 K. Based on the results,the transesterification of triolein with dimethyl carbonate should be studied above 400 K. The hydrolysis of diglycerol carbonate for glycerol carbonate is exothermic,so low temperature is beneficial to heightening the conversion.
dimethyl carbonate;triolein;transesterification;thermodynamic analysis;glycerol carbonate;fatty acid methyl ester
1000 - 8144(2014)03 - 0287 - 06
TQ 013.1
A
2013 - 09 - 17;[修改稿日期]2013 - 12 - 18。
王丽娇(1988—),女,河北省邢台市人,硕士生,电话 13833120771,电邮 13833120771@163.com。联系人:冯树波,电话 13091021012,电邮 fengsb@263.net。

