吡啶在HY分子筛上的脱附反应动力学及酸中心强度的表征
王 斌,张 颖,左 敏,郭广生
(1. 北京化工大学 化工资源有效利用国家重点实验室,北京 100029;2. 中国石化 北京化工研究院,北京 100013)
吡啶在HY分子筛上的脱附反应动力学及酸中心强度的表征
王 斌1,2,张 颖2,左 敏2,郭广生1
(1. 北京化工大学 化工资源有效利用国家重点实验室,北京 100029;2. 中国石化 北京化工研究院,北京 100013)
运用改进的程序升温脱附-红外光谱(TPD-IR)技术,采用新的脱附动力学模型,研究了吡啶在HY分子筛B酸中心和L酸中心上的脱附反应动力学,分别计算了吡啶在HY分子筛两种类型酸中心上的脱附活化能,并以此量化了各酸中心的强度,对表面酸中心的类型进行了详细的区分。实验及计算结果表明,吡啶在HY分子筛B酸中心上的程序升温脱附反应符合一级动力学模型,以其为探针分子,可在HY分子筛表面区分出两种强度不同的B酸中心,对应的吡啶脱附活化能分别为32.4,18.6 kJ/mol;吡啶在HY分子筛L酸中心上的程序升温脱附反应符合三级动力学模型,HY分子筛表面同时存在两种不同强度的L酸中心,对应的吡啶脱附活化能分别为24.9,5.3 kJ/mol。
HY分子筛;吡啶;程序升温脱附-红外光谱技术;脱附动力学;酸中心强度
分子筛催化剂的表面酸性是其酸催化性能的关键,所谓酸性是指表面酸中心类型、酸中心强度以及酸中心的分布和数量。研究与测定分子筛的酸性是设计和开发催化剂的重要基础。测定分子筛表面酸性的方法有很多,如碱滴定法、碱性气体吸附法、差热分析法和电位滴定法等[1-8],但这些方法均不能区别表面酸中心的类型。红外光谱法可以弥补上述方法的不足,可有效区分B酸中心和L酸中心,并可测定各种酸中心的数量及其分布,因而被广泛用来研究固体表面酸性[9-14];但对于酸强度的表征,红外光谱法无法给出满意的量化结果。相对于表面酸中心的数量和密度,酸强度对于催化过程中的活性具有更重要的意义。碱滴定法以及程序升温脱附(TPD)法只能给出平均的酸强度指标,无法同时区分表面酸的强度和类型。Li等[13-14]运用TPD与红外光谱相结合的TPD-IR法研究了NH3和吡啶在HY分子筛上的脱附,提供了HY分子筛表面酸中心的有关信息;但该方法基于探针分子的TPD过程是一级反应的假设,因此不适用于各种探针分子在不同类型酸中心上的脱附。
本工作运用改进的TPD-IR法,采用新的脱附反应动力学模型,计算了吡啶在HY分子筛不同类型酸中心上的脱附活化能,并以此作为各酸中心强度的量化指标,对表面酸中心的类型进行了详细的区分。
1 实验部分
1.1 仪器和原料
AVATAR360型傅里叶变换红外光谱仪:Nicolet公司,配备原位透射池及真空装置。HY分子筛:南开催化剂厂,使用前需在600 ℃下焙烧8 h。
1.2 实验方法
将直径为13 mm、重约15 mg的HY分子筛自支撑片置于原位透射池内,真空条件下程序升温至500 ℃并恒温2 h,然后降至室温;导入吡啶的饱和蒸气进行吸附,吸附饱和后升温至100 ℃并真空处理1 h;在真空条件下以5 ℃/min的速率由100 ℃升至500 ℃,然后进行程序升温脱附。当升温脱附程序开始时同步触发光谱采集程序,以采集“Series文件”的方式实时采集整个过程中的IR光谱,光谱分辨率4 cm-1,扫描速率1.898 8 cm/min,单光谱扫描87次,采样间隔时间1 min。采样结束后对“Series文件”进行处理,建立特征峰吸收强度随时间的分布曲线。
1.3 计算方法
在实验条件下,催化剂表面与脱附的探针分子不发生反应或再吸附,脱附反应不可逆,探针分子从一类酸中心上的脱附速率可根据Wigner-Polanyi方程[15-16]描述为:

式中,N(t)为脱附时间为t时的脱附速率,mol/s; Vm为单层饱和吸附量,mol;θ为表面覆盖度;t为脱附时间,min;n为脱附反应级数;ν为脱附反应频率因子;Ed为脱附活化能,kJ/mol;R为理想气体常数,8.314 J/(mol·K);T为脱附温度,K。本实验为线性升温程序下的脱附反应过程,因此脱附温度与脱附时间的函数可用式(2)表示。

式中,T0为初始脱附温度,K;λ为升温速率,K/ min。将式(2)代入式(1)得:

对式(3)两端取对数并变换得:
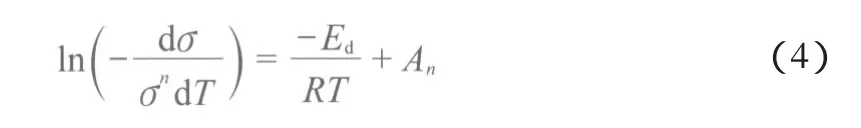
式中,σ为表面吸附量,mol,且σ=Vmθ;kn和An为常数(n=0,1,2,3)。脱附温度为T时的σ可由IR谱图实时得到,对轨迹图进行微分处理,可得对T的曲线。在确定反应级数的前提下,用ln(-dσ/(σndT))对T-1做图,并对结果进行线性拟合,可根据其斜率与R的乘积求得碱性探针分子在催化剂酸中心上的脱附活化能,然后用做图法求得反应级数。
2 结果与讨论
2.1 吡啶在酸中心上的吸附
HY分子筛在不同温度下吸附吡啶的IR谱图见图1。
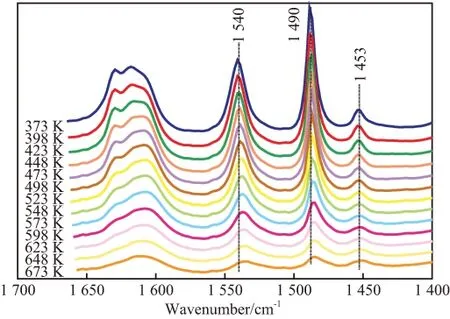
图1 HY分子筛在不同温度下吸附吡啶的IR谱图Fig.1 IR spectra of pyridine adsorbed on HY zeolite at different temperature.
由图1可见,当吡啶吸附于HY分子筛表面时,质子化吡啶的吸收峰位于1 540 cm-1附近,归属于B酸中心吸附吡啶的特征峰,可用来表征HY分子筛表面的B酸中心;络合态吡啶的吸收峰位于1 453 cm-1附近,归属于L酸中心吸附吡啶的特征峰,可用来表征HY分子筛表面的L酸中心。在TPD过程中,对峰面积进行连续积分,可得到酸中心上吡啶吸附量随脱附时间变化的曲线,将脱附时间参照升温速率和初始脱附温度转换为对应的脱附温度,可以得到B酸中心和L酸中心上吡啶表面吸附量随脱附温度的分布曲线(见图2)。

图2 HY分子筛中B酸中心和L酸中心上吡啶表面吸附量随脱附温度的分布曲线Fig.2 Surface adsorption quantity(σ) of pyridine on the B acid sites and L acid sites of HY zeolite at different desorption temperature(T).
2.2 吡啶在B酸中心上的脱附
吡啶从HY分子筛B酸中心脱附,分别在n=0,1,2,3时,尝试用ln(-dσ/(σndT))对T-1做图并进行线性拟合,结果见图3和表1。由图3和表1可见,当n=1时,线性相关结果均为负相关,且线性相关系数的绝对值最大,拟合标准偏差最小,可以判定吡啶在HY分子筛B酸中心上的TPD反应为一级反应。由图3还可见,当n=1时,HY分子筛表面同时存在两种强度不同的B酸中心,因此拟合计算了一级脱附反应的脱附活化能,计算结果见图4。

图3 HY分子筛B酸中心脱附吡啶时ln(-dσ/(σndT))与T-1的关系Fig.3 ln(-dσ/(σndT)) vs. T-1for the desorption of pyridine from the B acid sites of HY zeolite.

表1 HY分子筛B酸中心上脱附吡啶时用不同脱附反应级数线性拟合ln(-dσ/(σndT))与T-1关系的结果Table 1 Linear fitting results of ln(-dσ/(σndT)) vs. T-1for the desorption of pyridine from the B acid sites of HY zeolite

图4 HY分子筛B酸中心脱附吡啶时一级脱附反应的脱附活化能Fig.4 Activation energy(Ed) of the first order desorption reaction for the desorption of pyridine from B acid sites of HY zeolite.
由图4可知,吡啶在这两种B酸中心上的脱附活化能分别为32.4,18.6 kJ/mol。
2.3 吡啶在L酸中心上的脱附
吡啶从HY分子筛L酸中心上脱附,分别在n=0,1,2,3时,尝试用ln(-dσ/(σndT))对T-1做图并进行线性拟合,结果见图5和表2。由图5和表2可见,只有当n=3时,线性相关结果均为负相关,故可判定吡啶在HY分子筛L酸中心上的TPD反应为三级反应。由图5还可见,当n=3时,HY分子筛表面同时存在两种不同强度的L酸中心,因此拟合计算了三级脱附反应的脱附活化能,计算结果见图6。由图6可见,吡啶在这两种L酸中心上的脱附活化能分别为24.9,5.3 kJ/mol。

图5 HY分子筛L酸中心上脱附吡啶时ln(-dσ/(σndT))与T-1的关系Fig.5 ln(-dσ/(σndT)) vs. T-1for the desorption of pyridine from the L acid sites of HY zeolite.
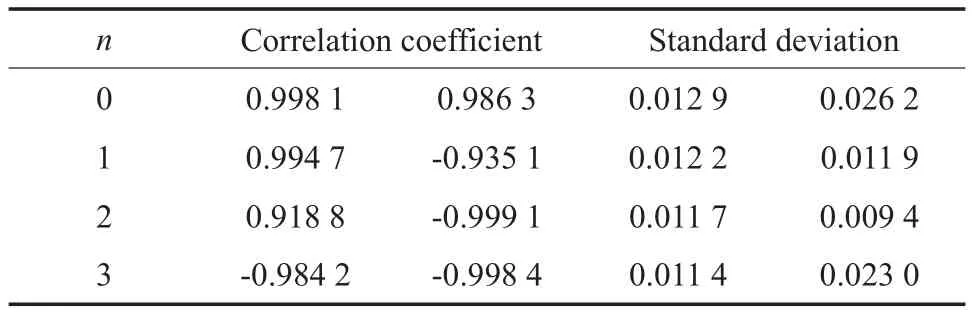
表2 HY分子筛L酸中心脱附吡啶时以不同脱附反应级数线性拟合ln(-dσ/(σndT))与T-1关系的结果Table 2 Linear fitting results of ln(-dσ/(σndT)) vs. T-1for the desorption of pyridine TPD from the L acid sites of HY zeolite

图6 HY分子筛L酸中心上脱附吡啶时三级脱附反应的脱附活化能Fig.6 Edof the third order desorption reaction for the desorption of pyridine from L acid sites of HY zeolite.
根据L酸的形成机理[23],具有桥式羟基的氢型分子筛脱羟基形成L酸中心,这一脱羟基过程同时包含骨架铝的脱除过程,从而在分子筛表面形成复杂的骨架外铝物种,如AlO+、AlxOyn+、电中性的氧化铝、各类水合氧化铝等。本实验结果表明,吡啶在HY分子筛的外表面及超笼内,存在两种不同强度的L酸中心,两种脱附活化能对应两种不同的骨架外脱铝物种。
3 结论
1)吡啶在HY分子筛B酸中心上的TPD反应符合一级动力学模型,HY分子筛表面存在两种不同强度的B酸中心,对应的吡啶脱附活化能分别为32.4,18.6 kJ/mol。
2)吡啶在HY分子筛L酸中心上的TPD反应符合三级动力学模型,HY分子筛表面同时存在两种不同强度的L酸中心,对应的吡啶脱附活化能分别为24.9,5.3 kJ/mol。
[1]Yori J C,Krasnogor L M,Castro A A. Correlation Between Acid Strength(H0) and Ammonia Desorption Temperature for Aluminas and Silica-Aluminas[J]. React Kinet Catal Lett,1986,32(1):27 - 32.
[2]Furuta S,Matsuhashi H,Arata K. Catalytic Action of Sulfated Tin Oxide for Etherification and Esterification in Comparison with Sulfated Zirconia[J]. Appl Catal,A,2004,269(1/2):187 - 191.
[3]Yin Changlong,Liu Chenguang. Hydrodesulfurization of Cracked Naphtha over Zeolite-Supported Ni-Mo-S Catalysts[J]. Appl Catal,A,2004,273(1/2):177 - 184.
[4]Sang Shiyun,Chang Fuxiang,Liu Zhongmin,et al. Difference of ZSM-5 Zeolites Synthesized with Various Templates[J]. Catal Today,2004,93(1):729 - 734.
[5]Liu Conghua,Gao Xionghou,Zhang Zhongdong,et al. Surface Modification of Zeolite Y and Mechanism for Reducing Naphtha Olefin Formation in Catalytic Cracking Reaction[J]. Appl Catal,A,2004,264(2):225 - 228.
[6]Umansky B S,Hall W K. A Spectrophotometric Study of the Acidity of Some Solid Acids[J]. J Catal,1990,124(1):97 - 108.
[7]Blasco T,Corma A,Martinez-Triguero J. Hydrothermal Stabilization of ZSM-5 Catalytic Cracking Additives by Phosphorus Addition[J]. J Catal,2006,237(2):267 - 277.
[8]朱玉霞,林伟,田辉平,等. 固体酸催化剂酸性分析方法的研究进展[J]. 石油化工,2006,35(7):607 - 614.
[9]Liu Xinmei,Yan Zifeng. Optimization of Nanopores and Acidity of USY Zeolite by Citric Modification[J]. Catal Today,2001,68(1/3):145 - 154.
[10]Ivanova E,Hadjiivanov K,Pzwigaj S,et al. FTIR Study of CO and NO Adsorption on a VSiBEA Zeolite[J]. Microporous Mesoporous Mater,2006,89(1/3):69 - 77.
[11]Kotrla J,Kubelkova L. Activation of Reactants by Hydroxyl Groups of Solid Acids:An FTIR Study[J]. Stud Surf Sci Catal,1995,94(1):509 - 516.
[12]Venkov T,Fajerwerg K,Delannoy S,et al. Effect of the Activation Temperature on the State of Gold Supported on Titania:An FTIR Spectroscopic Study[J]. Appl Catal,A,2006,301(1):106 - 114.
[13]Li Quanzhi,Xue Zhiyuan,Zhu Leiming,et al. The Measurement of Activation-Energies of Desorption of Ammonia Adsorbed on H-Mordenite by an Advanced IR-TPD Technique[J]. Acta Chim Sinica,1989,47(10):947 - 951.
[14]Li Quanzhi,Zhang Ruiming,Xue Zhiyuan. Studies on the Surface Acidity of HY Zeolite by Combined IR and TPD[J]. Stud Surf Sci Catal,1986,28(1):487 - 494.
[15]King D A. Thermal Desorption from Metal Surfaces:A Review[J]. Surf Sci,1975,47(1):384 - 402.
[16]Falconer J L,Madix R J. The Kinetics and Mechanism of the Autocatalytic Decomposition of HCOOH and CO Desorption from Ni(110)[J]. Surf Sci,1975,48(2):393 - 405.
[17]Olson D H,Dempsey E. The Crystal Structure of the Zeolite Hydrogen Faujasite[J]. J Catal,1969,13(2):221 - 223.
[18]Czjzek M,Jobic H,Fitch A N,et al. Direct Determination of Proton Positions in DY and HY Zeolite Samples by Neutron Powder Diffraction[J]. J Phys Chem,1992,96(2):1535 - 1540.
[19]Eichler U,Brandle M,Sauer J. Predicting Absolute and Site Specific Acidities for Zeolite Catalysts by a Combined Quantum Mechanics/Interatomic Potential Function Approach[J]. J Phys Chem B,1997,101(48):10035 - 10050.
[20]Brandle M,Sauer J. Combining Ab InitioTechniques with Analytical Potential Functions:A Study of Zeolite-Adsorbate Interactions for NH3on H-Faujasite[J]. J Mol Catal A:Chem,1997,119(1/3):19 - 23.
[21]Hill J R,Freeman C M,Delley B. Bridging Hydroxyl Groups in Faujasite:Periodic vs Cluster Density Functional Calculations[J]. J Phys Chem A,1999,103(19):3772 - 3777.
[22]Suzuki K,Katada N,Niwa M. Detection and Quantitative Measurements of Four Kinds of OH in HY Zeolite[J]. J Phys Chem C,2007,111(2):894 - 900.
[23]Kuhl G H. The Coordination of Aluminum and Silicon in Zeolites as Studied by X-Ray Spectrometry[J]. J Phys Chem Solids,1977,38(11):1259 - 1263.
(编辑 李明辉)
Kinetics of Pyridine Desorption from Acid Sites on HY Zeolite and Characterization of Its Acid Strength
Wang Bin1,2,Zhang Ying2,Zuo Min2,Guo Guangsheng1
(1. State Key Laboratory of Chemical Resource Engineering,Beijing University of Chemical Technology,Beijing 100029,China;2. SINOPEC Beijing Research Institute of Chemical Industry,Beijing 100013,China)
The desorption kinetics of pyridine from the B acid sites and L acid sites on HY zeolite was studied by means of an improved temperature programmed desorption-infrared spectrum(TPD-IR) technique. The desorption activation energy of pyridine as probe molecules adsorbed on the B acid sites or L acid sites was calculated using a new desorption kinetics model to determine the type and strength of the acid sites. The results indicated that the temperature programmed desorption process of pyridine adsorbed on the B acid sites fitted well into the mechanism of the first order desorption reaction. The B acid sites were divided into two types with the desorption activation energies of 32.4 kJ/mol and 18.6 kJ/mol. The temperature programmed desorption process of pyridine adsorbed on the L acid sites of the HY zeolite accorded with the third order desorption reaction kinetics. There were two types of the L acid sites on the HY zeolite with the desorption activation energies of 24.9 kJ/mol and 5.3 kJ/mol.
HY zeolite;pyridine;temperature programmed desorption-infrared spectrum technique;desorption kinetics;acid strength
1000 - 8144(2014)03 - 0264 - 05
TQ 032.47
A
2013 - 10 - 20;[修改稿日期]2013 - 12 - 08。
王斌(1980—),男,河南省南阳市人,博士生,高工,电话 010 - 59202126,电邮 wangbin.bjhy@sinopec.com。
中国石油化工股份有限公司资助项目(410001)。

