后颅窝血管畸形出血的外科治疗
张毅,李则群,龙彦笑,钟鸣,鲁祥和,郑伟明
(温州医科大学附属第一医院 神经外科,浙江 温州 325015)
血管畸形是自发性后颅窝出血的常见病因,其基本类型有动静脉畸形、静脉畸形、海绵状血管瘤、毛细血管扩张、动静脉瘘等。外科治疗包括手术切除、血管内治疗和立体定向放射治疗。不同类型的血管畸形其临床表现、外科处理方式和预后也各不相同。现对我科2008年1月至2012年3月经手术治疗的24例血管畸形作回顾性分析,报告如下。
1 临床资料
1.1 一般资料 本组共24例,男18例,女6例,年龄9~64岁(中位年龄25.2岁)。所有患者均为急性起病,7例为蛛网膜下腔出血,17例为后颅窝血肿,格拉斯哥昏迷评分(Glascow Coma Scale,GCS):13~15分18例,9~12分3例,3~8分3例。本组包括动静脉畸形15例,毛细血管扩张1例,静脉畸形2例,硬脑膜动静脉瘘6例。血肿在小脑半球者14例,位于小脑蚓部者3例,同时并发血肿破入脑室者2例,脑积水者5例。
1.2 辅助检查 入院后均行头颅CT检查,19例同时行CT血管造影(computer tomographic angiography,CTA)检查,其余5例未行CTA检查(2例出现脑疝,3例因脑积水急诊行脑室外引流手术)。17例术前行数字减影血管造影(digital subtraction angiog-raphy,DSA)检查,诊断动静脉畸形9例,毛细血管扩张1例,静脉畸形1例,硬脑膜动静脉瘘6例。
1.3 手术治疗 本组手术治疗方式分以下几种:①未行血管造影直接开颅进行血肿清除加畸形血管切除,本组2例;②先行脑室外引流降低颅压,再行CTA或DSA检查明确出血原因,二期清除血肿和切除病变,本组3例;③入院即刻行CTA或DSA检查明确出血原因,采用手术或血管内治疗或放射治疗。本组17例行开颅手术,13例采用枕下正中或旁正中入路,3例采用乙状窦后入路,1例采用远外侧入路(颅颈交界区硬脑膜动静脉瘘);7例行血管内治疗,其中5例为硬脑膜动静脉瘘(见图1),2例为动静脉畸形。
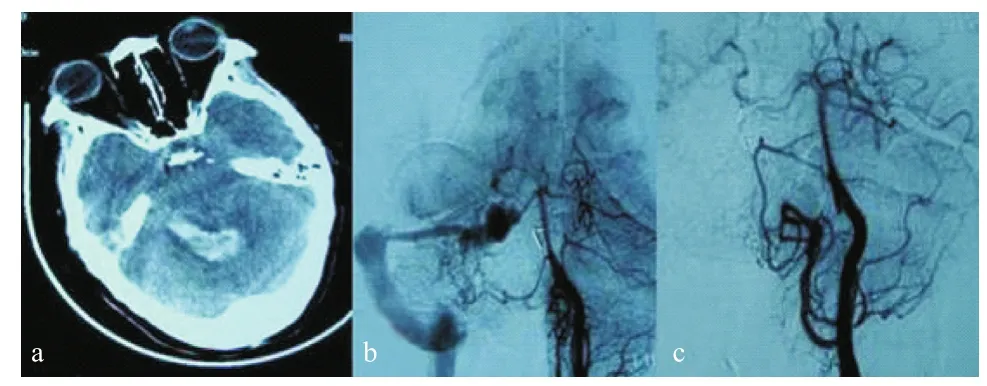
图1 天幕区硬脑膜动静脉瘘致后颅窝血肿病例
1.4 结果 本组1例动静脉畸形破裂出血患者术前深昏迷,术后死亡;1例静脉畸形患者术前脑疝、术后生命体征不稳定自动出院;其余患者术后无并发症发生,20例患者出院格拉斯哥预后评分(Glascow Outcome Scale,GOS)5分,改良Ranking评分0分,2例患者出院GOS 5分,改良Ranking评分1分。本组患者随访期(3~54个月)内无再出血事件发生,随访后GOS 5分。
2 讨论
血管畸形破裂是自发性后颅窝出血的主要原因之一,具有不同于高血压、动脉瘤所致出血的临床特点:如动静脉畸形、静脉畸形发病年龄轻,无高血压病史,多表现为脑实质内出血,而硬脑膜动静脉瘘常发生于天幕区、颅颈交界区,主要表现为蛛网膜下腔出血。各种血管畸形具有其独特的病理生理,其手术目的也各不相同,如动静脉畸形、硬脑膜动静脉瘘要求清除血肿和完全消除病变,而静脉畸形最有效的治疗方法是显微外科手术,以清除血肿减轻后颅窝内占位为主要目的,对出血的畸形静脉血管只电凝出血点压迫止血即可,不宜切除畸形病变[1]。毛细血管扩张出血临床较为罕见,多发生于后颅窝小脑及桥脑位置,病理切片表现为诸多细小扩张的毛细血管壁,其间夹杂正常脑组织,没有异常的供血动脉及粗大的引流静脉,出血量较动静脉畸形少,患者临床症状相对较轻。手术要求一期全部切除,切除不全会导致残留扩张的毛细血管血流改变,引起再次出血[2]。
血管畸形破裂出血量较动脉瘤破裂少,多为脑实质出血,但由于后颅窝容积小,患者病情变化更快也更危急。后颅窝血肿量较少、患者没有明显脑积水症状时,病情一般较为稳定;当血肿量较大时,血肿本身和继发性水肿的占位一方面可以直接压迫脑干引发患者意识障碍,另一方面发生枕骨大孔疝导致呼吸骤停。如果继发中脑导水管梗阻引起梗阻性脑积水,则将使颅内压增高,加重原有病情[3]。本组病例中2例因小脑内血肿较大致脑疝,3例因急性脑积水致病情恶化而未行颅内血管检查直接接受急诊手术。虽然目前多数人认为当血肿量大于10 mL时应早期予手术治疗,文献报道后颅窝血肿手术治疗预后与手术时间相关,早期手术治疗患者预后更好[4],但高度怀疑血管畸形出血者,患者神志清醒,生命体征稳定,术前CTA先行检查可以有效地明确血管畸形大小、位置及供血动脉情况,有助于采取正确的手术方案,增加手术安全性,减少手术并发症,改善患者预后。
后颅窝血管畸形中,最常见的是动静脉畸形。CTA、磁共振血管成像(magnetic resonance angiography,MRA)、DSA是目前诊断动静脉血管畸形的主要检查手段。患者入院后立即行CT平扫可以明确出血位置及出血量,判断是否需即刻急诊手术,但对颅内畸形血管不能明确显示,尤其后颅窝的血管畸形,检出率更低。在不清楚血管畸形大小和位置的情况下,仅凭CT平扫的结果进行血肿清除手术,极易导致骨窗开放大小不足,不能完全暴露血管畸形边界,更无法明确供血动脉、引流静脉的位置,造成术中大出血、血管畸形残留甚至患者术中死亡等危险。CTA与MRA可以清楚显示动静脉畸形的供血动脉、引流静脉及血肿与畸形血管团的位置关系,确诊率与DSA较接近。CTA检查由于耗时短,操作简便,对动静脉畸形确诊率较高,急诊入院患者生命体征稳定时,应首选CTA明确诊断。MRA操作时间较长,但检查后颅窝血管畸形时无骨伪影的影响,可以为下一步介入栓塞、手术或者伽马刀等进一步治疗提供帮助,对静脉畸形也可明确诊断,而海绵状血管瘤则主要依靠MRI诊断,以确定手术入路及手术方式。毛细血管扩张在平扫T1加权像上表现为低或等信号,在T1增强像上呈轻度增强,可以看到筛孔样毛细血管改变,但仍需病理学检查以明确诊断。DSA是诊断动静脉畸形、动静脉瘘及静脉畸形的金标准,可以明确畸形血管范围大小、供血及引流,动静脉瘘的瘘口及瘘口周边血管情况,还可以准确显示静脉瘘口的位置以及是否存在“危险吻合”,为手术选择提供依据。但因操作时间长,对于出血量较大、神志不清的患者不宜作为确诊的首要检查方法。
后颅窝血管畸形出血依据病因和患者的临床特点可分为三大类:①脑干压迫和急性脑积水表现,生命体征不稳定;②血肿量较大(大于10 mL),但生命体征尚平稳;③无占位效应且生命体征平稳。针对第一类首先需急诊解除脑干压迫和脑积水,挽救患者生命,应迅速降低颅压,缓解脑组织受压。先行血肿清除、脑室外引流术,并去除骨瓣,待病情稳定后行CTA、DSA检查以明确血管畸形大小和位置,二期手术完全切除或栓塞血管畸形;第二类可以急诊行CTA检查,对血管畸形有较准确的诊断,然后急诊手术清除血肿的同时根据疾病特点行病因治疗,以求完全切除病灶,如完全切除动静脉畸形;对于第三类患者,DSA、MRA明确诊断,然后做相应的手术治疗。动静脉畸形可以行栓塞术或者开颅畸形血管切除术,手术治疗要求完全清除畸形血管团,部分动静脉畸形切除不能降低再出血可能[5],部分栓塞动静脉畸形可能改变原有动静脉畸形的血流动力学特点,增加出血可能[6],巨大、复杂的动静脉畸形,手术中完全切除较困难时,可先行部分栓塞,以减小动静脉畸形大小、尽可能栓塞供血动脉为目的,再行手术切除,可以达到减少术中出血量、完全切除畸形血管团的目的。如不能完全切除的,可术后再行立体定向放射治疗。因放射治疗后血管内皮细胞增生需要数月时间,手术中还应尽量切除畸形血管团减少再出血概率。后颅窝静脉畸形由于致残率、致死率低,很少再出血,具有良性自然史,治疗应着眼于出血或血栓形成的并发症而并非切除静脉畸形。手术策略应采取血肿清除、去骨瓣减压、脑室外引流术等缓解颅内高压即可[4,7],强行切除静脉畸形将可能导致严重脑水肿。硬脑膜动静脉瘘则通过栓塞或手术夹闭瘘口,术前DSA明确瘘口位置及是否存在危险吻合尤为重要。血管内介入治疗使用Onxy胶栓塞瘘口疗效确切,患者创伤小,益处较开颅手术大。如有多个瘘口无法完全栓塞或因危险吻合致动静脉瘘残留还可二期行γ刀治疗[8]。毛细血管扩张由于没有明显供血动脉存在,出血量一般较少,患者症状相对较轻,CT仅表现为脑内血肿,术中可见扩张的毛细血管团与正常脑组织混杂,确诊需依靠术后病理确诊,手术切除要求完全切除扩张毛细血管团,如未能完全清除,可因扩张的毛细血管内血流改变引起再次出血。
后颅窝血管畸形出血是临床常见的一种危重病变,其临床特点和出血原因各异,合理正确的、个体化的诊疗有助于提高疗效,改善预后。

