骨骼病变为首发表现的急性淋巴细胞白血病1例
邹春华,谢勇久,王 绎,明 华,黄涛金,林 争
骨骼病变为首发表现的急性淋巴细胞白血病1例
邹春华,谢勇久,王 绎,明 华,黄涛金,林 争
急性淋巴细胞白血病;骨骼病变
1 病例报告
患者,男,33岁,因全身多处游走性疼痛于2012-11行X线片及CT检查,提示颈椎、肱骨、髂骨、股骨骨质破坏,股骨头见小囊状骨质破坏( 图1)。以多发性骨髓瘤(multiple myeloma,MM)收入我科。骨髓穿刺涂片检查考虑为急性淋巴细胞性白血病(acute lymphoblastic leukemia, ALL)。组织化学染色提示:过氧化物酶阴性,糖原染色阳性,糖原原始细胞积分高,醋酸萘酚酯酶染色阴性。流式细胞学检查:主要可见原始细胞群、成熟淋巴细胞群和粒系细胞群,原始细胞约占有核细胞32%,表达CD34、HLA-DR、CD19、CD10和CD13(部分阳性),少数细胞表达CD20、CD38,不表达cIgM、cCG79a,不表达cCD3、CD5、CD33和cMP0。骨髓活检:有核细胞核脂肪比值为2∶1,部分为中等偏小幼稚细胞。基因检测提示BCR-ABL融合基因阳性。综合诊断为B淋巴细胞系急性淋巴细胞性白血病L2(B-ALL-L2)。给予长春新碱、柔红霉素、环磷酰胺和泼尼松联合进行诱导缓解治疗,化疗方案6周期,预防性鞘内注射甲氨喋呤6次,最后一次化疗完成于2013-05。转入维持治疗(甲氨喋呤和巯嘌呤与泼尼松和长春新碱交替治疗)。期间于2013-01骨髓穿刺检查仅见3%幼稚淋巴细胞,评估为缓解。2013-05骨髓穿刺检查仅见1%幼稚淋巴细胞,评估为缓解。治疗过程中患者游走性疼痛症状减轻,PTH 2610 ng/L ,血钙 2121 mmol/L。2013-05 CT检查仍示胸椎多个椎体融骨性骨质破坏。2013-07患者双侧髋关节疼痛,逐渐加重,给予膦酸盐类药物治疗。患者开始口服伊马替尼。2013-08再次复查CT仍示双侧髂骨及股骨骨质破坏(图2)。继续止痛及膦酸盐类药物治疗,患者疼痛症状减轻。2014-04患者骨髓检查呈示缓解。

图1 骨骼病变为首发临床表现的成人急性淋巴细胞白血病治疗前影像
2 讨 论
ALL是常见的恶性血液系统疾病,发病多为幼儿及青年。在成年急性白血病占15%~25%。成年ALL患者生物学特征多样,临床异质性大[1]。增生的白血病细胞过氧化酶染色阴性 ,非特异性酯酶染色阴性,糖原染色阳性颗粒呈红色粗粒状或弥漫状。2008世界卫生组织将ALL归入前体淋巴细胞肿瘤并且进行了新的以分子生物学及遗传学为基础的分类[2]。60%以上的急性淋巴细胞白血病存在遗传学异常,更多的患者具有能够检测的分子生物学及分子遗传学异常[3]。成人ALL以多发骨骼病变为首发临床主要表现的少有报道。本例发病时无出血,无肝、脾、淋巴结肿大等急性白血病的典型症状和体征,血常规无明显异常,而以多发骨骼病变为主要临床表现,故被误诊为MM。MM除相关靶器官损害外,骨髓中单克隆浆细胞比例≥10%和(或)组织活检证明有浆细胞瘤,另血清和(或)尿出现单克隆M蛋白,有利于鉴别诊断[4]。本例骨损害发生在末梢血液改变之前,而骨痛作为白血病的首发症状,因此X 线骨骼检查作为辅助诊断,及时行骨髓穿刺检有助于明确诊断。
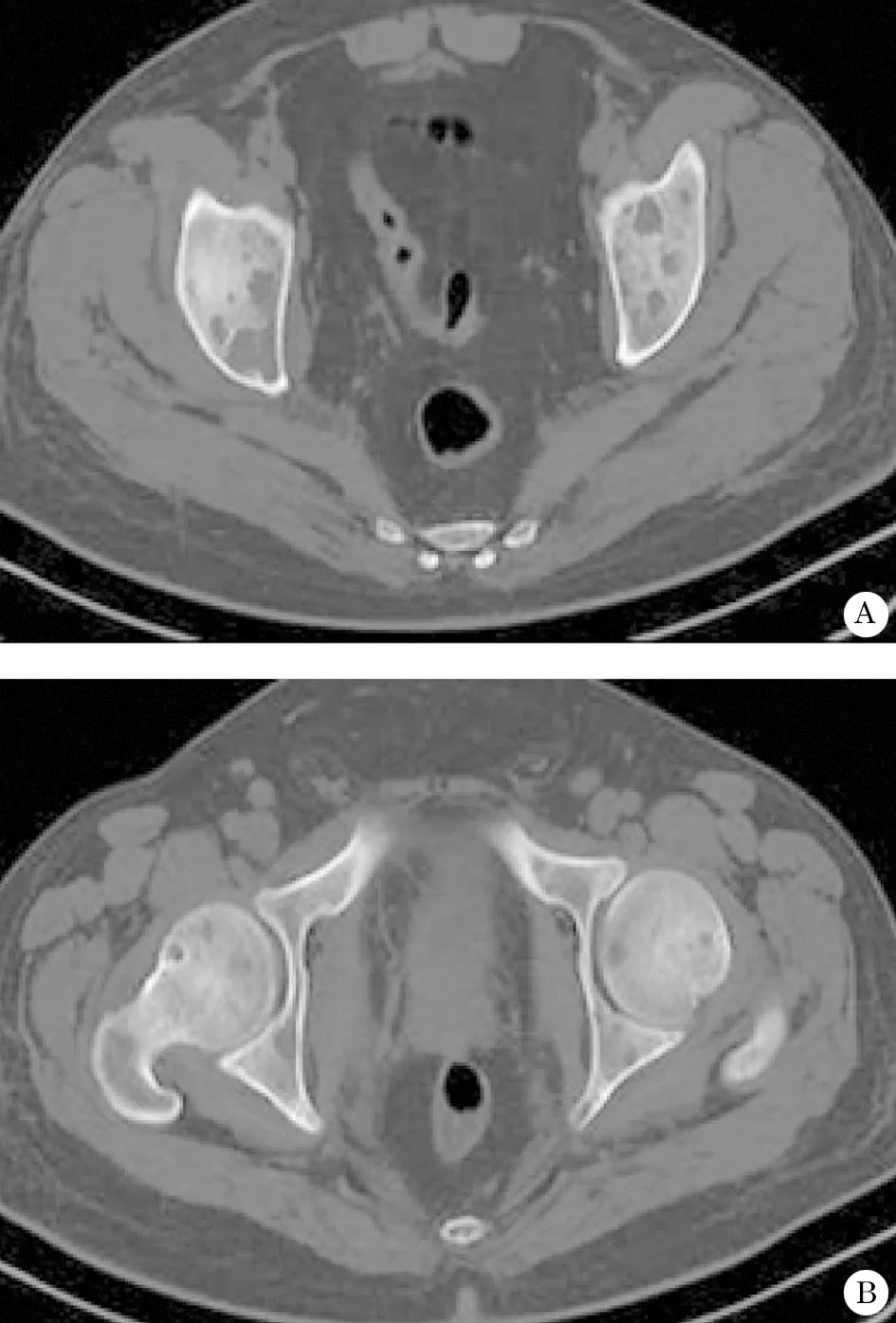
图2 骨骼病变为首发临床表现的成人急性淋巴细胞白血病治疗10个月后影像
白血病细胞多在红髓丰富的部位增殖 ,故病变多发生在颅骨、 胸骨、 脊柱、 髂骨等处。当白血病细胞在骨髓腔内异常增生、骨膜下浸润时均可引起骨痛,X 线检查显示病变呈斑点状、筛孔状以至虫蚀状改变[5,6]。目前引起骨坏死确切发病机制尚不清楚,ALL可能通过多种机制造成的骨代谢损伤、骨骼病变,尚需进一步探索[7,8]。
双膦酸盐具有抗骨吸收作用,已广泛用于癌性骨转移及多发性骨髓瘤骨病等的治疗[9]。20例ALL并发骨坏死患者经唑来膦酸(zoledronic acid)治疗13个月,5例疼痛完全消失,10例只有不定期疼痛,说明唑来膦酸有很好的耐受性和缓解疼痛作用[10]。文献[11]表明,双膦酸盐类药物可能会减轻骨坏死相关的疼痛及延缓患者运动功能丧失,该研究也显示ALL伴有骨质破坏的患者,无需外科干预,治疗原发病后其骨痛即可缓解。本例以骨骼病变为首发临床表现的成人ALL,经对原发病化学药物治疗及相关症状的对症治疗,患者骨痛缓解,但CT检查显示骨质破坏影像并无明显改变。不能除外治疗过程中皮质激素对ALL骨质破坏起促进作用。
关于ALL骨骼疾病的预后大多在儿童患者中开展,但结果令人失望,在成人ALL则鲜有报道,其预后尚不清楚。骨骼疾病在成人ALL患者是否为独立预后因素,与缓解率、持续缓解期、总体生存率是否相关尚不明了。
[1] 秘营昌.中国成人急性淋巴细胞白血病诊断与治疗专家共识——诊断和预后分组解读[J].中华血液学杂志,2013,34(11):994-996.
[2] Swerdlow S H, Campo E, Harris N L,etal. WHO classification of tumours of haematopoietic and lymphoid tissues [M]. Lyon: Iarc Press, 2008:167-178.
[3] 袁 田,秘营昌.成年人急性淋巴细胞白血病基因组学研究进展[J].国际输血及血液学杂志,2012,35(6): 521-524.
[4] 中国医师协会血液科医师分会,中华医学会血液学分会,中国多发性骨髓瘤工作组.中国多发性骨髓瘤诊治指南(2013年修订)[J].中华内科杂志, 2013,52(9): 791-795.
[5] Riccio I, Marcarelli M, Del Regno N,etal. Musculoskeletal problems in pediatric acute leukemia[J]. J Pediatr Orthop B, 2013, 22(3): 264-269.
[6] Ganesan P, Thulkar S, Gupta R,etal. Childhood aleukemic leukemia with hypercalcemia and bone lesions mimicking metabolic bone disease [J]. J Pediatr Endocrinol Metab, 2009, 22(5): 463-467.
[7] Kawedia J D, Kaste S C, Pei D,etal. Pharmacokinetic, pharmacodynamic, and pharmacogenetic determinants of osteonecrosis in children with acute lymphoblastic leukemia [J]. Blood, 2011, 117(8): 2340-2347.
[8] Te Winkel M L, Pieters R, Hop W C,etal. Prospective study on incidence, risk factors, and long-term outcome of osteonecrosis in pediatric acute lymphoblastic leukemia[J].J Clin Oncol,2011,29(31):4143-4150.
[9] Fleisch H. Bisphosphonates: mechanisms of action [J]. Endocr Rev, 1998, 19 (1): 80-100.
[10] Padhye B, Dalla-Pozza L, Little DG,etal. Use of zoledronic acid for treatment of chemotherapy related osteonecrosis in children and adolescents: a retrospective analysis [J]. Pediatr Blood Cancer, 2013, 60(9): 1539-1545.
[11] Leblicq C, Laverdière C, Décarie J C,etal. Effectiveness of pamidronate as treatment of symptomatic osteonecrosis occurring in children treated for acute lymphoblastic leukemia [J]. Pediatr Blood Cancer, 2013, 60(5):741-747.
(2014-04-25收稿 2014-06-10修回)
(责任编辑 武建虎)
邹春华,本科学历,主任医师,E-mail: zouchun_hua@163.com
610041, 武警四川总队成都医院血液肿瘤科
R733.71

