人肝癌多药耐药细胞系Bel-7402/DOX两种模型比较
钟兴国,龚仁华,孙登群,曹葆强,范育林,姜世涛,蔡 军,何新苗,骆会来
人肝癌多药耐药细胞系Bel-7402/DOX两种模型比较
钟兴国,龚仁华,孙登群,曹葆强,范育林,姜世涛,蔡 军,何新苗,骆会来
目的比较体外浓度梯度递增诱导和裸鼠肝脏移植诱导两种方法建立人肝癌多药耐药细胞系Bel-7402/多柔比星(Doxorubicin,DOX)模型的生物学特性。方法分别采用体外浓度梯度递增诱导和裸鼠肝脏移植诱导建立人肝癌多柔比星多药耐药细胞亚系Bel-7402/DOXV和Bel-7402/DOXL后,利用相差显微镜观察细胞,MTT法检测两种细胞的耐药性,细胞计数法绘制生长曲线并用公式法计算倍增时间,流式细胞仪测定细胞DOX的摄入和外排以及P糖蛋白(P-gp)、多药耐药相关蛋白(MRP)、谷胱甘肽硫转酶系统(GSH/GST)的表达。结果两组耐药细胞Bel-7402/DOXV和Bel-7402/DOXL对DOX、CDDP均产生了交叉耐药性,较亲本Bel-7402 IC50值差异有统计学意义(P<0.01);较亲本细胞的倍增时间明显延长,分别为65 h和46 h;较亲本的DOX外排率明显升高,分别为81.06%、66.56%;两组耐药细胞P-gp、MRP表达较亲本细胞显著提高(P<0.01),而GSH/GST的表达无明显变化。结论两种方法建立的耐药细胞系模型均有稳定的耐药性。肝脏移植法更能高度模拟人肝癌, 它是具有近似人肝癌生物学和抗癌药物动力学特征的较理想模型。
肝癌;多药耐药;多柔比星;细胞系模型
目前对于肝癌,尤其是对中晚期肝癌的治疗仍以手术及化疗相配合治疗为主。化疗在肝癌的治疗中仍占有重要地位。但是肝癌细胞对多种化疗药物产生的多药耐药(multidrug resistance, MDR)是肝癌治疗的瓶颈,因此针对耐药及其逆转策略是目前肝癌研究的热点之一。建立可靠的肿瘤MDR模型,是研究肿瘤MDR及其逆转的基础。本研究用多柔比星(Doxorubicin,DOX)通过两种常用方法建立人肝癌Bel-7402/DOX耐药细胞株,比较两者的生物学特性,从而获得较理想的耐药模型,为最终揭示临床MDR现象的本质和筛选逆转剂进行有益的探索。
1 材料与方法
1.1 材料 人肝癌细胞株Bel-7402购自上海生物研究所。4周龄BALB/c-nu/nu裸小鼠,质量12~16 g,购自上海斯莱克公司,饲养于中国科技大学生命科学院SPF动物中心。
1.2 实验方法
1.2.1 裸小鼠肝脏移植方法建立MDR细胞模型 4~6周龄雄裸小鼠共10只,水合氯醛(430 mg/kg)腹腔注射麻醉后,剑突下做一横切口,用1 ml注射器将0.2 ml Bel-7402细胞悬液(密度为1×108/ml)注入肝右叶实质内,关腹。随机分为肝原位移植瘤实验组(5只)和对照组(5只)2组,饲养于SPF条件下。于第3天开始实验组裸鼠分别予以DOX 1.5 mg/kg腹腔内注射,每周1次,共8周;对照组均腹腔注射等量的生理盐水。每天观察记录裸鼠的皮肤、反应、食欲及精神状态。肿瘤体积计算公式:V=πab2/a(a为肿瘤长径,b为肿瘤短径)。实验结束时处死裸鼠,取出瘤体,无菌下碾碎,以0.25%胰蛋白酶溶液消化细胞2~3 min制成单细胞悬液,分别接种于25 ml无菌培养瓶中原代培养、多次传代纯化后即获得肝脏移植耐药细胞株Bel-7402/DOXL(liver-implanted induction)。电镜观察标本处理:肿瘤细胞株以1%锇酸固定,树脂包埋,超薄切片,醋酸铀和枸缘酸铅双重染色后,ZEISS-902型透射电镜下观察。
1.2.2 体外诱导建立MDR模型 采用DOX浓度梯度递增诱导法,取对数生长期Bel-7402细胞5×105/ml接种于25 ml 培养瓶中,培养24 h后将培养液换为含低浓度的多柔比星(DOX 0.01 μg/ml)培养液,继续培养24 h后弃含药培养液,0.25%胰酶消化,1000 r/min离心3 min,收集细胞,按1×105/ml加入25 ml培养瓶重新接种,加不含药培养液,继续培养。待细胞生长状态良好,进入对数生长期(约2周)时提高药物浓度,提高的幅度使细胞存活60%~70%为宜。如此反复(周期约半年),直到细胞能在含0.5 μg/ml多柔比星的培养液中稳定生长增殖,将该细胞亚系命名为Bel- 7402/DOXV(vitro induction)。
1.2.3 MTT法检测细胞对药物的敏感性 取对数期3组细胞(亲本及两组耐药细胞)制备细胞悬液,调整细胞浓度为5×105/ml,接种至96孔培养板,每孔200 μl(相当于105个细胞),培养24 h后加入试验药物DOX、CDDP、MMC、MTX、5-FU。药物浓度参照各药临床用量的血峰浓度,上下各浮动103倍,设7个试验浓度,即103、102、101、100、10-1、10-2、10-3倍血峰浓度,另设不加药的对照组,每个实验浓度设置5个复孔。37 °C、5%CO2继续培养24 h,每孔加入MTT(5 mg/ml)溶液20 μl,继续培养4 h,弃上清液终止培养,每孔加入150 μl二甲基亚砜(DMSO),震荡10 min,上酶标仪,于波长为570 nm(校正波长为630 nm)处测定光密度(OD)值,计算细胞存活率。公式: 细胞存活率=(实验孔OD值/对照孔OD值)×100%。绘图法测定药物的半数抑制浓度(IC50)。耐药指数(resistance index, RI)=耐药细胞IC50/亲本细胞IC50。MTT试验在不同日重复3次。
1.2.4 生长曲线绘制及倍增时间测定 取生长状态良好的3组细胞,用RPMI 1640完全培养液制备细胞悬液(5×103/ml),接种至六孔板中(1 ml/孔),至少接种21 孔,分别于接种后1、2、3、4、5、6、7 d,每天取3孔进行细胞计数,结果取均值,以培养时间为横坐标,细胞数为纵坐标绘制生长曲线,按Patterson公式计算细胞倍增时间: Td=tlg2/lg(Nt/N0)。Td,倍增时间(h);t,细胞数由N0增至Nt所需的时间;N0,接种时的细胞数;Nt,培养t小时后的细胞数。
1.2.5 DOX的摄入和外排 采用流式细胞术测定细胞内DOX的荧光强度,间接反映其浓度。取对数生长期3组细胞制细胞悬液(1×106/ml),加DOX至终浓度为4.0 μg/ml,CO2培养箱中放置20 min,取1 ml离心,冷PBS洗2次,重悬于0.5 ml PBS中,立即上流式细胞仪检测DOX的相对荧光强度(激发波长479 nm,发射波长587 nm)。在外排实验中,将上述细胞离心后用冷的RPMI-1640培养液冼涤,重悬于无药培养液,在CO2培养箱中放置60 min,离心,PBS冼涤,检测细胞内多柔比星相对荧光强度,方法同前。以DOX的外排率反映细胞对DOX的外排功能。DOX外排率= (摄入值-滞留值)/摄入值×100%(试验在不同时间重复5次)。
1.2.6 流式细胞仪测定P糖蛋白(P-gp) 、MDR相关蛋白(MRP)及谷胱甘肽硫转酶系统(GSH/GST)的表达 取对数生长期耐药细胞及亲本细胞 (1×108/ml) 3组,每组5管,PBS(4 ℃, 0.01 mol/L, pH7.4)清洗2遍,分别加入MRK16(MDR1)、MRPrl(MRP)、GSH/ GST鼠抗人单克隆抗体,以鼠抗人isotype-matched单克隆抗体作为对照,4 ℃孵育1 h,分别加入羊抗鼠荧光标记IgG,4 ℃孵育30 min后于流式细胞仪上进行荧光测定。
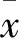
2 结 果
2.1 肝脏移植瘤耐药模型 肝脏移植瘤10只裸鼠均接种成功,实验组肿瘤平均生长速度约(3.50±0.37)mm3,对照组平均每天生长(3.70±0.41)mm3。在8周饲养及给DOX诱导的过程中,各组生长均良好,皮肤红润。实验组中有2只发生腹水,无恶病质,无死亡记录。8周后处死全部裸鼠,观察:实验组和对照组移植瘤大体形态无差异,呈椭圆形或分叶状,平均瘤重(1.48±0.21)g,肿瘤周围纤维组织包裹明显,瘤体切面呈灰白色,少数呈散在簇状分布。实验组有3只腹腔转移(图1)。
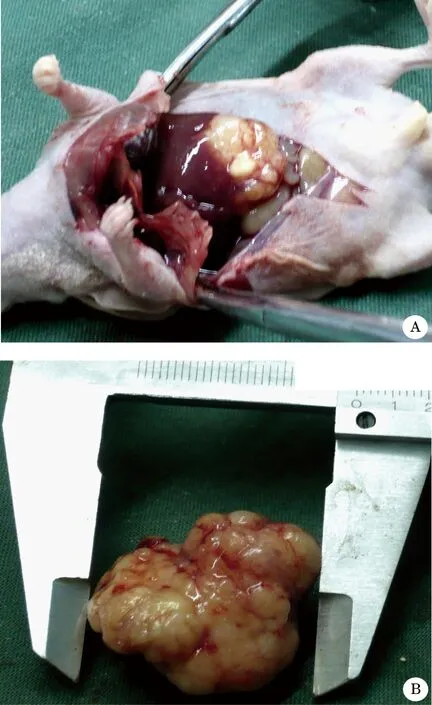
图1 肝脏移植瘤及体外瘤
2.2 细胞形态学观察 相差显微镜下观察Bel-7402细胞呈梭形,排列紧密、大小均匀、边界清楚、贴壁生长。加入药物后大部分细胞凋亡、溶解,存活的细胞大小不等,细胞轮廓欠清晰,附壁力下降,约两周后恢复生长,上述急性期变化消失。耐药细胞形态均不规则,体积稍增大,易堆积生长,胞浆内出现大量的颗粒和空泡,细胞核略皱缩。电镜观察:肿瘤细胞与人肝癌相似,移植的肝癌细胞核大、核仁深染、核膜有许多切迹(图2)。

图2 原位移植的肝癌细胞电镜照片(×10 000)
2.3 两种细胞对抗癌药的敏感性 两种耐药细胞亚系对DOX、CDDP都产生了交叉耐药性,对MMC、MTX和5-FU无交叉耐药(表1)。
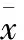
表1 Bel-7402/DOXL和Bel-7402/DOXV细胞对多种化疗药物的敏感性 (n=5;±s)
注:与Bel-7402比较,①P<0.05;与Bel-7402/DOXL比较,②P<0.05
2.4 生长曲线与倍增时间 耐药细胞较亲本细胞的倍增时间明显延长,Bel-7402、Bel-7402/DOXL和Bel-7402/DOXV倍增时间分别为39 h、46 h和65 h(图3)。

图3 人肝癌多药耐药细胞系Bel-7402/DOX细胞生长曲线
2.5 DOX的摄入和外排 各组细胞外排DOX后相对荧光强度均降低,耐药细胞较亲本更为明显, Bel-7402/DOXV对DOX的外排率最高,为(81.06±0.20)%(表2)。
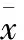
表2 各细胞DOX摄入和外排后的相对荧光强度 (n=5;±s)
注:与Bel-7402比较,①P<0.05;与Bel-7402/DOXL比较,②P<0.05
2.6 P-gp、MRP、GSH/GST表达的变化 两组耐药细胞的P-gp、MRP表达较亲本均明显提高(P<0.01),GSH/GST的表达在3组中比较,差异均无统计学意义(表3)。

表3 流式细胞仪分析P-gp、MRP及GSH/GST荧光细胞染色率 (n=5;
注:与Bel-7402比较,①P<0.05;与Bel-7402/DOXL比较,②P<0.05
3 讨 论
手术切除仍是肝癌治疗的最佳选择[1,2]。但是肝癌早期诊断率低,病情发展快,约60%以上肝癌确诊时已经发生临床或镜下转移[3],因此化疗等非手术治疗比手术治疗更有实用价值,但MDR的存在严重影响了肝癌的化疗效果,而进行这方面的研究离不开建立可靠的MDR细胞模型[4]。目前,人肝癌细胞MDR模型的建立多采用体外培养诱导肿瘤MDR、MDR基因转染及裸鼠移植模型诱导耐药等方法。体外培养诱导肿瘤MDR又包括药物浓度梯度递增法、高浓度药物间歇诱导法两种[5,6]。裸鼠体内移植诱导耐药方法包括皮下移植、肝脏移植和腹腔移植三种。各种方法各有优缺点,本实验旨在筛选哪种耐药细胞系是研究肝癌耐药机制的理想模型,为后续研究耐药本质及逆转奠定基础。
导致肿瘤细胞MDR的原因主要与P-gp、MRP、LRP、GST、谷胱甘肽和谷胱甘肽S-转移酶、蛋白激酶C、调亡相关基因(bcl-2、c-myc、p53)、GCS的高表达、癌细胞生活环境及DNA拓扑异构酶Ⅱ活性的改变等有关[7]。由于肿瘤的耐药机制错综复杂, MDR细胞耐药表型具有细胞特异性,诱导药物、诱导方式不同,所得耐药表型不尽一致。本实验将两种常用方法建立的两种人肝癌多柔比星MDR细胞亚系模型进行比较。总结如下:
两种耐药细胞在形态学方面均呈不规则,体积比亲代稍增大,生长速度变慢,易堆积生长,细胞膜边界模糊,胞浆内出现大量的颗粒和空泡,细胞核略皱缩。体外诱导耐药细胞差异较明显,体内移植诱导耐药细胞形态接近于亲本。
浓度梯度递增法建立的耐药细胞模型具有更高的耐药倍数,两者对DOX的RI分别为112.88和22.45,对CDDP的RI分别为13.73和25.69,两种细胞对MMC、MTX和5-FU无交叉耐药,因此提示体外浓度梯度递增法更容易使细胞产生耐药表型。两种耐药细胞较亲本细胞的倍增时间均明显延长,倍增时间分别为39 h、46 h和65 h,可以看出体外浓度梯度递增法耐药细胞系生长速度及增殖能力明显低于体内诱导法。
在耐药机制方面,药物外排泵介导的药物外排增多是最常见的耐药机制之一[8]。本研究显示,亲本及二者对DOX的外排率分别为34.14%、66.56%和81.06%,耐药细胞对DOX的外排率明显增高,表现为药物的滞留减低,从而使细胞内的药物浓度减低,减少药物对细胞靶器官的损伤,推测这是导致其耐药指数较高的主要原因。
两组耐药细胞P-gp、MRP的表达较亲本均显著提高,而GSH/GST的表达在两组中比较差异均无统计学意义。提示P-gp高表达可能造成细胞内DOX药物蓄积减少,从而构成耐药性的一个分子基础;MRP过度表达可能是造成细胞耐药性的另一分子基础。而肝癌细胞耐药性的形成与GSH/GST的表达无明显关系。
本研究发现,体外浓度梯度递增法建立的耐药细胞模型优势是耐药指数及稳定性均较高,但缺点在于细胞增殖能力低,同时诱导耐药过程耗时长,一般需要6个月左右时间,诱导过程也很容易引起污染。裸鼠体内诱导法建立的耐药模型优势在于细胞有较强的增殖能力,诱导过程短,一般为8周左右,且污染可能性小,缺点是耐药性及稳定性稍差。
综上所述,在两种建模方法中,裸鼠体内肝脏诱导法建立的耐药模型较为理想。首先,具备较稳定的耐药性。其次,能较准确反映临床耐药的形成过程。此建模方法与化疗过程中的给药方法非常接近,即都是在活体内短时间注入大剂量化疗药物,达到一定的血药浓度杀死癌细胞。临床上为减轻化疗药的不良反应,提高疗效,常使用大剂量短程给药方法[9]。再者,与临床耐药细胞相似,它们均有较强的增殖能力。因MDR形成而导致化疗失败的患者最终将出现原发灶的复发或转移[10],这提示在临床上出现的耐药细胞具有较强的增殖和转移能力,是在药物的作用下而选择出的有更强生存优势的肿瘤细胞群体,这类细胞能克服化疗药的抑制而正常生长增殖。此外,诱导过程短,污染可能性小,操作相对简单,也是其一大优点。
[1] Zhou X D, Tang Z Y, Yang B H,etal. Experience of 1000 patients who underwent hepatectomy for small hepatocellular carcinoma [J]. Cancer, 2001, 91(8):1479-1486.
[2] Yang J M, Kan T, Chen H,etal. Hepatectomy in the treatment of very big primary liver cancer:report of 86 cases[J]. Hepatobiliary Pancreat Dis Int, 2002, 1(1): 42-45.
[3] Pignata S, Daniele B, Gallo C,etal. Endocrine treatment of hepatocellular carcinoma, any evidence of benefit[J]. Eur J Cancer, 1998, 34(1): 25-32.
[4] Urasaki Y, Ueda T, Yoshida A,etal. Establishment of a daunorubicin-resistant cell line which shows multi-drug resistance by multifactorial mechanisms [J]. Anticancer Res, 1996, 16(2): 709-714.
[5] Yang L Y, Trujillo J M. Biological characterization of multidrug-resistant human colon carcinoma sublines induced/selected by two methods [J]. Cancer Res, 1990, 50: 3218-3225.
[6] Gottesman M M, Fojo T, Bates S E. Multidrug-resistance in cancer: role of ATP- dependent transporters [J]. Cancer, 2002, 2(1): 45-48.
[7] Sun Y L, Zhou G Y, Li K N,etal. Suppression of glucosyceramide synthase by RNA interference reverses multidrug resistance in human breast cancer cells [J]. Neoplasma, 2006, 53(1): 1-8.
[8] Ejendal K F, Hrycyna C A. Multidrug resistance and cancer: the role of the human ABC transporter ABC G2 [J]. Curr Protein Pept Sci, 2002, 3(5): 503- 511.
[9] Eckhardt S. Recent progress in the development of anticancer agents [J]. Curr Med Chem Anti Canc Agents, 2002, 2(3): 419-439.
[10] Choi J H, Lim H Y, Joo H J,etal. Expression of multidrug resistance-associated protein1, P-glycoprotein, and thymidylate synthase in gastric cancer patients treated with 5-fluorouracil and doxorubicin-based adjuvant chemotherapy after curative resection [J]. Br J Cancer, 2002, 86(10): 1578-1585.
(2014-02-28收稿 2014-04-17修回)
(责任编辑 武建虎)
本刊“临床病例讨论”栏目征稿通知
为了贯彻“面向部队,服务基层”的办刊宗旨,加强不同层次医疗机构临床实践交流,帮助基层医师学习和了解先进教学医院和知名专家对疾病的临床诊治思路,提高基层卫生机构的临床业务水平。本刊于2012年开辟“临床病例讨论”栏目,报道武警部队各级医院及重点学科临床工作中遇到的疑难和典型病例,以及基层卫生队经过多学科专家远程会诊得以成功治疗的典型病例。会诊专家需署名(如无外请专家,也可署本院科主任名),格式如:张某某医师(肝胆科)。具体行文格式参考本栏目已发表的论文格式。全文字数3800或6500左右。 来稿请在右上角标注“临床病例讨论”。本栏目所录稿件为原创性临床研究论文,欢迎广大临床医师踊跃投稿!
武警医学编辑部
2014年1月
Comparisonofmulti-drugresistanthumanhepatocellularcarcinomacelllineBel-7402/DOXmodelestablishedbytwomethods
ZHONG Xingguo, GONG Renhua, SUN Dengqun, CAO Baoqiang, FAN Yulin, JIANG Shitao, CAI Jun, HE Xinmiao, and LUO Huilai. Department of General Surgery, Anhui Provincial Corps Hospital,Chinese People’s Armed Police Forces, Hefei 230041, China
ObjectiveTo compare the biological characteristics of two types of human hepatocellular carcinoma multi-drug resistant cell sub-lines Bel-7402/DOX models established by two methods.MethodsWe established human hepatocellular carcinoma doxorubicin multi-drug resistant cell sub-lines models Bel-7402/DOXV and Bel-7402/DOXL by in vitro concentration gradient increased induction and nude mice liver-implanted induction, respectively. Phase contrast microscopy was used to observe the cells and MTT (methyl thiazolyl tetrazolium) method was used to detect drug resistance of the two different sub-lines of cells. The ingestion and excretion of cellular doxorubicin (DOX) and the expression of P-glycoprotein (P-gp), multi-drug resistance-sociated protein (MRP) and glutathione S-transfer enzyme system (GSH/GST) were detected by flow cytometry.ResultsThe Bel-7402/DOXV and Bel-7402/DOXL generated cross-resistance to DOX and CDDP (cis-Diaminedichloroplatinum), they showed a significant difference in resistance to Bel-7402 IC50 value (P<0.01). The doubling times were significantly extended, compared with the parent cell line (39 h), and were 65 h (Bel-7402/DOXV) and 46 h (Bel-7402/DOXL). The excretion rates of DOX were significantly increased, compared with the parent cell (34.14%) line and were 81.06% (Bel-7402/DOXV) and 66.56% (Bel-7402/DOXL). Expressions of P-gp and MRP in the two groups of resistant sub-lines cells were significantly enhanced (P<0.01). There was no significant variation in the expression of GSH/GST (P>0.05).ConclusionsStable resistance is involved in the resistant cell line model established by the two methods above. Liver implantation is a good simulation of human hepatocellular and proves to be an ideal model with characteristics similar to human hepatocellular biology and the pharmacokinetics of anticancer drugs.
hepatocellular carcinoma; multidrug resistance; doxorubicin; cell line model
安徽省自然科学基金(1208085MH181)
钟兴国,硕士,副主任医师,副教授,E-mail:zhongxg75@163.com
230041合肥,武警安徽总队医院普外科
R735.7

