新疆地区不同民族肝癌患者欧洲营养风险筛查2002(NRS2002)情况调查
肖 蕾, 吴兰华, 马 静,张 华, 张瑞丽, 刘 畅, 包永星
(新疆医科大学第一附属医院1肿瘤中心, 2护理部, 3个案管理科, 乌鲁木齐 830054)
大量的研究表明,肿瘤患者的营养代谢相对于健康人具有一定的特异性,肿瘤患者的代谢具有如下特征:高代谢、蛋白分解加速、脂肪动员、糖代谢紊乱等多种代谢紊乱,初诊时的营养状况也成为患者预后的独立危险因素之一[1]。在肿瘤不断发生发展的过程中, 约有50%患者存在有营养不良和营养风险,90%以上的终末期肿瘤患者存在有营养不良和营养风险,需要进行正规的评估和干预[2-3]。进行正规营养干预患者的预后也要优于不进行营养干预的患者[4]。
新疆是多民族聚集地区,肝癌也是新疆地区的常见恶性肿瘤之一[5]。本课题组前期的研究发现,新疆地区的肝癌患者具有一定的民族特异性,其中代谢性因素可能在维吾尔族肝癌的发病中扮演更为重要的角色[6],但是针对于新疆肝癌患者的营养筛查和评价报道较少。目前关于恶性肿瘤的营养状况的评价方法包括预后营养指数(PNI)、营养风险指数(NRI)、主观全面评定(SGA)、微型营养评定(MNA)、营养不良通用筛查工具(MUST)和营养风险筛查2002(NRS2002)等,其中NRS2002是欧洲肠外营养学会于2002年提出并且推荐使用的营养筛查工具,也是迄今为止唯一基于128个随机对照研究共计8 944例研究对象循证医学为基础的研究工具,并且多数基于客观指标,民族习惯和主观因素对其影响较小。目前尚未发现关于新疆地区不同民族原发性肝癌患者营养状况差异的报道,本研究采用欧洲营养风险筛查2002(Nutritional Risk Screening,NRS2002)量表对新疆地区351例原发性肝癌患者进行筛查,现将研究结果报道如下。
1 资料和方法
1.1临床资料选择2010年1-12月在新疆医科大学第一附属医院肿瘤中心就诊的肝癌患者351例,其中男性277例,女性74例,男女比例为3.74∶1;年龄25~87岁,中位年龄60岁;汉族患者286例,维吾尔族患者34例, 哈萨克族14例,回族9例,蒙古族5例,柯尔克孜族2例,外国籍1例。纳入标准:(1)患者入院前经过相关检查并经过我院肿瘤多学科专家讨论会讨论,明确诊断为原发性肝癌的患者;(2)住院1 d以上;(3)经过知情同意和医院伦理委员会批准,同意进行调查的患者。排除标准:(1)入院期间诊断不明者;(2)严重胃肠道疾病、严重心脑血管疾病、内分泌代谢性疾病者;(3)不同意进行调查的患者;(4)无法沟通的患者。
1.2方法
1.2.1 筛查方法 采用定点连续抽样的方法,由专业调查人员对所有调查对象在入院24 h内应用NRS2002进行营养筛查。营养不足、超重和肥胖的判定标准,BMI的判定标准采用BMI中国标准:即BMI<18.5为营养不足;18.5≤BMI<24.0为体质量正常;24.0≤BMI<28.0为超重;BMI≥28.0为肥胖。体质指数(BMI)=体质量(kg)/身高2(m2)。筛查方法:调查前集中培训调查人员,采用统一的NRS2002调查表进行营养筛查,晨起排二便,空腹免鞋测定身高、体质量。体质量测定校正至±0.2 kg,身高标尺校正至±0.5 cm。营养评价标准NRS2002筛查的结果为营养状况、疾病严重程度和年龄3者评分相加,评分≥3分为有营养风险。
1.2.2 临床研究终点与随访时间 自患者入院之日起,收集患者姓名、性别、年龄、住院号、民族、BMI、NRS2002评分、生存时间、死亡日期等信息,通过电话进行跟踪随访,随访终点为死亡或者随访截止时间,随访截止至2013年3月31日,340例患者完成随访,随访率为96.87%。

2 结果
2.1BMI在新疆地区肝癌患者中的筛查结果351例患者均完成筛查,BMI评定为营养不足、超重和肥胖的发生率分别为11.68%、6.55%、4.84%,汉族患者分别为12.59%、6.64%、3.15%,维吾尔族患者为11.76%、8.82%、14.71%,男性患者和女性患者差异无统计学意义(P=0.431),汉族和维吾尔族患者间差异有统计学意义(P=0.017),维吾尔族、汉族患者与其他少数民族患者比较差异无统计学意义(P>0.05),结果见表1、2。
2.2新疆地区肝癌患者NRS2002的筛查结果NRS2002筛查提示在新疆肝癌患者中营养风险的总发生率为58.69%,男性患者营养风险发生率(64.26%)高于女性(47.30%),差异有统计学意义(P=0.011)。汉族患者营养风险发生率为60.84%,维吾尔族患者营养风险发生率为35.29%,其他少数民族患者营养风险发生率为64.52%,汉族患者和其他民族患者营养风险发生率高于维吾尔族患者,差异具有统计学意义(P=0.006),维吾尔族患者营养风险发生率低于其他少数民族患者,差异具有统计学意义(P=0.026),结果见表3、4。
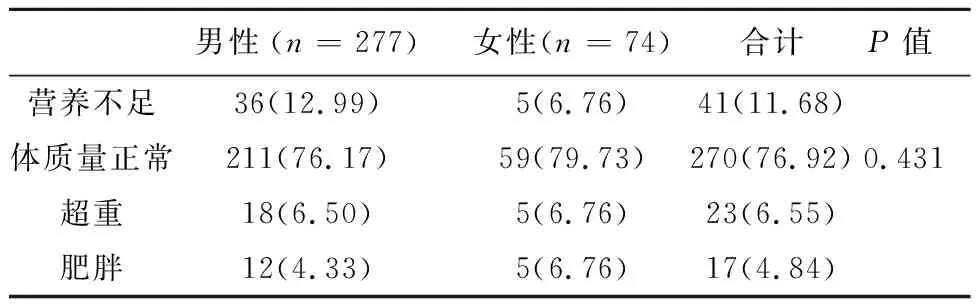
表1 BMI在不同性别肝癌患者中的筛查结果/例(%)

表2 BMI在不同民族肝癌患者中的筛查结果/例(%)
注: 与汉族比较,*P<0.05。

表3 新疆地区不同性别肝癌患者NRS2002筛查结果/例(%)
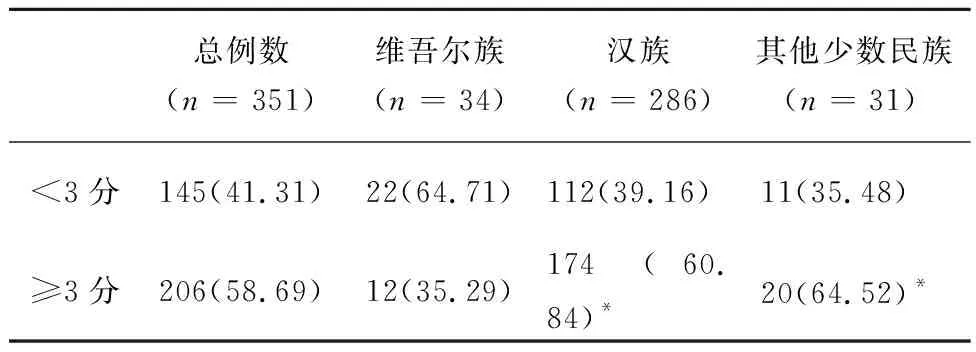
表4 新疆地区不同民族肝癌患者NRS2002筛查结果/例(%)
注: 与维吾尔族比较,*P<0.05。
2.3营养状况评分和患者远期生存的关系
2.3.1 初诊时BMI评分与预后的关系 单因素Keplan-Meier生存分析显示:初诊时的BMI评分营养不良、体质量正常、超重、肥胖的发生率与生存率无相关性(P=0.48),见图1。
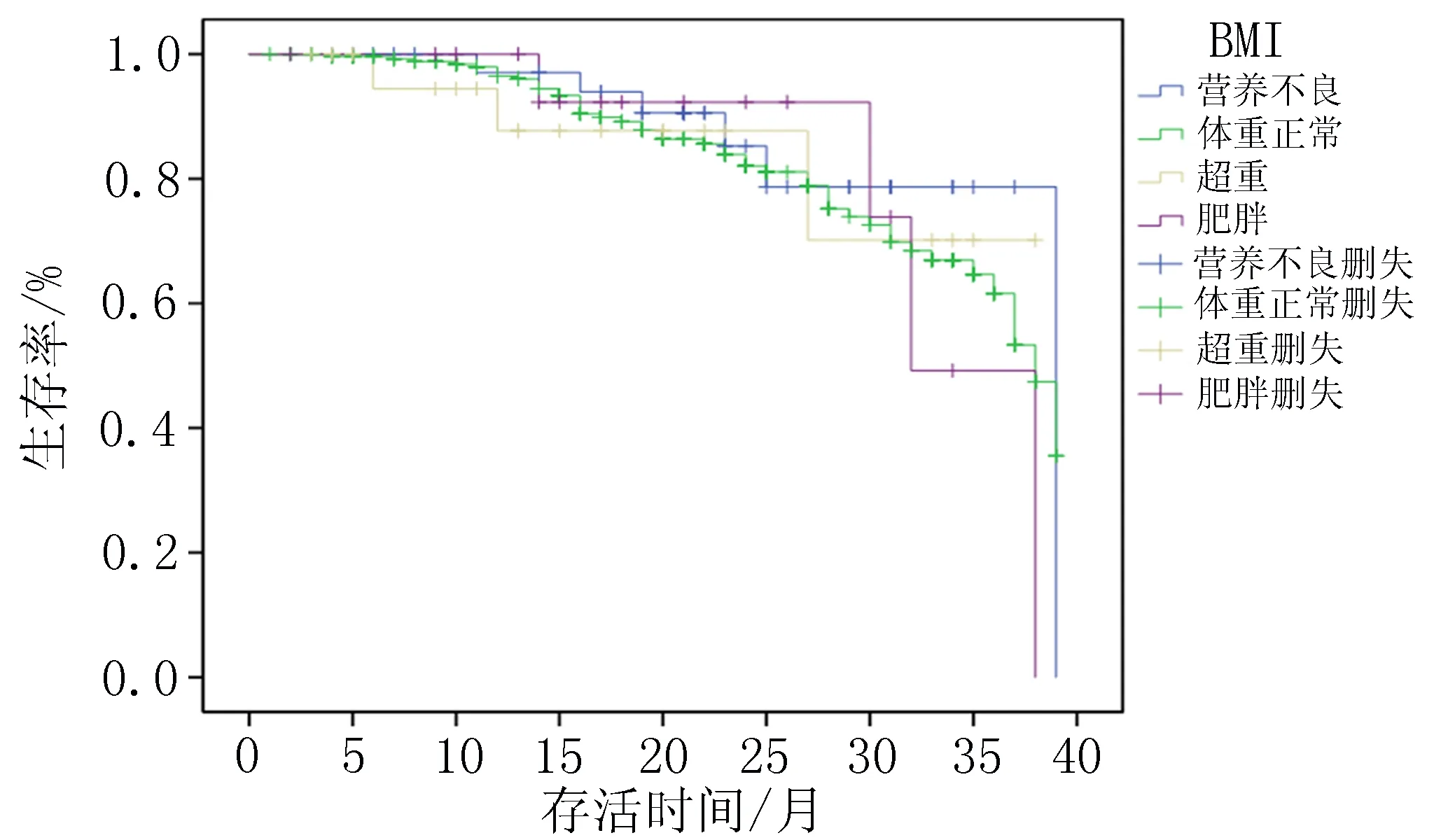
图1 初诊时BMI评分与预后的关系生存分析曲线
2.3.2 初诊时NRS2002与预后的关系 单因素Keplan-Meier生存分析显示:初诊时NRS2002评分与预后生存具有明显相关性,NRS2002评分<3分的患者预后优于≥3分的患者(P<0.05),见图2。
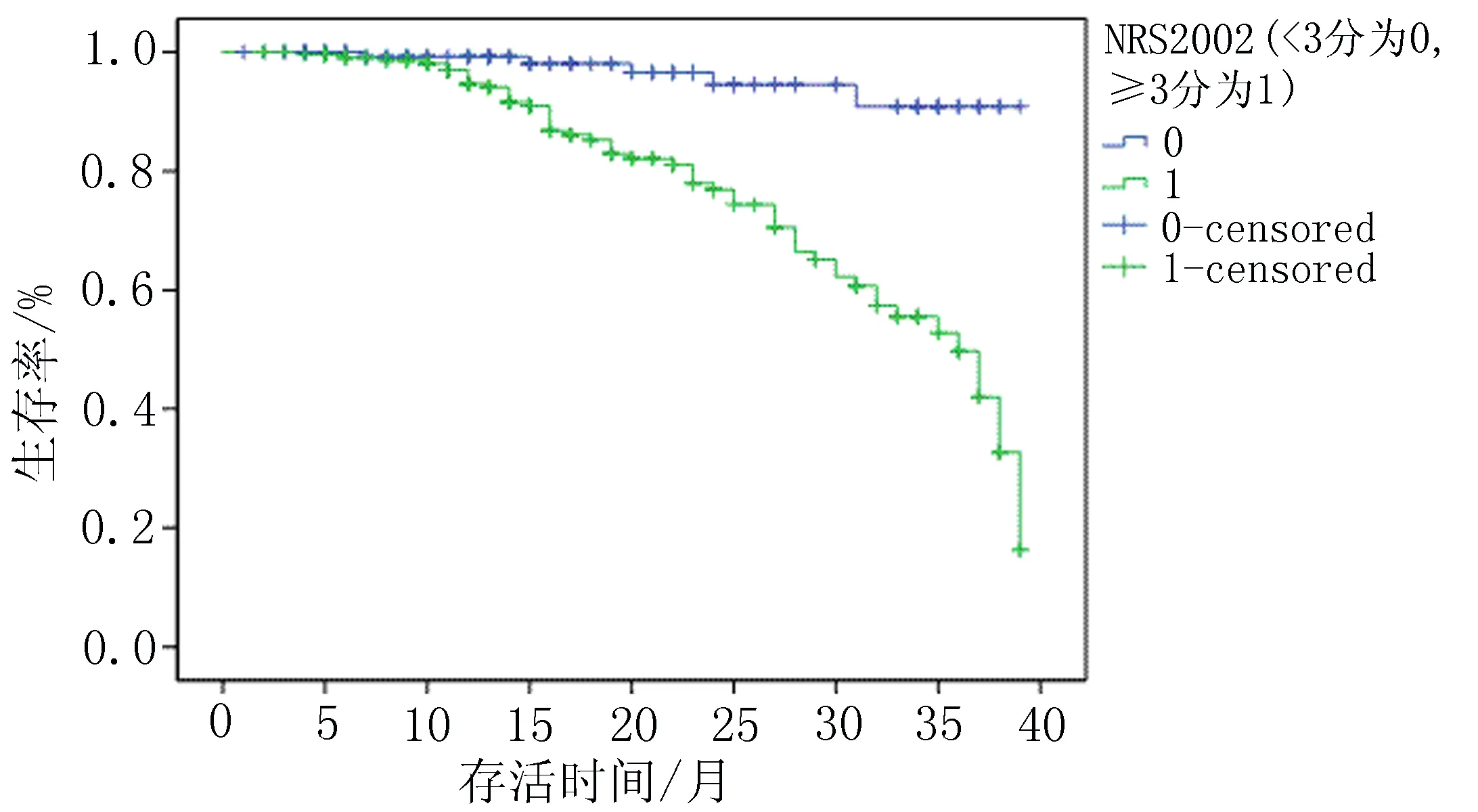
图2 初诊时NRS2002评分与预后的关系生存分析曲线
3 讨论
原发性肝癌是新疆地区多发性疾病[5],本课题组前期研究发现哈萨克族和维吾尔族原发性肝癌的临床特点与汉族有明显差异,其非病毒感染性肝癌所占比例较高,提示代谢性的因素可能在新疆地区少数民族原发性肝癌发病中扮演着重要的角色[6]。不同民族肝癌患者可能由于饮食习惯和生活方式的不同而导致民族间营养状况存在有差异。本研究采用欧洲营养风险筛查2002(Nutritional Risk Screening,NRS2002)量表对新疆地区351例原发性肝癌患者进行筛查,得到初步的研究结果。
本研究结果表明BMI评定为营养不足、超重和肥胖的发生率分别为11.68%、6.55%、4.84%,汉族患者分别为12.59%、6.64%、3.15%,维吾尔族患者分别为11.76%、8.82%、14.71%,汉族和维吾尔族患者的BMI筛查结果差异有统计学意义,汉族患者的超重和肥胖率低于维吾尔族,说明维吾尔族患者中喜肉食、少蔬菜的生活习惯导致超重和肥胖的患者较多,不仅增加其代谢相关疾病如冠心病、糖尿病的发病率,可能也是肝癌相关的发病因素之一。
经过NRS2002筛查后发现,肝癌患者总体营养风险的发生率为58.69%,汉族患者营养风险发生率为60.84%,维吾尔族患者营养风险发生率为35.29%,同样在汉族患者中营养风险发生率要高于维吾尔族,再次说明维吾尔族肝癌患者初诊时的营养状况要优于汉族患者。因此,在临床治疗的过程中,需要针对不同民族的患者,采用不同的个体化的治疗,对于汉族患者,在进行抗肿瘤治疗的同时,给予更加积极的营养支持治疗,可能会取得更好的治疗效果。同时,由于维吾尔族患者的营养状况好于汉族患者,因此可能对于治疗的耐受性相对汉族患者更佳,更能够耐受积极的治疗。本课题组前期关于食管癌的研究也发现不同的民族患者间存在有放化疗耐受性的差异[7]。
本研究对患者进行跟踪随访后发现,单因素分析显示,BMI虽然能够在维吾尔族和汉族肝癌患者的初诊治疗中提示存在有差异,但是这种差异并不能提示预后的情况。相反采用NRS2002进行筛查后提示营养风险和预后有明显的相关性,不存在营养风险的人群的预后显著好于存在有营养风险的人群,提示在肝癌患者初诊时进行营养风险的评价对于患者预后具有指导意义。亦有相关的研究也提示类似的结论[8-10]。本研究不足之处在于,维吾尔族患者病例人数较少,只有34例,与维吾尔族肝癌本身发病率较低有关,同时NRS2002是否真正作为预后指标来评价还需要与其他因素联合进行多因素分析从而排除交互作用后再进行进一步的分析。
本研究虽然发现部分肝癌患者存在有营养不良风险,但是由于患者就诊于不同的科室,故未能进行正规的营养支持治疗,方案差异较大;同时因为部分患者无法承受营养支持的费用,故无法评价营养支持的效果,但是即使对存在营养风险进行不正规的营养支持的患者的预后仍旧差于初诊时营养状况良好的患者,充分说明初诊时的营养状况对患者预后的影响。
总之,营养状况对于恶性肿瘤的发生发展及预后的作用已经逐渐被人们所认可[11-12],并且也在通过进一步研究探明其机制[13]。因此,在患者初诊的过程中进行标准的营养状况评价不仅能够指导患者的治疗方式选择,更能够作为一种预测因子提示预后。因此,对新疆地区不同民族肝癌患者间营养状况存在的差异需要进行进一步的研究,以探索其发病的独特性,明确肝癌病因。
参考文献:
[1] Pan HM, Cai SJ, Fu J, et al. The impact of nutritional status, nutritional risk, and nutritional treatment on clinical outcome of 2248 hospitalized cancer patients: A multi-center, prospective cohort study in chinese teaching hospitals[J]. Nutr Cancer,2013,65(1):62-70.
[2] Tu MY, Chen TW, Chou MT. Using a nutritional screening tool to evaluate the nutritional status of patients with colorectal cancer[J]. Nutri Cancer,2012,64(2):323-330.
[3] Hsu WC, Tsai AC, Chan SC, et al. Mini-nutritional assessment predicts functional status and quality of life of patients with hepatocellular carcinoma in Taiwan[J]. Nutr Cancer,2012,64(4):543-549.
[4] Hayaishi S, Chung H, Kudo M, et al. Oral branched-chain amino acid granules reduce the incidence of hepatocellular carcinoma and improve event-free survival in patients with liver cirrhosis[J]. Dig Dis,2011,29(3):326-332.
[5] 肖蕾,张华,毛睿,等.42 808例恶性肿瘤统计分析[J].中国病案,2011,12(2):52-54.
[6] 倪雅琼,赵华荣,毛睿,等.新疆地区3 602例原发性肝癌临床流行病学资料分析[J].中华肿瘤杂志,2012,34(5): 374-377.
[7] 玛依努尔·艾力,忙尼沙·阿不都拉,肖蕾,等.新疆哈萨克族与汉族晚期食管癌同期放化疗疗效比较[J].中华放射肿瘤学杂志,2011,20(3):205-207.
[8] 陈颖君,范英华,乔羽,等. 肝癌患者肝切除前后口服肠内营养混悬液的效果观察[J].中华护理杂志,2012,47(5): 399-401.
[9] 艾丽,何秀颖.肝癌切除术后随访患者营养状况及相关因素分析[J].中国误诊学杂志,2012,12(5):363-369.
[10] 张明,王杨,宋桂花,等.潍坊某三甲医院早、中期(Ⅰ、Ⅱ、Ⅲ期)胃肠道癌患者的营养风险、营养不足发生率和营养支持情况调查[J].中华临床营养杂志,2012,20(6):345-350.
[11] 周东,刘胜,应敏刚,等.肝癌病人术后早期肠内与肠外营养支持治疗的比较[J].肠外与肠内营养,2012,19(1):50-51.
[12] 尤振兵,徐达夫,朱卫国,等.早期肠内营养对食管癌患者营养指标和免疫功能的影响[J].中华全科医师杂志,2012,11(10):788-790.
[13] 李俊,杨斌,郭瑜,等.营养剥夺通过诱导自噬促进肝癌细胞侵袭[J].华中科技大学学报:医学版,2012,41(5):513-517.

