胰腺组织TLR4及其炎症因子在高脂饮食诱导小鼠胰岛素抵抗中的表达
王晓静,魏 琴,吴鸿涛,杨 凯,娜仁花,王 宁
(新疆医科大学第一附属医院1干部病房内一科,2临床研究中心,乌鲁木齐 830054)
胰岛素抵抗是2型糖尿病发生发展中的重要特征,同时在代谢综合征的形成中也起着关键的作用,胰岛素抵抗的发生与肥胖、高血压、冠心病等疾病有明显关系。大量的研究已经表明肥胖(尤其是内脏型肥胖)是产生胰岛素抵抗的重要因素[1-3]。Toll样受体(TLR)在炎症因子基因启动以及炎症因子的转录调控过程中有非常重要的地位。Toll样受体4(TLR4)在自然配体(LPS)作用下,导致核因子-kappa B(NF-κB)激活,从而释放大量炎症因子,致使胰岛素抵抗的发生[4]。释放的大量炎症因子中包括肿瘤坏死因子(TNF-α)、白介素6(IL-6)等,TNF-α主要由巨噬细胞产生,T淋巴细胞和成纤维细胞也能产生,TNF-α通过与p55RNFR结合,继而激活并水解中性神经鞘磷脂酶,引起胰岛素底物受体(IRS-1)丝氨酸磷酸化,最终导致胰岛素生物功能下降,发生胰岛素抵抗。白介素(IL)是在白细胞或免疫细胞间相互作用的细胞因子,有关研究[5]发现在胰岛素抵抗机体中白介素6(IL-6)水平明显升高,可能是参与了炎症反应,但具体机制尚有待进一步研究,既往对于研究骨骼肌、脂肪细胞中TLR4的信号传导以及其炎症因子表达的影响的相关报道较多[6],但关于TLR4在胰腺组织中的信号传导研究较少。本研究通过高脂饮食喂养诱导小鼠肥胖模型,观察高脂饮食小鼠胰腺组织中TLR4表达对炎症因子表达的影响,以及对胰岛素敏感性的影响。
1 材料与试剂
1.1 材料 80只6周龄健康雄性C57BL/6小鼠,购于新疆医科大学实验动物中心。随机分为两组,分别给予高脂饮食(高脂组)和基础饲料饮食(对照组)喂养12w[7]。
1.2 试剂 Harris苏木精液、RabbitAnti-TNF-a(bs-0078R)、羊抗小鼠IgG-HRP(二抗)、10×WB洗涤液(KGP109)、异丙醇、苏木素溶液、异丙醇、二甲苯分析醇(北京中杉金桥生物技术有限公司),EDTA抗原修复液(天津凯通化学试剂有限公司),山羊二步法免疫组化测试试剂盒(PV-9003)(天津凯通化学试剂有限公司),PBS及枸橼酸盐缓冲液(天津凯通化学试剂有限公司),SDS-PAGE凝胶配制试剂盒(KGP113)、Braford蛋白含量检测试剂盒(KGA801)、5×SDS-PAGE蛋白上样缓冲液(KGP101)、全蛋白抽提试剂盒(KGP250)(南京凯基生物科技发展有限公司),IL-6(一抗)(Santa Cruz),免疫组化染色试剂盒(北京博奥森生物技术有限公司)。
1.3 方法
1.3.1 放射免疫法测定血清胰岛素水平 每组小鼠于实验前禁食14h,称其体质量,取小鼠尾静脉血测定空腹血糖值。同时取小鼠內眦静脉,用放射免疫法测定血清胰岛素水平。
1.3.2 小鼠胰腺组织情况及胰岛β细胞团面积断颈处死并留取小鼠胰腺标本,用10%甲醛溶液固定1d,再冲洗、脱水、浸染、石蜡包埋、连续切片(厚度约为4μm),行常规HE染色,在光镜下观察小鼠胰腺组织情况及胰岛β细胞团面积的变化。
1.3.3 免疫组织化学法测定 TNF-a、IL-6 先将准备好的小鼠胰腺组织提前固定于多环甲醛,用石蜡包埋、切片,再进行脱蜡、脱水,加入双氧水消除内源性氧化物酶的活性,一般室温10~30min,冲洗进行抗原修复,将稀释一抗滴于切片,孵育后冲洗,自然干燥后加入二抗,室温孵育,用PBS反复冲洗3次,滴入碱性磷酸酶标记的链酶卵白素工作液,室温孵育,冲洗,加入显色剂,显微镜下注意观察并及时用自来水冲洗以终止反应,最后用自来水大量冲洗,复染、脱水、透明、封片。
1.3.4 蛋白质印迹法测定 TLR4、NF-kB 将小鼠胰腺组织剪碎,充分研磨后,在低温下洗涤,震荡、高速离心后留取上清液,将TEMED放入配置好的分离胶中,加入电泳液进行电泳,电泳20min后变为200mA恒流电转1h,转膜完成后在5%脱脂奶粉封闭液中常温下封闭1h,弃去封闭液,加入一抗(山羊抗小鼠抗体)(1∶1000),室温孵育2h,加入二抗,室温下慢摇摇床摇荡2h,充分洗膜、漂洗进行化学发光反应,加入显影液曝光,显影,洗像,然后进行分析。
1.4 统计学处理 采用SPSS17.0统计软件包对数据进行处理,实验数据以均数±标准差)表示,组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组间及不同时间段小鼠体质量、血糖及胰岛素水平 喂养12w后,高脂饮食成功诱导小鼠胰岛素抵抗模型,小鼠体质量、空腹血糖逐渐增加,高脂组分别于第14天、第21天高于对照组,差异有统计学意义(P<0.05),第84天至最大值,高脂组血清胰岛素水平于第3天开始增加,至第7天与对照组相比差异有统计学意义 (P<0.05),第84天与对照组比较无统计学差异,见表1。
表1 各时间段分组的体质量、血糖及胰岛素水平比较()
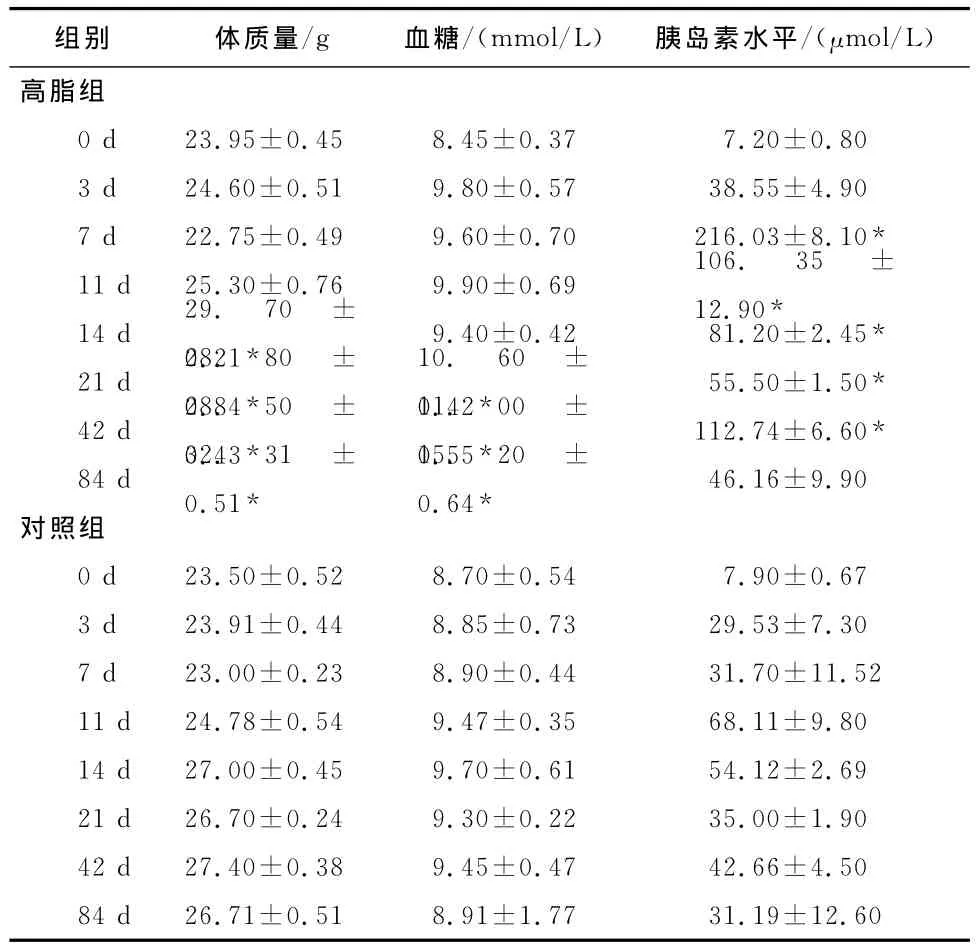
表1 各时间段分组的体质量、血糖及胰岛素水平比较()
注:与对照组比较,*P<0.05。
组别 体质量/g 血糖/(mmol/L) 胰岛素水平/(μmol/L)高脂组0d 23.95±0.45 8.45±0.37 7.20±0.803d 24.60±0.51 9.80±0.57 38.55±4.907d 22.75±0.49 9.60±0.70 216.03±8.10*11d 25.30±0.76 9.90±0.69 106. 35 ±12.90*14d 29.70 ±0.21* 9.40±0.42 81.20±2.45*21d 28.80 ±0.84*10.60 ±0.42* 55.50±1.50*42d 28.50 ±0.43*对照组0d 23.50±0.52 8.70±0.54 7.90±0.673d 23.91±0.44 8.85±0.73 29.53±7.307d 23.00±0.23 8.90±0.44 31.70±11.5211d 24.78±0.54 9.47±0.35 68.11±9.8014d 27.00±0.45 9.70±0.61 54.12±2.6921d 26.70±0.24 9.30±0.22 35.00±1.9042d 27.40±0.38 9.45±0.47 42.66±4.5011.00 ±0.55* 112.74±6.60*84d 32.31 ±0.51*15.20 ±0.64* 46.16±9.9084d 26.71±0.51 8.91±1.77 31.19±12.60
2.2 胰腺组织TLR4、NF-κB蛋白表达 高脂饮食喂养后,胰腺组织从第7天以后TLR4、NF-κB蛋白表达量开始增加,到大约第21天时增到最高值,与对照组相比差异有统计学意义 (P<0.05),此后又逐渐下降,同时伴有胰岛的特异性的 TNF-α、IL-6高表达,见表2、图1、2。

表2 TLR4与NF-κB蛋白表达
2.3 胰岛细胞 TNF-α、IL-6的表达 通过免疫组化法发现高脂饮食组小鼠胰岛细胞TNF-α和IL-6呈阳性表达,但本实验发现TNF-α、IL-6仅着色于胰岛细胞,在胰腺其他部位未见着色(图3、4)。

图1 胰腺组织TLR4蛋白随喂养天数的变化

图2 胰腺组织NF-κB蛋白随喂养天数的变化

图3 胰岛TNF-a阳性
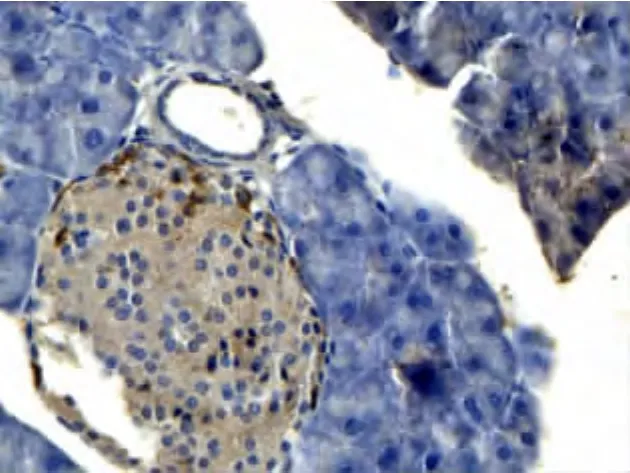
图4 胰岛IL-6阳性
2.4 胰腺组织形态学观察结果 HE染色光镜观察结果显示:0~5d胰岛大小不等,分布均匀,形状规则,界限清楚,均未见炎症细胞,无水肿,胰岛细胞正常,个别细胞胞浆红染,核深染,符合凋亡细胞特征;第1周~5周胰岛增生,其中在第1周呈现体积开始增大,分布较弥散,部分胰岛轻度充血、肿胀,内有少量凋亡细胞。第5~10周胰岛肿胀明显,胞浆中可见大小不等的脂肪颗粒,凋亡细胞明显增多,胰腺小叶间隔可见稀疏网状胶原纤维沉积。第11周腺泡开始萎缩,开始节结状纤维化,到第12周体积已明显缩小。第15周后胰腺小叶结构完全破坏,胰腺不完全纤维化,脂肪组织浸润(图5)。

图5 高脂喂养不同时间小鼠胰腺组织 (HE×40)
3 讨论
随着人们饮食的多元化和生活方式的改变,不仅代谢综合征的发病日渐增多,而且促进了代谢综合征各组分的发生和发展,其中长期高能量摄入导致机体肥胖与代谢性疾病的发生有非常密切的关联。肥胖实际上是一种低度的慢性炎症状态[8],TLR4在免疫炎症基因调节中起着很重要的作用,它所导致的炎症反应的信号通路大部分都需要激活NF-κB信号传导途径,使NF-κB活化,继而启动相应的转录及合成等程序,调节炎症因子分泌,如:TNF-α、IL-6等,促进各种炎症因子分泌入血,进而发生全身性低度慢性炎症反应,最终使机体发生了胰岛素抵抗。
TLR4/NF-κB信号通路目前被认为是炎症反应中最重要的一条通路,TLRs最早是在果蝇中被发现,在先天免疫系统中发挥了关键性作用,可以直接识别、结合某些病原体和其产物所共同拥有的高度保守的特定分子结构(即病原相关分子模式),还可以对不同的病原相关分子模式进行识别、结合,并引发一系列的信号转导,进而导致释放大量炎性介质[9-10],TLR4几乎在所有细胞表面具有存在,既往研究[11]已明确小鼠胰腺组织确实表达了TLR4,本研究通过免疫组化法观察发现IL-6、TNF-α只着色于胰岛细胞,在胰腺其他部分未见着色,考虑可能是IL-6、TNF-α在胰腺组织内仅存在于胰岛细胞,并且本研究表明高脂饮食可以诱导TLR4在胰岛β细胞的表达增高,在自然配体(LPS)作用下,主要有2条信号通路,1条是髓样分化因子88(MyD88)依赖途径,TLR4和LPS相结合[12],然后信号途径转移到胞内,TLR4的胞内区与MyD88的羧基端结合,通过激活IL-1来激活NF-ΚB,最终使大量合成和释放炎症因子。另1条是MyD88非依赖途径,TLR4通过TRAM作用于TRIF,然后通过调节TRIF活化IKK复合体,最终导致 NF-κB释放入核[13]。
目前研究表明胰岛素抵抗患者体内存在TLR4/NF-κB信号通路的激活[14],小鼠胰岛细胞内可见TNF-α、IL-6的阳性表达,同时胰岛在实验第11天时体积增大,在第84天时体积明显缩小,这与临床上2型糖尿病病人胰腺CT形态变化趋势相符[15],说明了胰岛细胞中 TLR4/NF-κB 信号通路激活与胰岛素抵抗密切相关[16]。
本研究发现胰腺组织中TLR4、NF-κB蛋白表达量、第7天开始增加,第21天达高峰,此后又逐渐下降,同时伴有胰岛的特异性的 TNF-а、IL-6高表达。HE染色也表明,胰岛在第1周呈现体积增大,到第12周体积已明显缩小。推测高脂饮食可以使胰腺组织TLR4/NF-κB信号通路激活,并产生较多的炎症因子,参与机体内慢性炎症反应,并与胰岛素抵抗之间具有相关性,进一步证实了TLR4存在于全身多种组织中,并且TLR4/NF-κB信号通路与胰岛素抵抗的发生密切相关,也验证了高脂饮食与肥胖、胰岛素抵抗之间的关系,为糖尿病健康教育提供了更有利的依据,可考虑通过减少TLR4的表达或抑制TLR4信号通路来调节胰岛素抵抗的发生,为代谢性疾病的治疗提供了一个新的方向。
[1] Amyot J,Semache M,Ferdaoussi M,et al.Lipopolysaccharides impair insulin gene expression in isolated islets of Langerhans via toll-like receptor-4and NF-jB signalling[J].PLos One,2012,7(4):36200.
[2] Dewei Ye,Francois YL.Li,Karen S L Lam,et al.Toll-like receptor-4mediates obesity-induced non-alcoholic steatohepatitis through activation of X-box binding protein-1in mice[J].Gut,2012,61(7):1058-1067.
[3] Zhang HM,Chen LL,Wang L,et al.Macrophage infiltrates with high levels of Toll-like receptor4expression inwhite adipose tissues of male Chinese[J].Nutr Metab Cardiovasc Dis,2009,19(10):736-743.
[4] Song MJ,Kim KH,Yoon JM,et al.Activation of Toll-like receptor 4is associated with insulin resistance in adipocytes[J].Biochem Biophys Res Commun,2006,346(3):739-745.
[5] Zick Y.Role of Ser/Thr kinases in the uncoupling of insulin signaling.[J].Int J Obes Relat Metab Disord,2003,27:56-60.
[6] Kim KA,Gu W,Lee IA,et al.High fat diet-induced gut microbiota exacerbates inflammation and obesity in mice via the TLR4signaling pathway.[J].PLoS One,2012,7(10):47713.
[7] 袁海瑞,牛燕媚,刘效磊,等.有氧运动对胰岛素抵抗小鼠骨骼肌基因表达谱的影响[J].中国运动医学杂志,2010,29(4):434-440.
[8] Konner AC,Brüning JC.Toll-like receptors:linking inflammation to metabolism[J].Trends Endocrinol Metab,2011,22(1):16-23.
[9] Arora P,Garcia-Bailo B,Dastani Z,et al.Genetic polymorphisms of innate immunity-related inflammatory pathways and their association with factors related to type 2diabetes[J].BMC Med Genet,2011,12:95.
[10] Charbonneau A,Marette A.Inducible nitric oxide synthase induction underlies lipid-induced hepatic insulin resistance in mice:potential role of tyrosine nitration of insulin signaling proteins[J].Diabetes,2010,59(4):861-871.
[11] Sallam N,Fisher A,Golbidi S,et al.Weight and inflammation are the major determinants of vascular dysfunction in the aortae of db/db mice[J].Naunyn Schmiedebergs Arch Pharmacol,2011,383(5):483-492.
[12] 梁泉.Toll样受体4的研究进展 [J].天津医科大学报,2006,12(1):151-153.
[13] 栗莉,张磊,候祥红.TLR4对人体骨骼肌细胞炎症因子表达及胰岛素抵抗的影响[J].现代生物医学进展,2012,6(2):201-204.
[14] 冉兴无,李秀钧.胰岛素抵抗的基础与临床研究进展[J].中国糖尿病杂志,2009,17(7):481-483
[15] 李晓阳,邢国凤,赵林.胰腺脂肪浸润的CT表现及2型糖尿病关系的临床分析[J].中华胰腺病杂志,2011,4,11(2):136-137.
[16] Round JL,Lee SM,Li J,et al.The Toll-like receptor 2 pathway establishes colonization by a commensal of the human microbiota[J].Science,2011,332(6032):974-977.

