大鼠骨髓单个核细胞诱导内皮细胞的实验研究
王静静, 李新喜, 白 超, 王 洋, 田 野, 罗 军
(1新疆医科大学第一附属医院血管甲状腺外科, 乌鲁木齐 830054; 2新疆维吾尔自治区人民医院重症医学二科, 乌鲁木齐 830000)
血管内皮细胞(vascular endothelial cell, VEC)在动脉硬化闭塞症的病理生理过程中起重要作用,VEC作为种子细胞可促进缺血器官和肢体的血管新生,可能是未来治疗周围动脉缺血性疾病的方法之一[1]。VEC来源有限,诱导干细胞向VEC转化较为困难。本实验尝试诱导SD大鼠骨髓单个核细胞向VEC转化,探索诱导方式,并对被诱导出的VEC的生物学特性进行检测。
1 材料与方法
1.1材料
1.1.1 实验动物 雄性,4~6周龄,体质量150~180 g,SPF封闭群SD大鼠,由新疆医科大学医学实验动物中心提供[许可证号:SYXK(XJ)2003-0001]。饲养在消毒笼具中,每笼2只,在室温20~22℃饲养,明暗交替12 h,自由进食饲料。实验动物使用权以及实验技术路线经新疆医科大学第一附属医院伦理委员会审查通过(证号:20080701007)。
1.1.2 试剂 M199培养基粉剂(Gibico公司),澳洲胎牛血清(HyClone公司),0.25%胰蛋白酶(HyClone公司),大鼠淋巴细胞分离液Ficoll(天津灏洋生物公司),重组血管内皮生长因子VEGF(Invitrogen 公司),重组成纤维细胞生长因子( bFGF,R&D公司),明胶(sigma公司),von Willebrand Factor Monoclonal Antibody(Thermo公司),Anti-von Willebrand Factor antibody FITC(Abcam公司),CD34 Antibody PE(Novus),mouse anti rat CD31 FITC(AbD公司),mouse anti rat CD44 FITC,goat anti-mouse IgG secondary antibody (Thermo),Hoechst33342(sigma公司),Cell Counting Kit(CCK试剂盒)(上海锐赛生物公司)。
1.1.3 仪器 德国Leica正置显微镜(DMI5000B),倒置显微镜(DMI4000B)及图形采集处理系统(Leica Application Surte,Version 2.8.1),香港Heal Froce HF240 CO2培养箱,法国Jouan BR4离心机,苏州SW-CJ-2FD双人单面净化工作台,上海精宏DK-600S三用恒温水箱,离心机,美国BD公司流式细胞仪(FACScalibur)。
1.2方法
1.2.1 分离大鼠骨髓单个核细胞 SD大鼠颈部脱臼处死,75%酒精浸泡双下肢,无菌条件下分离出大鼠的股骨和胫骨[2-3],剪去骨两端,注射器吸取5 mL M199培养基冲出骨髓细胞,用4号注射针头吹打细胞悬液,制备成单细胞悬液。将骨髓细胞悬液加入等体积的Ficoll分离液上层,2 000 r/min离心30 min。吸取单个核细胞,加入PBS至5 mL再1 600 r/min离心5 min,弃上清。用完全培养液(M199培养基+10% FBS)制成细胞悬液并计数,按1×105个/mL的细胞数接种于包被有0.5%明胶的培养皿中。置入37℃、5% CO2的培养箱中孵育。
1.2.2 诱导内皮细胞 细胞增殖铺满整个培养皿底约40%[4-5]后分为两组, 实验组在原有完全培养液中添加50 ng/mL VEGF和10 ng/mL bFGF;对照组继续使用完全培养液。每隔48 h更换1次培养液。孵育环境条件同上。3 d后开始显微镜下观察内皮细胞的形态变化。
1.2.3 细胞增殖与活性检测 待细胞汇合达80%左右,用0.25%胰蛋白酶消化细胞,制成单细胞悬液,均以1×103个/孔接种于96孔板中,次日开始每日按Cell Counting Kit 8(CCK 8)试剂盒说明书进行细胞增殖的检测,一式20份,实验组连续检测10 d,每次检测以4孔为空白对照。对照组连续监测7 d,每次检测以4孔为空白对照。计算每日测定得平均数值绘制细胞生长曲线。并根据作图法计算出细胞群体倍增时间。
1.2.4 细胞表面特异性标记物的检测 待细胞汇合达90%左右,弃完全培养基,添加PBS清洗培养皿,每次3 min,需清洗2次。添加1 mL 0.25%胰蛋白酶溶液消化2~3 min,即添加完全培养基终止,并用移液枪吹打培养皿底部,将细胞混匀后移至15 mL离心管中,离心后弃上清,添加5 mL PBS,将其与细胞混匀,再次1 200 r/min 离心6 min,按此方法再次洗涤1次后行细胞计数,并将其分装至EP管中,包装每个EP管中的细胞总数>1×105个/EP管。每个EP管中添加抗CD34-(PE荧光)、抗CD31-(FITC荧光),抗vWF-(FITC荧光)标记实验组及对照组,并放置4℃冰箱中孵育30 min,孵育好后取出,放置高速离心机离心30 s,弃上清。每个EP管加入PBS缓冲液混匀,再次高速离心30 s,弃上清,加入500 μL PBS缓冲液混匀,于FACSCalibur流式细胞仪(Becton Dickinson)中检测。
1.2.5 免疫荧光鉴定 待细胞汇合达90%左右,弃去培养液,用含0.1%Triton x-100的4%多聚甲醛室温固定30 min,弃培养皿中液体后使用PBS缓冲液冲洗2次,每次5 min,加3%H2O225 min,以灭活内源性过氧化物酶,弃培养皿中的3%H2O2后使用PBS缓冲液冲洗2次,每次5 min,加4%山羊血清封闭液10 min阻断非特异性抗原,加入Anti-von Willebrand Factor antibody 37℃孵育1 h,PBS缓冲液冲洗2次,每次5 min,加入10 ng/mL Hoechst 33342 1 mL标记细胞核 5 min,PBS冲洗2次,每次5 min,随后于培养皿中添加少量PBS缓冲液后,置倒置荧光显微镜下观察标记荧光的细胞,随机选择4个视野,统计vWF的阳性率。
2 结果
2.1细胞生长形态特征实验组细胞贴壁速度较慢,使用倒置显微镜观察诱导3 d后的内皮细胞形态为圆形或者类圆形,但此类细胞较少(图1)。当诱导6 d后细胞浆突向两极呈橄榄状,并排列呈线性生长(图2),当诱导10~12 d后细胞体积明显增大,单个核位于中央,细胞呈椭圆状,如铺路石状排列(图3)。对照组细胞于4 d后呈梭形、纺锤形或三角形,约7 d后细胞伪足伸向四周,呈毛刺状。将诱导后9 d的内皮细胞行瑞氏、吉姆萨染色,使用倒置显微镜拍照观察形态,红色为骨髓间充质干细胞的细胞核,蓝色为内皮细胞(图4)。
2.2细胞生长曲线实验组细胞生长曲线呈M型,对照组细胞生长曲线呈S型(图5~6);实验组和对照组的细胞群体倍增时间分别约为8 d(192 h)、5 d(120 h)。
2.3细胞表面标志物的测定经FACSCalibur流式细胞仪(Becton Dickinson)测定,实验组细胞表面特异性标记物 CD31、CD34、vWF分别为29.6%、50.2%、98.2%(图7~9)。对照组细胞表面特异性标记物CD31、CD34、vWF分别为0.6%、1.9%、5.3%。
2.4细胞免疫荧光特异性染色实验组细胞免疫荧光特异性染色 vWF染色呈绿色,为阳性,随机选取4个视野进行统计,其阳性表达率为(55.00±10.70)%(图10),对照组细胞免疫荧光特异性染色vWF染色不呈现绿色,为阴性。

图1 实验组细胞诱导第3天

图2 实验组细胞诱导第6天

图3 实验组细胞诱导第12天

图4 对照组内皮细胞瑞士-吉姆萨染色

图5 实验组细胞生长曲线图

图6 对照组细胞生长曲线图

图7 实验组细胞表面特异性标记物CD31
3 讨论
研究证实骨髓中的单个核细胞可用于缺血性疾病的治疗[6-7],这种包含造血干/祖细胞、单核细胞、骨髓间充质细胞、淋巴细胞等异质性细胞群的单个核细胞在使用诱导剂(如VEGF、bFGF、FGF、粒巨噬细胞集落刺激因子等)作用下都可不同程度动员和趋化为内皮细胞[8]。其中VEGF是血管生成的必需因子,它可以促进动脉、静脉及淋巴管来源的内皮细胞的生长,并维持血管正常状态和完整性,提高血管通透性,促血管生成,能特异性地促进血管内皮细胞有丝分裂,协调血管新生及血管形成。bFGF即是特异性促进内皮细胞的丝裂原,又是血管生成素、细胞生长因子,并且具有多种功能,其中与细胞迁移、分化及组织发育有关。因这2种诱导因子具有多种功能,并有较强的促血管作用[9],故本研究采用VEGF、bFGF诱导因子作为诱导剂[10],诱导单个核细胞培养成血管内皮细胞。
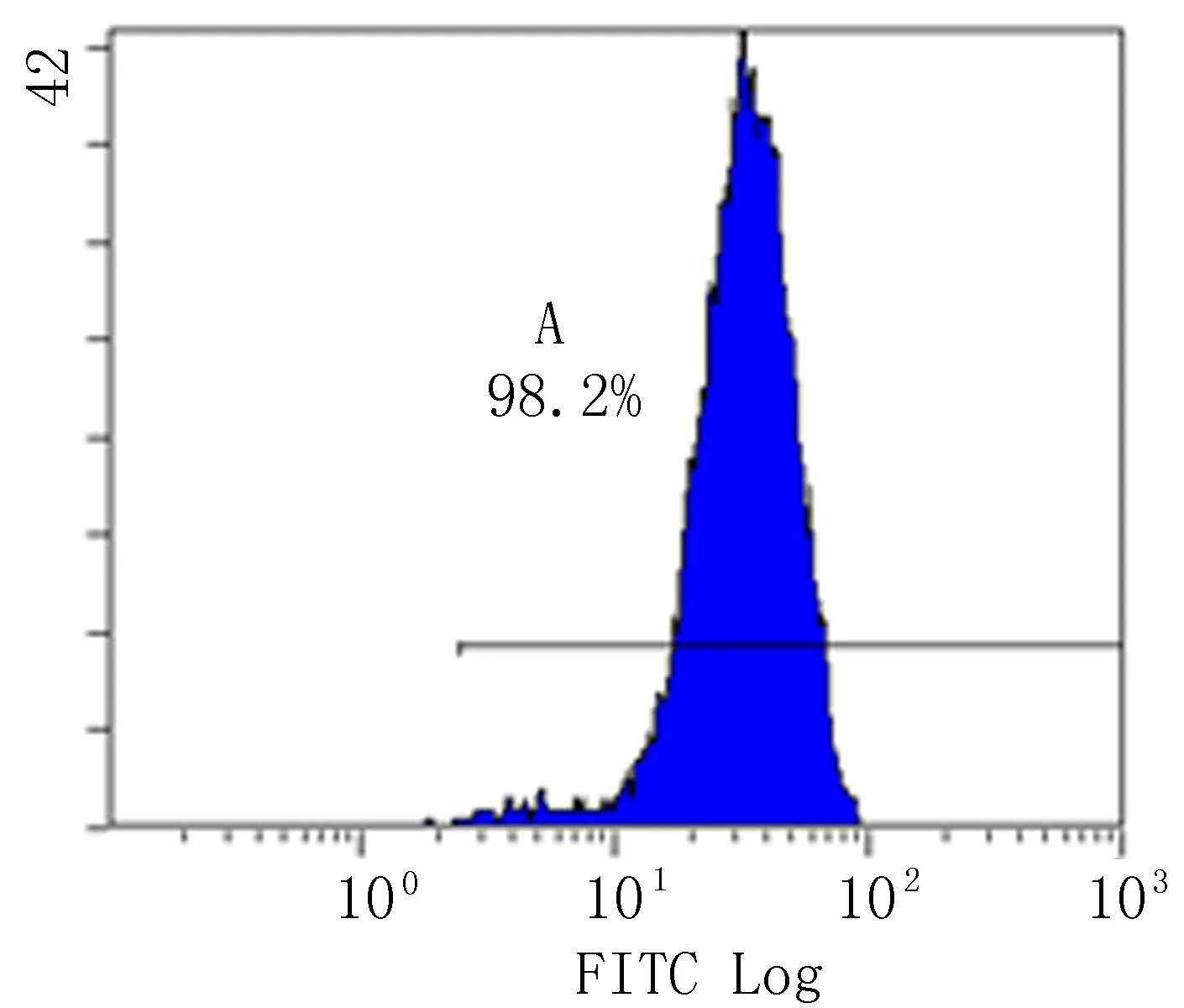
图9 实验组细胞表面特异性标记物vWF

图10 为vWF免疫荧光阳性表达
血管内皮细胞的鉴定方法及表面记标物仍处于争论阶段,依据相关研究发现:CD31、CD34、CD105、CD45、CD133、vWF、Flk-1、Tie-2等对于血管内皮细胞具有一定特异性[11]。其中vWF又称血管性假血友病因子,它是血管内皮细胞的重要鉴定因子,参与血管内皮细胞合成。CD31是成熟血管内皮细胞所特有的标记物,CD34在骨髓间充质干细胞不表达,而在血管内皮细胞中高表达。本实验经FACSCalibur流式细胞仪(Becton Dickinson)测定,单个核细胞群中CD31的阳性率为29.6%,CD34的阳性率为50.2%,显示弱表达,vWF的阳性率为98.2%,显示高表达。通过综合鉴定表明骨髓单个核细胞添加诱导剂后可诱导出血管内皮细胞。
本实验通过Ficoll密度梯度离心法分离骨髓获得单个核细胞,进一步诱导培养成内皮细胞,并对其进行生物学鉴定,通过细胞形态可初步确定为内皮细胞,进一步经过流式细胞仪检测细胞表面特异性标记物及细胞免疫荧光特异性染色阳性鉴定为血管内皮细胞,可证实骨髓单个核细胞内添加诱导剂后能在体外向血管内皮细胞诱导分化并保持一定的生物学特性。如何采取直接从骨髓单个核细胞诱导出产量足够、纯度够高的血管内皮细胞,且诱导时间是否与常用的方法相同,并能保持血管内皮细胞特有的生物学特性都是需要解决的问题,有待进一步研究。
参考文献:
[1] Zheng Y, Yi C, Xia W, et al. Mesenchymal stem cells transduced by vascular endothelial growth factor gene for ischemic random skin flaps[J]. Plastic Reconstructive Surg, 2008,21(1):59-69.
[2] Breyer A, Estharabadi N,Oki M,et al.Multipotent adult progenitor cell isolation and culture procedures[J].Exp Hematol,2006,34(11):1596-1601.
[3] 杨陆蒙,李新喜,白超,等.大鼠骨髓间充质干细胞培养方法的比较及细胞鉴定[J].新疆医科大学学报,2013,36(10):1451-1454.
[4] Ulloa-Montoya F,Kidder BL,Pauwelyn KA,et al.Comparative transcriptome analysis of embryonic and adult stem cells with extended and limited differentiation capacity[J].Genome Biol, 2007,8(8):163.
[5] Ebner HL, Blatzer M,Nawaz M,et al.Activation and nuclear translocation of ERK in response to ligand-dependent and-independent stimuli in liver and gill cells from rainbow trout[J]. J Exp Biol, 2007,210(Pt 6):1036-1045.
[6] Xu J, Liu X, Jiang Y,et al. MAPK/ERK signalling mediates VEGF-induced bone marrow stem cell differentiation into endothelial cell[J]. J Cell Mol Med, 2008,12(6A):2395-406.
[7] Battistella V, de Freitas GR, da Fonseca LM,et al.Safety of autologous bone marrow mononuclear cell transplantation in patients with nonacute ischemic stroke[J]. Regenerative Med, 2011,6(1):45-52.
[8] Lee S, Chen TT, Barber CL,et al.Autocrine VEGF signaling is required for vascular homeostasis[J]. Cell, 2007, 130(4):691-703.
[9] Asahara T, Murohara T, Sullivan A, et al. Isolation of putative progenitor endothelial cells for angiogenesis[J].Science,1997,275(5302):964-967.
[10] Sölder E,Böckle BC, Nguyen VA,et al.Isolation and characterization of CD133+CD34+VEGFR-2+CD45-fetal endothelial cells from human term placenta[J]. Microvascular Res, 2012,84(1):65-73.
[11] Zhao YH, Yuan B, Chen J,et al.Endothelial Progenitor Cells: Therapeutic Perspective for Ischemic Stroke[J]. CNS Neurosci Ther,2013,19(2):67-75.

