响应面分析法优化乳糖酶发酵培养基
赵从波,章淑艳,罗同阳,李宾
(河北省微生物研究所,河北 保定 071051)
0 引 言
乳糖酶(Lactase)学名β-D-半乳糖苷半乳糖水解酶(β-D-galactoside galactohydrase),能够水解β-D-半乳糖苷和α-L-阿拉伯糖苷,而催化乳糖的实用意义较大,故被研究得最多[1]。牛乳和乳清中含有大量乳糖,它是乳制品中的主要碳水化合物,乳糖酶的存在是乳糖在人体内进行正常代谢的一个必要条件,如果数量缺少或活性不够,就会导致消化障碍[2]。近年来,对米曲霉、黑曲霉、脆壁酵母、乳酸酵母等菌株乳糖酶的研究报道较多,而对青霉乳糖酶的研究相对较少。本文利用一株青霉菌发酵生产乳糖酶,为提高乳糖酶的酶活,采用PB设计和响应面法对其发酵条件进行研究,确定了最佳产酶条件,以期为乳糖酶的生产提供理论基础。
1 实 验
1.1 材料
菌株:青霉 Aspergillus oryzae。
主要试剂:邻硝基苯酚(ONP),邻硝基苯酚-β-D-半乳糖苷 (ONPG),pH值为5.5浓度为0.02 mol/L乙酸-乙酸钠缓冲液。
培养基:斜面培养基(PDA培养基)。基础发酵培养基:葡萄糖20 g,乳糖5 g,蛋白胨6 g,玉米浆3 g,MgSO4·7H2O 0.3 g,K2HPO4·3H2O 0.5 g,KH2PO40.5 g,Tween-80 1.5 mL,水1 000 mL。
1.2 方法
1.2.1 单孢子悬液的制备
取30℃条件下培养4 d的斜面菌种,加10 mL的无菌生理盐水,将孢子振荡打散,用带脱脂棉的漏斗进行过滤,然后用无菌生理盐水将孢子悬液稀释。血球计数板测定孢子浓度。
1.2.2 培养方法
将菌种转接斜面活化,待孢子成熟后制备孢子悬液,接种发酵培养基进行摇瓶发酵,接种量104mL-1。发酵条件:30℃,200 r/min,装液量100 L/500 L。
1.2.3 绘制标准曲线
ONP标准液的制备:称取139.0 mg的邻硝基苯酚,用10 mL体积分数为95%的乙醇溶解后,转移至1 000 mL的容量瓶中,用水定容并摇匀。
分别移取邻硝基苯酚储备液2,4,6,8,10,12 mL和14 mL到100 mL的容量瓶中,分别加入25 mL的碳酸钠溶液,再用反应缓冲液定容至刻度,摇匀,溶液邻硝基苯酚的浓度分别是0.02,0.04,0.06,0.08,0.10,0.12 mmol/L和0.14 mmol/L。选择合适的分光光度计,用1 cm的吸收池,用水作空白,在420 nm处测定每个稀释液的吸光度[3],结果如表1所示。
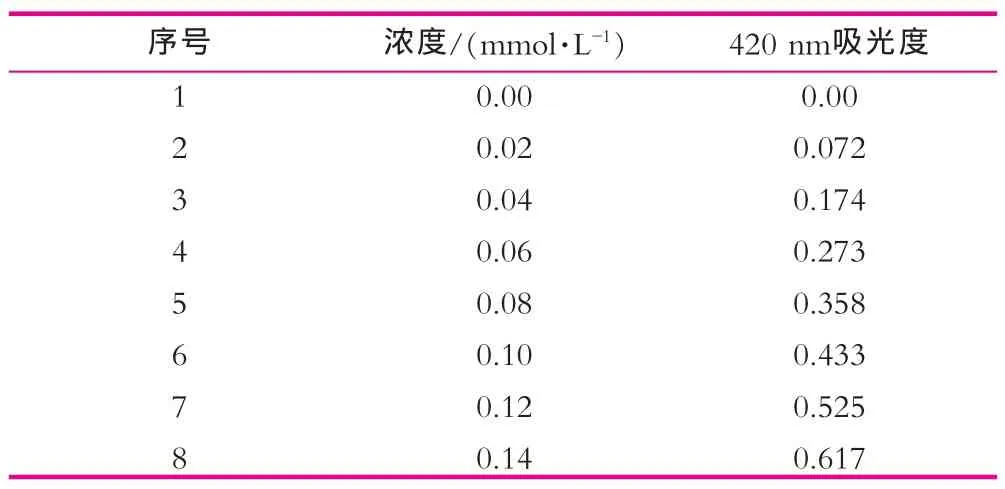
表1 不同浓度邻硝基苯酚420 nm处吸光度
以420 nm处吸光度为横坐标,邻硝基苯酚的浓度为纵坐标,绘制标准曲线,结果如图1所示。

图1 乳糖酶酶活标准曲线
1.2.4 粗酶液的制备
发酵液在4℃条件下,10 000 r/min离心15 min,取上清液测定酶活。
1.2.5 酶活测定
邻硝基苯酚β-D半乳糖苷(ONPG)溶于浓度为0.02 mol/L乙酸缓冲液(pH值为5.5)配制成质量分数为0.25%的底物溶液。取400 μL酶液加入1 600 μL底物溶液中,50℃保温15 min。加入2 mL浓度为1 mol/L的Na2CO3显色,测定420 nm光吸收值。计算水解产物邻硝基酚(ONP)的含量和酶活性。
酶活力单位定义:一个酶活单位(U)即在55℃和pH值5.5条件下每分钟将ONPG分解为l μmol黄色的ONP所需的酶量。
1.2.6 培养基优化方法
采用Plackett-Burman设计法,最陡爬坡实验和响应面法。
2 结果分析
2.1 PB设计筛选主要因素
PB设计法是一种两水平的试验设计方法,它可以用最少的试验次数使各因素的主效应得到尽可能精确的估计,从众多考察因素中快速筛选出最为重要的几个因素,以供进一步研究[4]。本研究选用实验次数N=12的设计,培养基中的8种成分:葡萄糖、乳糖、蛋白胨、玉 米 浆 、MgSO4·7H2O、 K2HPO4·3H2O、 KH2PO4、Tween-80,分别作为PB设计中的8个因素x1x2x3…x8,每个因素取两个水平,低水平“–”为原始培养条件,高水平 “+”取低水平的1.25倍。响应值为乳糖酶酶活(Y)。实验设计水平及编码如表2所示;实验设计、数据分析及模型建立均采用Minitab 16软件来进行,实验设计及结果如表3所示,各因素效应及评价如表4所示。
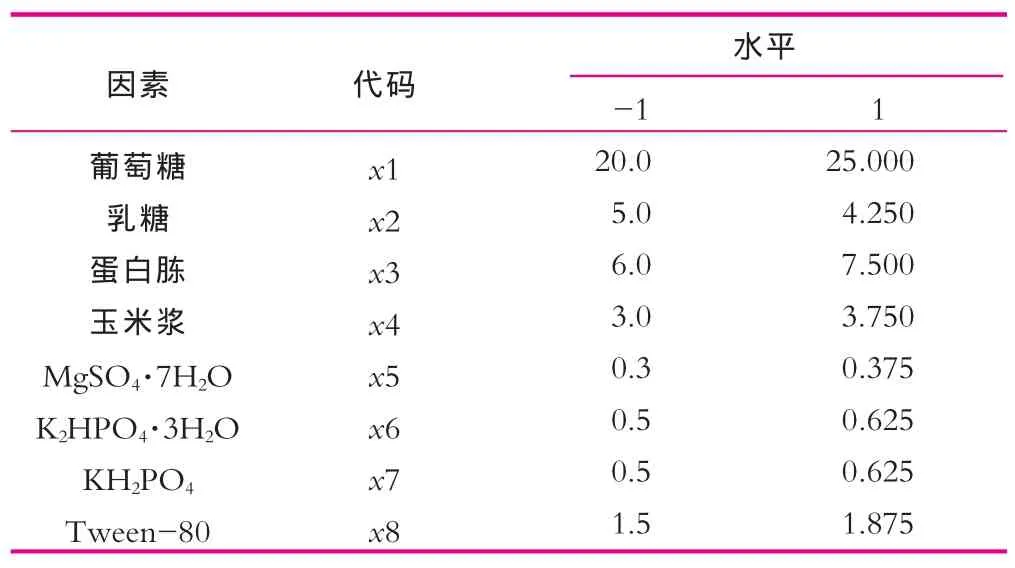
表2 PB实验设计水平及编码

表3 PB实验设计及结果
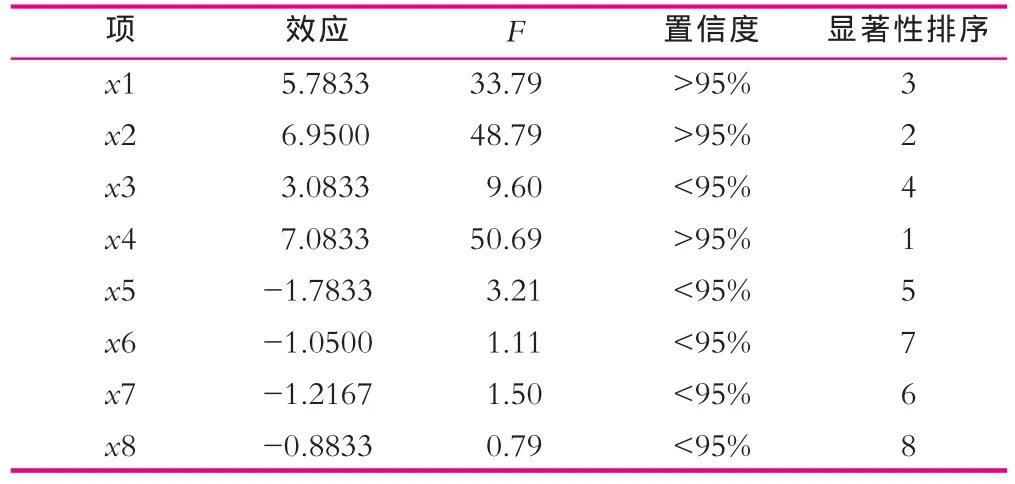
表4 各因素效应值及显著性分析
由表4可以看出,葡萄糖、乳糖和玉米浆对青霉产乳糖酶的结果有显著影响,可信度均大于95%,3个因素均为正效应,因此,提高3个因素的浓度可以提高乳糖酶的酶活。
2.2 最陡爬坡实验
由于葡萄糖、乳糖和玉米浆3个因素的浓度对乳糖酶的酶活有显著影响,且均为正效应,应提高浓度。根据效应的大小确定爬坡步长,逼近最大区域。实验设计及结果如表5所示。
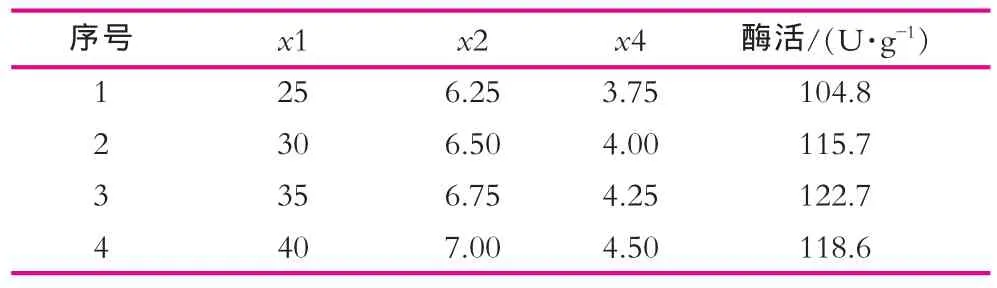
表5 最陡爬坡实验设计及结果
由表5得知,最佳结果在实验3和4之间,故以实验3为实验中心点做响应面设计。
2.3 响应面法优化最佳培养基
利用minitab16软件,根据Box-behnken的中心组合设计原理进行实验,以葡萄糖、乳糖和玉米浆为自变量,以乳糖酶酶活为响应值,实验因素水平如表6所示,实验设计及结果如表7所示。

表6 中心组合实验变量及水平
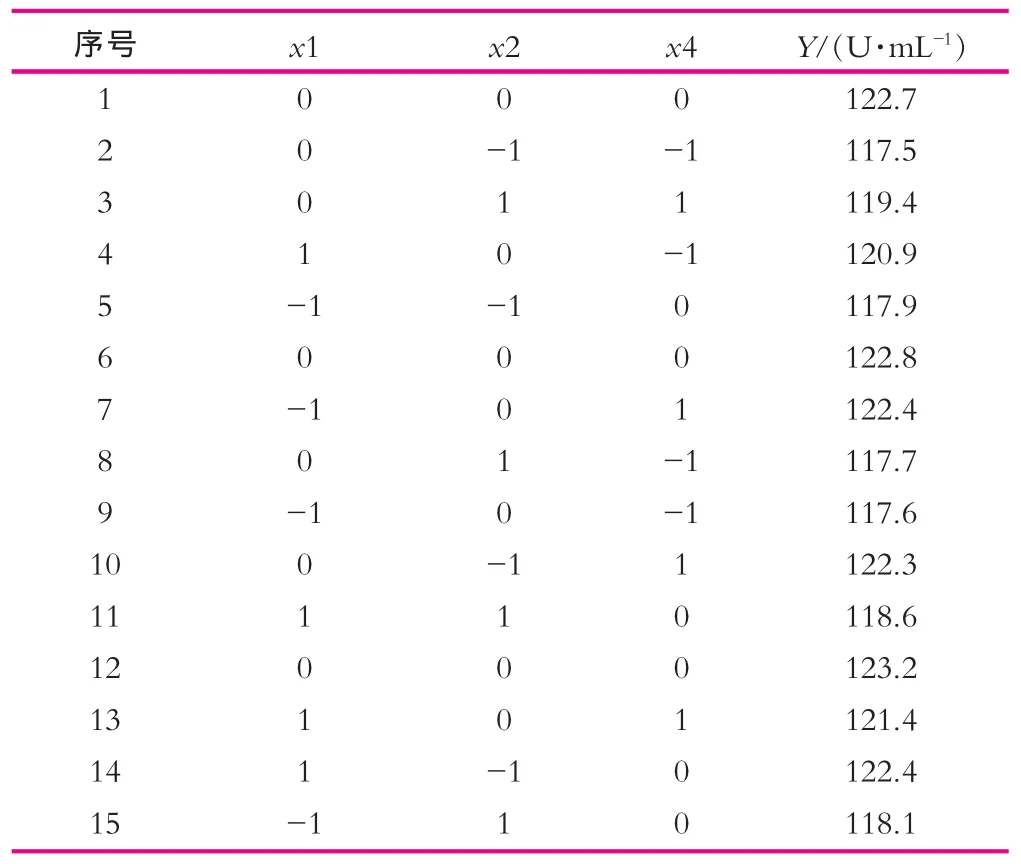
表7 中心组合实验设计及结果
以乳糖酶酶活为响应值,根据表7的实验结果,用minitab16软件对数据进行二次回归分析,得到的回归方程为:
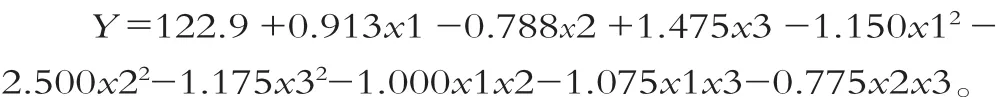
分析结果如表8和表9所示。
模型的相关系数R2=98.12%,调整后R2=94.74%,说明此模型与实验拟合很好,能够很好地预测发酵培养基组分与乳糖酶酶活的关系。
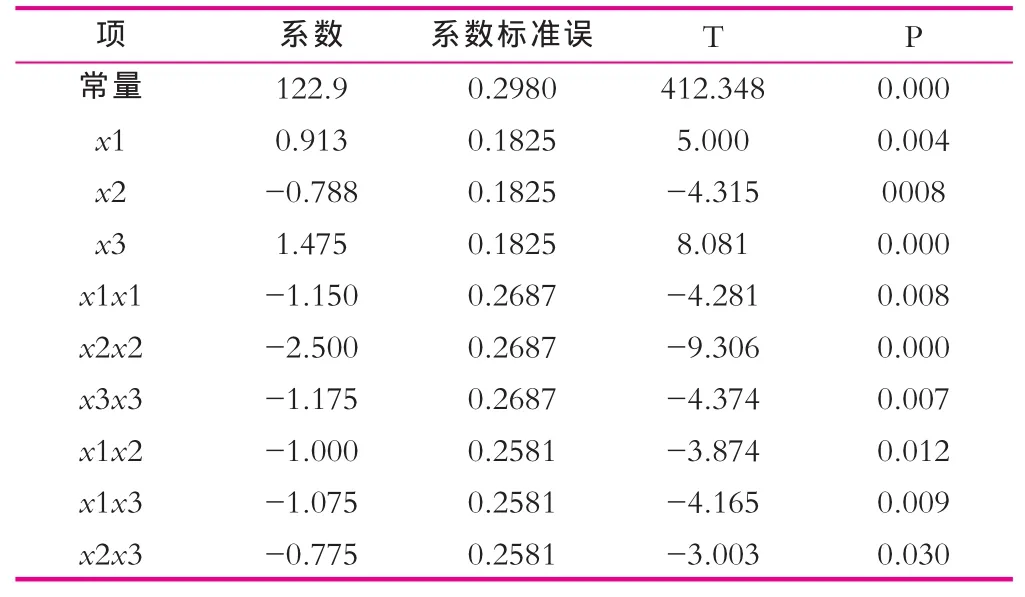
表8 回归系数检验
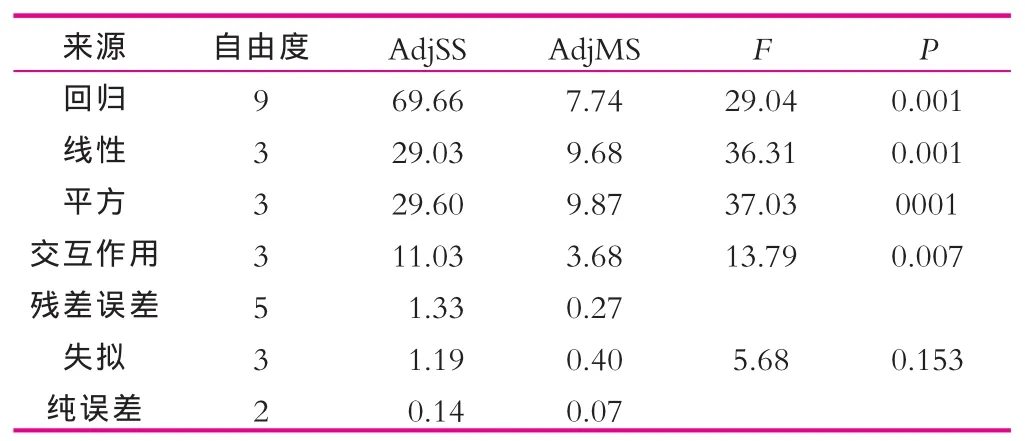
表9 方差分析结果
构建乳糖酶酶活与发酵培养组分葡萄糖、乳糖和玉米浆的三维空间响应面图,结果如图2~图4所示。
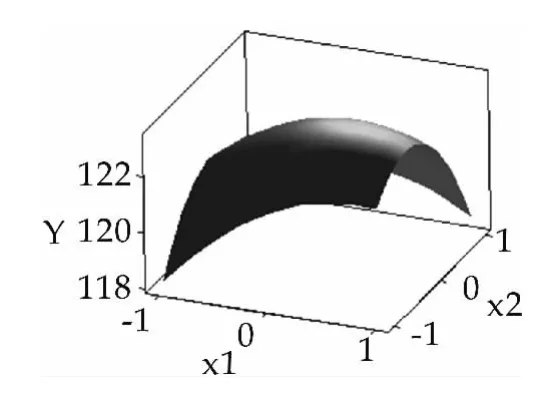
图2 Y与x1,x2的响应面
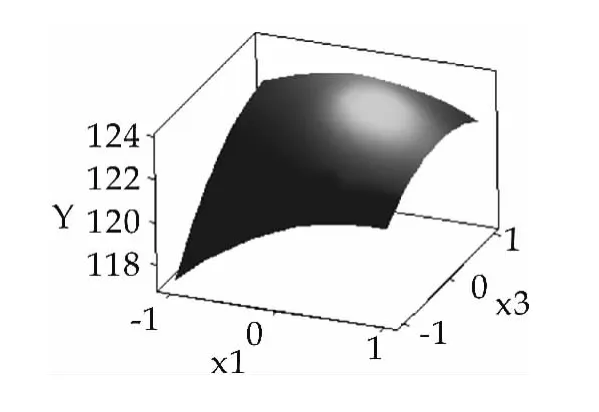
图3 Y与x1,x3的响应面
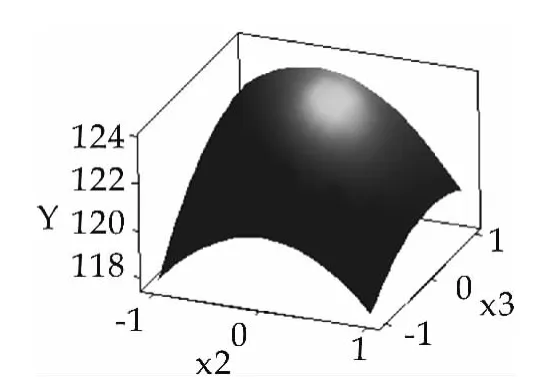
图4 Y与x2,x3的响应面
由图2~图4可以看出,此模型具有最大值,利用minitab16软件响应优化器进行优化,最大处x1=0.2323,x2=-0.2929,x3=0.6162, 以上代码换算可得:x1=36.2,x2=6.7,x3=4.4,在此条件下,预测的乳糖酶酶活为123.6 U/mL。
2.4 模型的验证
为了确定实验结果的可靠性,对上述优化的培养基和初始培养基进行了验证性实验,分别做了3组平行实验。乳糖酶的酶活达到了124.3 U/mL,与预测值非常接近,仅相差0.57%,比初始培养提高了32.3%。
3 结 论
Plackett-Burman设计法和响应面分析法在微生物发酵培养基的优化中广泛应用,并取得了良好的效果,本研究应用这两种方法对青霉液体发酵产乳糖酶的发酵培养基进行了优化,最终确定了最佳的发酵培养基为:葡萄糖36.2 g/L,乳糖6.7 g/L,蛋白胨6 g/L,玉米浆4.4 g/L,MgSO4·7H2O 0.3 g/L,K2HPO4·3H2O 0.5 g/L,KH2PO40.5 g/L,Tween-80 1.5 mL/L。 在此条件下,乳糖酶的酶活比初始培养基提高了32.3%。
[1]陈鞠声,胡学智.酶制剂生产技术[M].北京:工业出版社,1994:416-423.
[2]顾佳升,夏静.乳糖及其代谢障碍[J].乳业科学与技术,2003,26(1):17-23.
[3]赵华梅,王曼霞等.乳糖酶制剂活力测定方法的研究[J].食品科技.2010,35(4):240-246.
[4]张锋华,许煜泉,张雪洪.采用响应面分析法优化吩嗪-1-羧酸的发酵条件[J].现代农药,2007,6(2):15-18.

