内蒙古白绒山羊翻译控制肿瘤蛋白(TCTP)基因克隆及组织表达特性分析
杨立敏 姚睿原 郭志新 朝格图 其布日 郑旭 鲍文蕾 王志钢
(内蒙古大学生命科学学院,呼和浩特 010021)
翻译控制肿瘤蛋白(Translationally controlled tumor protein,TCTP)也称为组胺释放因子(HRF),包括P21、P23、TPT-1和Q23,存在于许多真核生物中,是由172个氨基酸组成的亲水性蛋白质[1],不包含任何疏水性跨膜结构域或细胞器的定位信号[2],主要存在于细胞质中[3],具有进化上的高度保守性。TCTP在许多组织和各类型的细胞中广泛表达[4],在细胞代谢及各类生物体维持正常功能过程中起着至关重要的作用,包括调节细胞周期的进程[5],抗细胞凋亡[6],蛋白质合成[7],参与调节炎症反应、应激反应、细胞生长增殖和分化,癌症发生[8,9]等。
Rheb(Ras homolog enriched in brain)是Ras超家族的一员,是哺乳动物雷帕霉素靶蛋白(the mammalian target of rapamycin,mTOR)信号通路中的上游调节因子,具有整合营养和促细胞分裂信号的功能。细胞内Rheb以两种状态存在,即与GTP结合的活性状态和与GDP结合的无活性状态,Rheb-GTP形式可以激活下游的mTOR信号通路调节细胞的生理活动。有报道认为,TCTP是调控Rheb的鸟嘌呤核苷酸交换因子(Guanine nucleotide exchange factor,GEF),可以使得Rheb结合GTP而有活性。果蝇中TCTP低表达可导致果蝇的细胞、器官变小,细胞数量减少,即出现Rheb突变表型[10],TCTP直接与Rheb相互作用完成鸟苷酸交换活动,人类的TCTP也有类似的功能[11]。但也有报道指出,在体外实时荧光分析试验中却没有发现hTCTP具有GEF活性,RNA干扰低表达TCTP对S6K磷酸化水平也没有显著改变[12];Wang等[13]发现超表达hTCTP对HEK293细胞的S6磷酸化水平没有显著影响。TCTP作为Rheb的鸟苷酸交换因子受到了争议,其中的关键问题是TCTP是否可以与Rheb具有相互作用关系。
我们之前的工作已经克隆了内蒙古白绒山羊的Rheb基因,但TCTP基因及其编码的蛋白尚未有相关研究报道。本研究试图建立有效克隆内蒙古白绒山羊TCTP基因的RT-PCR体系,克隆该基因的编码区cDNA片段,为进一步通过酵母双杂交方法确定与Rheb的相互作用关系提供条件;同时建立定量RT-PCR 体系,分析TCTP基因的基本表达模式,为进一步研究该基因产物在介导营养信号调控细胞生长及机体发育中的作用提供条件。
1 材料与方法
1.1 材料
1.1.1 供试材料 内蒙古白绒山羊器官组织采自内蒙古鄂托克旗白绒山羊商业屠宰场屠宰后的羊体。
1.1.2 试剂 总RNA 提取试剂盒(RNAiso Reagent),RNase Inhibitor,RNase Free dH2O,克隆载体pMD19-T Vector,T4 DNA 连接酶、限制性内切酶EcoRⅠ、SalⅠ,DNA分子量标准DL2000、λ-EcoT14Ⅰdigest DNA Marker,2×SYBR Premix EXTaqTMⅡ试剂盒均购自宝生物工程(大连)有限公司(TaKaRa);反转录试剂盒(M-MLV First Strand Kit)购自上海英骏生物技术有限公司(Invitrogen),氨苄青霉素、胰蛋白酶(Trypsin)、标准胎牛血清(Fetal bovine serum,FBS)购自Sigma 公司;质粒提取试剂盒(Biospin Plasmid DNA Extraction Kit)购自博日科技有限公司(BIOER),凝胶回收试剂盒(AxyPrepTMDNA Gel Extraction Kit 50-prep)购自爱思进生物技术(杭州)有限公司(AXYJEN);DMEM /F12培养基、PBS为Gibco 产品;感受态大肠杆菌DH5α 由本实验室制备。其余试剂均为国产分析纯。
1.2 方法
1.2.1 动物组织及细胞培养 内蒙古白绒山羊的肾脏、肌肉、胰腺、肝脏、睾丸和脑组织现场采集后立即放入液氮冷冻,带回实验室置-80℃保存。胎儿成纤维细胞培养采用单层培养的方法,所用培养基为含有10% FBS的DMEM/F12,37℃、5% CO2、饱和湿度条件下培养。
1.2.2 总RNA 的提取及反转录 按总RNA提取试剂盒(RNA iso Reagent)说明书的操作方法分别提取内蒙古白绒山羊胎儿成纤维细胞及肾脏、肌肉、胰腺、肝脏、睾丸和脑组织的总RNA,琼脂糖凝胶电泳验证RNA 完整性,保存于-80℃备用。用Oligo(dT)20Primers按照反转录酶M-MLV说明书的方法反转录合成cDNA第一链。以胎儿成纤维细胞提取总RNA合成cDNA(cDNA1)为模板PCR 扩增TCTP基因编码区片段。以肾脏、肌肉、胰腺、肝脏、睾丸和脑组织提取总RNA合成cDNA(cDNA2)为模板,RT-PCR检测TCTP基因在各组织中的表达情况。
1.2.3 内蒙古白绒山羊TCTP基因的分子克隆 根据GenBank中牛(BT021036.1)和绵羊(EU370543.1)TCTP 基因核苷酸序列,设计PCR 特异性简并引物P1(表1),以反转录合成的cDNA1为模板进行PCR扩增,PCR扩增的反应为10 μL体系:模板cDNA 1 μL;P1(10 μmol/L)0.4 μL;P2(10 μmol/L)0.4 μL;d3H2O 3.2 μL;Trans Mix HiFi 5 μL。PCR反应程序:94℃预变性4 min;94℃ 30 s,55℃ 30 s,72℃ 35 s,30 个循环;72℃ 10 min。预期片段长度519 bp。PCR 反应产物经1%琼脂糖凝胶电泳,用胶回收试剂盒回收特异条带。回收产物与pMD19-T 载体连接,转化E. coliDH5α感受态细胞,接种于含Amp+的LB培养基,37℃培养14 h,筛选重组菌落,提取质粒,质粒经电泳、PCR和酶切(EcoRI/SalI)鉴定正确后送华大基因有限公司测序。
1.2.4 生物信息学分析 测序得到的内蒙古白绒山羊TCTP基因cDNA 序列用NCBI的BLAST(http://www.ncbi.nlm.nih.gov/BLAST/)进行序列比对,开放阅读框(ORF)预测采用ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html),理论分子量大小和蛋白等电点预测采用软件(http://isoelectric.ovh.org/),预测蛋白质二级结构利用Swiss-Model workspace(http://swissmodel.expasy.org/)[14-16],蛋白质功能位点分析采用Psite程序(http://www.softberry.com),进化树建立使用CLC软件,蛋白质亚细胞定位采用ProtComp Version 9.0程序(http://linux1.softberry.com/)。
1.2.5 组织特异性表达检测 根据TCTP基因的CDS区序列设计定量PCR引物P2(表1),预期片段长度为169 bp。选用2×SYBR Premix EXTaqTMⅡ试剂盒在罗氏实时定量PCR仪对各组织TCTP基因mRNA丰度进行定量检测。不同组织的TCTP基因mRNA拷贝数使用β-actin作为内参进行校正,根据β-actin基因序列设计定量PCR引物P3(表1),预期片段长度 229 bp。采用20 μL反应体系,其中包括2 μL cDNA模板,10 μL 2×SYBR Premix EXTaqTMⅡ,0.8 μL引物,6.4 μL dH2O。每个样本设3个重复,分别使用 P2和P3进行扩增。优化后的退火温度为48℃,产物特异性使用熔解曲线判定。每个组织的TCTP基因mRNA相对表达量,使用2-DCt表示,其中DCt = Cttargetgene- Ctβ-actin。

表1 本研究中用到的各引物基本信息
2 结果
2.1 TCTP基因克隆与序列测定
PCR 扩增产物经电泳鉴定后得到与预期片段大小相符的特异性条带(图1)。重组质粒(pMD19-TTCTP)经PCR和酶切双重鉴定正确(图2)。测序结果表明,扩增片段全长519 bp,包括了全部的ORF。

图1 PCR 扩增产物TCTP的电泳鉴定
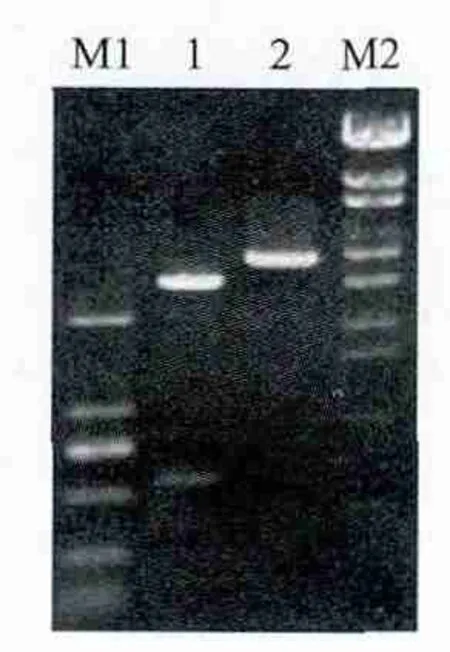
图2 重组质粒pMD19-T-TCTP的酶切鉴定
2.2 TCTP基因序列分析及同源性比较
测序得到的内蒙古白绒山羊TCTP基因cDNA核酸序列中G+C含量为65.55%(图3)。核苷酸序列与绵羊(NM-001280680.1)、牛(BT021036.1)、猪(NM-214373.1)、人(X16064.1)、猴(XM-0010-90279.2)及大鼠(NM-053867.1)的同源性分别为99%、99%、97%、97%、95%和95%,相应的氨基酸序列同源性均达到99%以上。与已报道的7个物种的TCTP基因核苷酸序列构建进化树(图4),表明内蒙古白绒山羊与绵羊和牛的亲缘关系较近。

图3 内蒙古白绒山羊TCTP基因cDNA核苷酸序列及预测氨基酸序列

图4 根据TCTP基因核苷酸序列构建的进化树
2.3 编码蛋白分析
内蒙古白绒山羊TCTP基因编码一个由172个氨基酸残基组成的蛋白质。该蛋白理论分子质量19.6 kD,等电点(pI)4.673,氨基酸组成中Glu含量最高,为11%。利用Swiss-Model workspace预测蛋白质二级结构获得3D图像(图5),Psite分析(图6)表明在51-54氨基酸位有一个N端糖基化位点,在98-100氨基酸位有一个蛋白激酶C磷酸化位点,有3个酪蛋白激酶Ⅱ磷酸化位点分别在9-12氨基酸位、37-40氨基酸位、68-71氨基酸位,48-63氨基酸是翻译控制肿瘤蛋白特征序列1,134-153氨基酸是翻译控制肿瘤蛋白特征序列2。ProtComp Version 9.0程序分析将其定位于细胞质中。

图5 TCTP蛋白3D图(1-172氨基酸序列)

图6 内蒙古白绒山羊TCTP氨基酸序列与其他物种氨基酸序列比较及Psite活性位点分析
2.4 组织表达特异性分析
组织定量RT-PCR分析(图7)表明,TCTP基因在绒山羊肾脏、肌肉、胰腺、肝脏、睾丸和脑组织中均有表达,其中在肝脏中的表达量较高,在脑中表达量较低。
3 讨论

图7 定量RT-PCR检测内蒙古白绒山羊TCTP基因组织表达特异性
翻译控制肿瘤蛋白(TCTP)是一种高度保守的蛋白,存在于真核生物中,本试验克隆得到的内蒙古白绒山羊TCTP基因编码区序列全长519 bp,与已报道的几种哺乳动物的序列长度相同且比对显示同源性较高,Psite程序分析显示克隆得到的TCTP基因含有TCTP特征序列1和TCTP特征序列2,表明克隆的内蒙古白绒山羊TCTP基因正确。
TCTP在真核生物中广泛表达,过去的研究已发现在500多个不同的组织和细胞类型中均存在,但依据组织和细胞类型及其不同的生长阶段,表达水平差别极大,在有丝分裂活跃的组织中表达量相对较高,在有丝分裂期后的组织中表达量相对较低[17,18]。Fiucci等[19]研究发现TCTP在小鼠多个组织中均有表达,并且在脑中表达量最低,在肝脏和肾脏中表达量最高。本研究定量RT-PCR检测结果表明,TCTP基因在内蒙古白绒山羊肾脏、肌肉、胰腺、肝脏、睾丸和脑中均有表达,表达量在肝脏中较高,在脑中较低,与小鼠中的表达模式基本一致,表明TCTP在结构与功能上的高度保守性。
虽然TCTP缺乏核双向定位信号序列,但其作为一种抗氧化蛋白[20]在细胞质和细胞核中均有分布[21,22]。TCTP蛋白通常具有公认的小泛素样(SUMO化)修饰,这种修饰可能在其核运输中起着非常重要的作用[23]。细胞内一些蛋白与TCTP蛋白在结构和功能上密切相关,TCTP保守的β-折叠区域对它与其它分子间的相互作用非常重要,如与Bcl-XL结合可以完成抗凋亡活动[24];α-螺旋区域与Ca2+[25,26]和微管蛋白结合[27,28],对钙传输和进一步的信号转导起着重要作用。作为一种管家基因,除了GEF的作用,TCTP在许多细胞生理中发挥功能。
内蒙古白绒山羊是经过长期自然选育形成的优良地方性绒肉兼用型品种,对营养的需求、利用与代谢有其特殊性,机体对营养和能量信号刺激的敏感性在绒肉发育中起着重要的作用,但机制尚不清楚。mTOR信号通路是细胞内介导营养信号调控细胞生长与代谢的中心协调器,如能确定TCTP通过与Rheb的直接作用而实现其GEF功能,则能确定TCTP对mTOR信号通路的调控作用。本研究正确克隆了内蒙古白绒山羊TCTP基因并对其基本表达模式进行了分析,这些结果将为进一步研究TCTP在绒山羊细胞生长和早期胚胎发育中的功能及发挥作用的分子机制提供条件。
4 结论
克隆的内蒙古白绒山羊TCTP基因cDNA序列为519 bp,包含了全长ORF。TCTP基因在肾脏、肌肉、胰腺、肝脏、睾丸和脑组织中均有表达,其中在肝脏中的表达量最高,在脑中表达量最低。TCTP基因的克隆为下一步研究其与Rheb之间的相互作用提供了条件。
[1] Savarino A, Mai A, Norelli S, et al. “Shock and kill” effects of class I-selective histone deacetylase inhibitors in combination with the glutathione synthesis inhibitor buthionine sulfoximine in cell line models for HIV-1 quiescence [J] . Retrovirology, 2009, 6(10):52-61.
[2] Li F, Zhang D, Fujise K. Characterization of fortilin, a novel antiapoptotic protein [J] . The Journal of Biological Chemistry,2001, 276(10):47542-47549.
[3] Sanchez JC, Schaller D, Ravier F, et al. Translationally condrolled tumor protein:a protein identified in several nontumoral cells including erythrocytes [J] . Electrophoresis, 1997, 18(1):150-155.
[4] Deng SS, Xing TY, Zhou HY, et al. Comparative proteome analysis of breast cancer and adjacent normal breast tissues in human [J] .Genomics Proteomics Bioinformatics, 2006, 4(3):165-172.
[5] Brioudes F, Thierry AM, Chambrier P, et al. Translationally controlled tumor protein is a conserved mitotic growth integrator in animals and plants [J] . Proc Natl Acad Sci USA, 2010, 107(37):16384-16389.
[6] Slaby O, Sobkova K, Svoboda M, et al. Significant overexpression of Hsp110 gene during colorectal cancer progression [J] . Oncol Rep,2009, 21(5):1235-1241.
[7] Cans C, Passer BJ, Shalak V, et al. Translationally controlled tumor protein acts as a guanine nucleotide dissociation inhibitor on the translation elongation factor eEF1A [J] . Proc Natl Acad Sci USA,2003, 100(24):13892-13897.
[8] Gnanasekar M, Thirugnanam S, Zheng G, et al. Gene silencing of translationally controlled tumor protein(TCTP)by siRNA inhibits cell growth and induces apoptosis of human prostate cancer cells [J] .International Journal of Oncology, 2009, 34(5):1241-1246.
[9] Miao X, Chen YB, Xu SL, et al. TCTP overexpression is associated with the development and progression of glioma [J] . Tumor Biology, 2013, Epub ahead of print.
[10] Patel PH, Thapar N, Guo L, et al. Drosophila Rheb GTPase is required for cell cycle progression and cell growth [J] . Journal of Cell Science, 2003, 116(Pt17):3601-3610.
[11] Hsu YC, Chern JJ, Cai Y, et al. Drosophila TCTP is essential for growth and proliferation through regulation of dRheb GTPase [J] .Nature, 2007, 445(7129):785-788.
[12] Rehmann H, Bruning M, Berghaus C, et al. Biochemical characterisation of TCTP questions its function as a guanine nucleotide exchange factor for Rheb [J] . FEBS Letters, 2008, 582(20):3005-3010.
[13] Wang X, Fonseca BD, Tang H, et al. Re-evaluating the roles of proposed modulators of mammalian target of rapamycin complex 1(mTORC1)signaling [J] . The Journal of Biological Chemistry,2008, 283(45):30482-30492.
[14] Arnold K, Bordoli L, Kopp J, et al. The SWISS-MODEL Workspace:A web-based environment for protein structure homology modeling [J] . Bioinformatics, 2006, 22(2):195-201.
[15] Schwede T, Kopp J, Guex N, et al. SWISS-MODEL:an automated protein homology-modeling server [J] . Nucleic Acids Research,2003, 31(13):3381-3385.
[16] Guex N, Peitsch MC. SWISS-MODEL and the Swiss-PdbViewer:An environment for comparative protein modeling [J] .Electrophoresis, 1997, 18(15):2714-2723.
[17] Bommer UA, Thiele BJ. The translationally controlled tumour protein(TCTP)[J] . International Journal of Biochemistry and Cell Biology, 2004, 36(3):379-385.
[18] Thiele H, Berger M, Skalweit A, et al. Expression of the gene and processed pseudogenes encoding the human and rabbit translationally controlled turnout protein(TCTP)[J] . European Journal of Biochemistry, 2000, 267(17):5473-5481.
[19] Fiucci G, Lespaqnol A, Stumptner-Cuvelette P, et al. Genomic organization and expression of mouse Tpt1 gene [J] . Genomics,2003, 81(6):570-578.
[20] Gnanasekar M, Ramaswamy K. Translationally controlled tumor protein ofBrugia malayifunctions as an antioxidant protein [J] .Parasitology Research, 2007, 101(6):1533-1540.
[21] Johansson H, Vizlin-Hodzic D, Simonsson T, et al. Translationally controlled tumor protein interacts with nucleophosmin during mitosis in ES cells [J] . Cell Cycle, 2010, 9(11):2160-2169.
[22] Cheng X, Li J, Deng J, et al. Translationally controlled tumor protein(TCTP)down regulates Oct4 expression in mouse pluripotent cells[J] . BMB Rep, 2012, 45(1):20-25.
[23] Gnanasekar M, Ramaswamy K. Sumoylation of human translationally controlled tumor protein is important for its nuclear transport[J] . Biochemistry Research International, 2012, 2012:doi:10.1155/2012/831940.
[24] Yang Y, Yang F, Xiong Z, et al. An N-terminal region of translationally controlled tumor protein is required for its antiapoptotic activity [J] . Oncogene, 2005, 24(30):4778-4788.
[25] Kim M, Jung Y, Lee K, et al. Identification of the calcium binding sites in translationally controlled tumour protein [J] . Archives of Pharmacological Research, 2000, 23(6):633-636.
[26] Arcuri F, Papa S, Meini A, et al. The translationally controlled tumor protein is a novel calcium binding protein of the human placenta and regulates calcium handling in trophoblast cells [J] .Biol Reprod, 2005, 73(4):745-751.
[27] Gachet Y, Tournier S, Lee M, et al. The growth-related, translationally controlled protein P23 has properties of a tubulin binding protein and associates transiently with microtubules during the cell cycle [J] . Journal of Cell Science, 1999, 112(Pt8):1257-1271.
[28] Jaglarz MK, Bazile F, Laskowska K, et.al. Association of TCTP with centrosome and microtubules [J] . Biochemistry Research International, 2012, 2012:doi:10.1155/2012/541906.

