L-酪氨酸分子印迹传感器敏感膜的制备与性能研究
申贵隽,熊 迪
(大连大学 环境与化学工程学院,辽宁 大连 116622)
0 引言
L-酪氨酸是人体不能合成的芳香族氨基酸,为非必需氨基酸。在医药领域,L-酪氨酸是合成各种物质的前体原料,如甲状腺素、肾上腺素、左旋多巴和酪氨酸亚硫酸盐等[1];在临床上,酪氨酸亚硫酸盐用于治疗各种中枢神经系统疾病骨髓灰质炎,如结核性脑膜炎的急性期、神经分裂症、无力综合征以及老年性精神病等[2]。目前,检测L-酪氨酸的含量方法主要有色谱法、流动注射化学发光法、极谱法、毛细管电泳法和光度法等[3-5],这些检测方法消耗时间长、程序繁琐、所需费用高且容易被污染,因此建立一种快速、高效且价廉的分离检测L-酪氨酸的方法具有重要的现实意义。
分子印迹技术起源于以抗原合成抗体的研究理论[15],并经过一定时间的思想萌芽[16,17]。在1972 年,德国Wulff 研究组提出了分子印迹聚合物的概念[18],代表着分子印迹理论的正式提出。而1993 年George等[19]报道了分子印迹聚合物的研究,极大的推动了分子印迹技术的发展。分子印迹聚合物的高选择性与稳定性等特殊性质,使得分子印迹技术在色谱分离、固相萃取、仿生传感器、模拟酶催化和膜分离等诸多领域得到广泛应用[8-12]。近年来,将分子印迹技术应用于传感器识别元件[9,13],利用分子印迹敏感膜的特异识别性与电化学传感器的导高灵敏度相结合成为国内外研究热点之一。
电化学聚合方法可制备具有特异识别性的聚合物薄膜[9,14],通过改变聚合电位和聚合缓冲液组分等条件实现聚合过程的控制,从而获得不同厚度、不同电性能的聚合物膜。为此,本文利用邻苯二胺通过电化学聚合制备对L-酪氨酸具有特异识别性的分子印迹传感器敏感膜,从而实现对L-酪氨酸的快速检测。
1 实验部分
1.1 仪器与试剂
邻苯二胺(o-PD)、铁氰化钾和氯酸钾;氮气(纯度>99.5%);L-苯丙氨酸(L-Phe)、L-丙氨酸(L-Ala)、L-色氨酸(L-Trp)和L-天冬氨酸(L-Asp)均为生物纯;实验用水均为二次蒸馏水,其它试剂均为分析纯。
CV 法和DPV 法测试均在CS300 工作站(上海辰华仪器公司)上进行,EIS 法测试在CHI660D 工作站(上海辰华仪器公司)采用三电极体系:金电极为工作电极,钛丝电极为辅助电极,饱和甘汞电极为参比电极。
1.2 金电极的预处理
如图1,将金电极在砂纸上打磨后在均匀鹿皮上抛光(用0.05 μm 的氧化铝粉)之后,浸入热混合溶液[V(浓硫酸):V(30%H2O2)=3:1]中清洗10 min。取出电极用去离子水冲洗,依次分别在去离子水、硝酸(1:1)、无水乙醇、去离子水中清洗5 min,然后在0.5 mol/L 硫酸溶液中与-1~1 V 进行循环伏安(CV)电化学处理,直到获得稳定的循环伏安电流响应。再将金电极放入 10 mol/L KCLO3和 10 mmol/L K3[Fe(CN)6]的混合液(混合比例1:1)中,于-0.6~0.4 V 分别用CV 法、DPV 法检验电极活性,所有操作均在室温下进行。

图1 0.5 mol/L 硫酸溶液中活化裸金电极
1.3 分子印迹敏感膜的制备
将4 mmol/L 的 L-酪氨酸和10 mmol/L 的邻苯二胺混合液(比例1:1)溶液通氮气除氧10 min 自组装4 h,在-1~1 V 电位范围内并设置扫描速度为50 mV/s,运用CV 法扫描50 圈,在磷酸缓冲溶液(pH=8.0)中使邻苯二胺电聚合成膜。取出电极,用去离子水冲洗,放入10 mmol/L K3[Fe(CN)6]和10 mmol/L KCLO3的混合液中,于-0.6~0.4 V 分别用CV 法、DPV 法检测电极;取出电极后,先用去离子水冲洗,然后再用V(甲醇):V(乙酸)=9:1 的洗脱液洗脱模板分子L-酪氨酸。以上所有实验均在室温下进行。
1.4 分子印迹敏感膜的性能表征
将分子印迹敏感膜修饰电极(即印迹电极)浸入含有10 mmol/L KCLO3和10 mmol/L K3[Fe(CN)6]的支持电解质溶液中,采用循环伏安(CV)法,示差脉冲(DPV)法、电化学阻抗谱(EIS)法对其进行性能测试。循环伏安(CV)法设置电位范围为-1.2~0.8 V,扫描速度为50 mV/s;示差脉冲(DPV)法设置电位范围为-1.2~0.8 V;阻抗(EIS)法设置的频率范围为1.0×10-2~1.0×106Hz。
2 结果与讨论
2.1 分子印迹敏感膜的制备
由图2CV 曲线形状可知,模板分子L-酪氨酸存在时金电极上o-PD 电聚合过程是一个完全不可逆过程,扫描的第一圈CV 图中于-0.25 V 处有明显的氧化峰,第二圈峰电流随着扫描圈数数增多而明显降低,扫描三圈后氧化峰相比较前两圈明显减弱,扫描五圈后氧化峰基本消失,处于相对稳定状态,而L-酪氨酸在所选范围内并无电活性,说明在金电极表面发生了聚合反应,生成了致密的且包含了L-酪氨酸分子的o-PD 聚合物低导电性膜,即分子印迹敏感膜。

图2 金电极电聚合过程循环伏安图
2.2 分子印迹敏感膜表面的电化学性质
由图3 可知,a 表示电聚合后,由于电极表面形成的聚邻苯二胺膜不具有导电性,[Fe(CN)6]4-/3-不能透过聚合物膜直接与金电极发生氧化还原反应,所以峰电流很小;b 表示在电聚合之前[Fe(CN)6]4-/3-容易达到裸金电极表面发生反应;c 表示将模板分子L-酪氨酸从邻苯二胺分子印迹膜上洗脱之后,在聚合物膜内形成了与L-酪氨酸分子的大小和形状相同的印迹穴孔,这些穴孔能允许[Fe(CN)6]4-/3-与电极表面接触,达到电极表面并进行氧化还原反应,在图中能观察到有可逆的[Fe(CN)6]4-/3-还原峰。配制一定浓度L-酪氨酸溶液(pH=8.0 的磷酸缓冲溶液环境下)与印迹聚合物膜与再次发生电化学反应,L-酪氨酸分子不断被印迹孔穴识别,填补大小和形状相同的孔穴,导致[Fe(CN)6]4-/3-的传质过程再次受到阻碍,不能直接与金电极表面接触而使导电性减弱,其氧化还原电流强度显著减弱,可逆性变差。

图3 金电极聚合前后变化循环伏安图 (a)裸金电极,(b)非印迹电极,(c)印迹电极
由图4 是以K3[Fe(CN)6]为探针,KCLO3 为支持电解质,测试了分子印迹敏感膜修饰电极的交流阻抗图,其中的a 和b 代表裸金电极的阻抗,裸金电极的阻抗谱基本成线性,表明[Fe(CN)6]4-/3-容易到达裸金电极表面发生反应,在裸金电极表面不存在阻挡电子传输的物质;c 表示金电极表面已聚合印迹膜且模板分子未洗脱的电极,e 和d 表示洗脱后的分子印迹传感器敏感膜在4 mmol/L 的L-酪氨酸溶液中吸附L-酪氨酸后,其阻抗值有明显变化,说明分子印迹电极对L-酪氨酸分子有特异性识别作用。

图4 金电极聚合前后变化阻抗图 (a)裸金电极和,(b)非印迹电极,(c)印迹电极
图5 可知,适用DPV 法检测分子印迹传感膜的化学性质,曲线分别abc 是裸金电极、已聚合印迹膜且模板分子未洗脱的电极和洗脱后模板分子之后的分子印迹膜在铁氰化钾和氯酸钾混合溶液中进行DPV 法扫描图,从图可以看出,a 裸金电极在铁氰化钾溶液中的DPV 图线出现较大峰电流值,在聚合上包含模板的分子印迹膜之后,峰电流值减小几乎呈线性,当洗脱模板分子之后,出现峰值,说明电聚合后,金电极上形成了不导电的聚邻苯二胺膜,邻苯二胺膜不与铁氰化钾发生反应,电流很小,洗脱模板分子后,铁氰化钾离子可以通过电极表面形成的孔穴与电极表面发生氧化还原反应。

图5 金电极聚合前后示差脉冲图 (a)裸金电极,(b)非印迹电极,(c)印迹电极
2.3 分子印迹敏感膜的选择性检测
考察分子印迹传感器敏感膜对L-酪氨酸分子及干扰物的电化学影响,选择与L-酪氨酸结构相似的L-苯丙氨酸、L-色氨酸、L-天冬氨酸等几种氨基酸作为干扰物,对分子印迹敏感膜的选择性进行检测,使用的方法为示差脉冲法(DPV)。如图6:

图6 印迹电极L-酪氨酸及干扰物的反应
由图6 可知,分子印迹膜修饰电极对L-色氨酸、L-天冬氨酸、L-苯丙氨酸的电流响应很小,说明这些干扰物与分子印迹膜上的印迹孔穴大小和形状不匹配,不能完全封闭穴孔,铁氰化钾能通过孔穴缝隙与金电极表面接触而不受阻碍,而印迹膜对L-酪氨酸的电流响应较大。这说明印迹膜对L-酪氨酸具有特异识别性。
2.4 印迹电极对L-酪氨酸的响应性及应用
配制不同浓度的L-酪氨酸的背景溶液,采用示差脉冲法(DPV)法检测了[Fe(CN)6]4-/3-氧化峰随L-酪氨酸浓度的变化,如图6 可知,分别以L-酪氨酸的浓度对数和峰电流做标准曲线,在 1×10-2~2.0 mg/mL 的浓度范围内峰电流随L-酪氨酸浓度的增加呈线性下降,线性回归方程为:
I=-3.5×10-6logCL-Tyr+6.2×10-6
相关系数为0.9917。配制样品进行检测,测得样品峰电流值为8.7428×10-6A,根据标准曲线方程计算得到对应的样品浓度为0.1992 mg/mL。
2.5 分子印迹传感器敏感膜电极的重现性
用制备的同一支分子印迹传感器敏感膜电极,采用示差脉冲法(DPV)法对6 个浓度为0.2 mg/mL 的L-酪氨酸背景溶液进行连续平行测定,实验结果见表1。
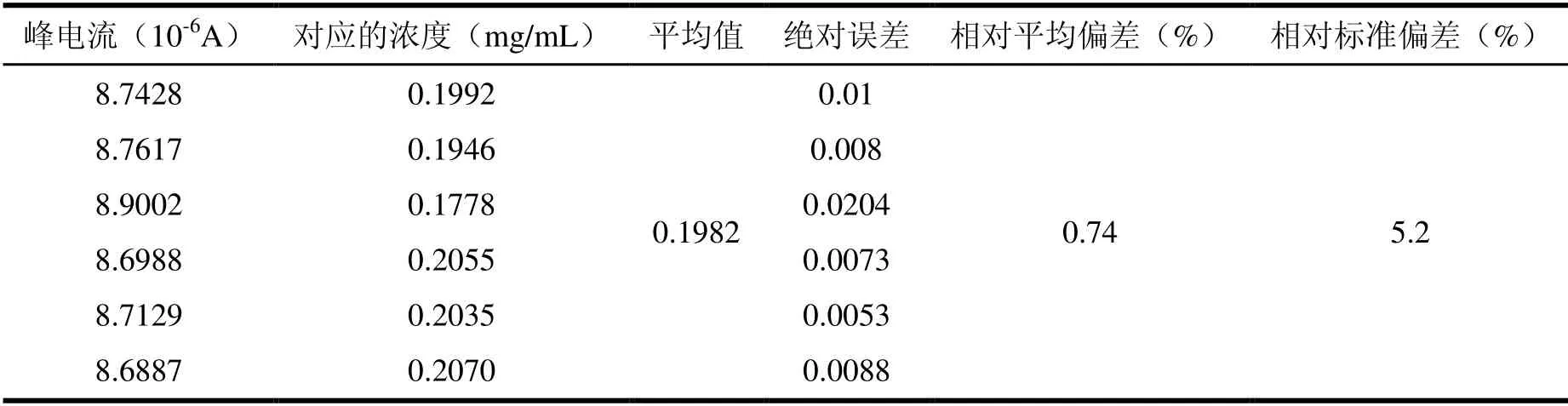
表1 印迹膜修饰电极重现性
由表1 得知,对浓度为0.2 mg/mL 的6 个L-酪氨酸对照溶液进行检测,其相对标准偏差为5.2%。
2.6 分子印迹传感器敏感膜的使用寿命
将印迹电极储存一周,电流响应值达到初始响应值的90%,一个月后电流响应值达到75%,说明该印迹电极使用寿命较长。鉴于该印迹电极在对L-酪氨酸的分析研究中已经取得了令人满意的结果,因此该印迹传感器有望应用于食品,药品中L-酪氨酸的检测。
[1] 刘学良, 刘莺, 王俊德, 等. 分子烙印技术的应用与最新进展[J]. 分析化学, 2002, 30(10): 1260-1266.
[2] 李秀华, 王自瑛, 王后方. L-酪氨的合成研究[J]. 科技信息, 2007(33): 343.
[3] 王颖, 李楠. 分子印迹技术及其应用[J]. 化工进展, 2010, 29(12): 2315-2323.
[4] 宫倩倩, 曹玉华、, 王阳, 等. 吲哚-3-乙酸分子印迹聚合物膜电化学传感器的研制[J]. 分析科学学报, 2011, 27(5): 556-560.
[5] 迟大民, 苏立强, 邓茜珊, 等. 分子印迹功能单体选择方法研究进展[J]. 化工时刊, 2009, 23(12): 55-57.
[6] 隋红艳, 李红旗, 沈忠耀. 分子印迹技术手性分离氨基酸衍生物(I)-分子印迹聚合物的制备、色谱评价及物理化学表征[J]. 精细化工, 2002, 20(6): 345-348.
[7] 高宝平, 李婧, 郭满栋. 白藜芦醇分子印迹传感器的制备及应用[J]. 分析科学学报, 2011, 27(2): 162-166.
[8] Caro E, Marcé R M, Borrull F, et al. Application of molecularly imprinted polymers to solid-phase extraction of compounds from environmental and biological samples [J]. TrAC Trends in Analytical Chemistry, 2006, 25(2): 143-154.
[9] 徐雯, 李晓, 张卫英, 等. L-色氨酸分子印迹敏感膜的制备与性能[J]. 高等学校化学学报, 2012(10): 2199-2204.
[10] Dai J, Pan J, Xu L, et al. Preparation of molecularly imprinted nanoparticles with superparamagnetic susceptibi- lity through atom transfer radical emulsion polymerization for the selective recognition of tetracycline from aqueous medium [J]. Journal of hazardous materials, 2012, 205: 179- 188.
[11] Qiao F, Du J. Rapid screening of clenbuterol hydrochloride in chicken samples by molecularly imprinted matrix solid- phase dispersion coupled with liquid chromatography [J]. Journal of Chromatography B, 2013, 923: 136-140.
[12] 赖家平, 何锡文, 郭洪生, 等. 分子印迹技术回顾、现状与展望[J]. 分析化学研究报告, 2001(7): 836-844.
[13] Hu Y, Zhang Z, Zhang H, et al. Sensitive and selective imprinted electrochemical sensor for p-nitrophenol based on ZnO nanoparticles/carbon nanotubes doped chitosan film [J]. Thin Solid Films, 2012, 520(16): 5314-5321.
[14] Li Y, Yang T, Qi X, et al. Development of a group selective molecularly imprinted polymers based solid phase extraction of malachite green from fish water and fish feed samples [J]. Analytica Chimicacta, 2008, 624(2): 317-325.
[15] Pauling L. A theory of the structure and process of formation of antibodies [J]. Journal of the American Chemical Society, 1940, 62(10): 2643-2657.
[16] Dickey F H. The preseparation of specific adsorbents [J]. P Natl Acad Sci USA, 1949, 35(5): 227-229.
[17] Dickey F H. Specific adsorption [J]. The Journal of Physical Chemistry, 1955, 59(8): 695-707.
[18] Wulff G, Sarhan A, Zabrocki K. Enzyme-analogue built polymers and their use for the resolution of racemates [J]. Tetrahedron Letters, 1973, 14(44): 4329-4332.
[19] Vlatakis G, Andersson L I, Müller R, et al. Drug assay using antibody mimics made by molecular imprinting [J]. Nature, 1993, 361(6413): 645-647.

