根皮素对糖尿病小鼠光感受器视杆细胞的保护作用△
石珂 赵璐 游志鹏 张倩 汪昌运
糖尿病视网膜病变(diabetic retinopathy,DR)是全球主要的不可逆致盲性眼病之一,据调查在美国有410万成年人患有DR[1]。目前已公认高血糖是DR重要的起始因素,体内长期高血糖环境会损伤视网膜中视杆细胞等光感受器细胞。视杆细胞负责暗视觉,其损伤将严重影响患者的视功能[2],如何抑制糖尿病患者视杆细胞等神经细胞的损害已成为目前研究的热点。根皮素是一种葡萄糖转运蛋白-1(glucose transporter-1,GLUT1)抑制剂,早在1986年已有学者发现根皮素可以抑制葡萄糖转运入肝[3],目前已证实GLUT1是葡萄糖通过血-视网膜屏障的唯一载体[4]。我们设想利用根皮素限制GLUT1转运葡萄糖进入视网膜而降低视网膜组织含糖量,可能对视杆细胞等神经元有一定的保护作用。本研究通过腹腔注射链脲佐菌素(streptozotocin,STZ)建立糖尿病小鼠模型后予以根皮素,而后检测并比较暗适应视网膜电图(electroretinogram,ERG)振幅和视网膜外核层厚度,以判断根皮素对糖尿病小鼠视网膜视杆细胞功能和形态的影响。
1 材料与方法
1.1主要试剂和仪器复方托吡卡胺滴眼液(日本参天制药株式会社),重组牛碱性成纤维细胞生长因子眼用凝胶(珠海亿胜制药公司)。STZ、根皮素和葡萄糖含量测定试剂盒(美国Sigma-Aldrich公司),蛋白质含量测定试剂盒(美国Bio-Rad公司),柠檬酸缓冲液(北京天根生化科技有限公司),电子分析天平(上海精科天平厂),视网膜电图仪(美国Diagnosys公司),光谱分析仪(德国Spectro公司),生物显微镜(日本奥林巴斯株式会社)。
1.2实验动物与分组健康8周龄无眼疾近交系雄性C57BL/6小鼠18只,体质量20~30 g,打上耳钉编号后根据随机数字表随机选取分为正常对照组、糖尿病对照组和根皮素治疗组,每组6只。建立DM模型方法:小鼠禁食8 h后腹腔注射STZ连续5 d,注射前将STZ溶于pH 4.5的0.01 mol·L-1柠檬酸缓冲液里,而后糖尿病对照组和根皮素治疗组予以50 mg·kg-1剂量注射,正常对照组予以等量柠檬酸盐缓冲液腹腔注射。第7天采尾部静脉血测量血糖,大于16.7 mmol·L-1即认为建模成功。成模后根皮素治疗组予以根皮素100 mg·kg-1灌胃,连续12周,隔日进行1次灌胃;正常对照组和糖尿病对照组予以等量生理盐水灌胃。18周后行暗适应ERG检查。
1.3暗适应ERG检查3组小鼠使用复方托吡卡胺滴眼液散瞳后放于暗室过夜,第2天予以氯胺酮(10 mg·kg-1)和赛拉嗪(60 mg·kg-1)混合液麻醉。然后将小鼠置于加热温板上,参比电极和接地电极插入腭部和尾巴,铂制角膜电极置于双眼角膜上并予以重组牛碱性成纤维细胞生长因子眼用凝胶润滑,以上操作均在暗室弱红光灯照明下完成。ERG仪设置光照强度0.0004 cd·s-1·m-2、 0.04 cd·s-1·m-2、 4 cd·s-1·m-2、 400 cd·s-1·m-2和 2000 cd·s-1·m-2分别记录暗视ERG结果。
1.4视网膜组织含糖量检测3组小鼠完成ERG检查后颈椎脱臼法处死,摘除左眼球(右眼球另有他用)后取视网膜组织并加入50 μL去离子水,加热至70~75 ℃共15 min,然后超声裂解30 s,离心20 min后取上清液35 μL加入165 μL葡萄糖含量测定试剂里,并设立标准曲线和空白对照,应用光谱分析仪测定标本的吸光度,然后应用SPECTRO STAR NANO MARS软件计算葡萄糖浓度。而后再取10 μL上清液加入190 μL蛋白质含量测定试剂中,同样设立标准曲线和空白对照,应用光谱分析仪测定标本的吸光度,然后应用SPECTRO STAR NANO MARS软件计算蛋白质浓度。视网膜葡萄糖含量以nmol glucose/mg protein表示,其计算公式为:视网膜组织含糖量=G·GV/(GMW·P·PV),其中G:葡萄糖浓度(ng·mL-1)、GV:葡萄糖含量测定反应液容积(mL)、P:蛋白质浓度(mg·mL-1)、PV:蛋白质含量测定反应液容积(mL)、GMW:葡萄糖相对分子质量(180.2)。
1.5视网膜外核层厚度测量在1.4步骤中摘除小鼠的右眼球后直接放入40 g·L-1多聚甲醛中固定1 h,而后剪除角膜和晶状体后再次放入40 g·L-1多聚甲醛中固定15 min,PBS清洗后酒精梯度脱水,而后放入二甲苯Ⅰ及二甲苯Ⅱ中透明,浸蜡后包埋,切片(厚5 μm)后烤干。将制备完成的石蜡切片置入二甲苯Ⅰ及二甲苯Ⅱ中脱蜡,无水酒精漂洗,而后置入梯度酒精,放入苏木精中染色10~30 min,水洗后放入体积分数1%盐酸乙醇中褪色,再漂洗,放入梯度酒精脱水,再放入体积分数0.5%伊红乙醇液复染,再脱水,置入二甲苯Ⅰ及二甲苯Ⅱ中透明,封片。于显微镜下观察切片并应用ImagePro软件分别测量距离视盘上下方0.48 mm、0.96 mm、1.44 mm、1.92 mm处的视网膜外核层厚度。

2 结果
2.13组小鼠视网膜组织的含糖量比较18周后正常对照组小鼠视网膜含糖量为(39.43±2.17)nmol glucose/mg protein,糖尿病对照组小鼠视网膜含糖量高达(142.25±6.92)nmol glucose/mg protein,根皮素治疗组小鼠的视网膜含糖量为(97.82±4.12)nmol glucose/mg protein,两组糖尿病模型小鼠的视网膜含糖量均高于正常对照组,差异均有显著统计学意义(均为P<0.01),但根皮素治疗组小鼠视网膜含糖量低于糖尿病对照组,差异也有显著统计学意义(P<0.01)。
2.23组小鼠的暗适应ERG比较糖尿病对照组和根皮素治疗组的小鼠暗适应ERG的a波及b波振幅均较正常对照组低,且差异均有显著统计学意义(均为P<0.01),但根皮素治疗组小鼠的暗适应ERG a波及b波振幅较糖尿病对照组高,差异也均有显著统计学意义(均为P<0.01,见图1、表1)。
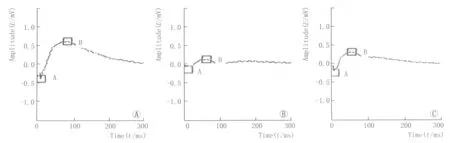
Figure 1 Scotopic ERG of three groups.A:Normal control group;B:Diabetic control group;C:Phloretin treatment group 三组小鼠的暗适应ERG表现。A:正常对照组;B:糖尿病对照组;C:根皮素治疗组

表1 3组小鼠的暗适应ERG振幅
2.33组小鼠视网膜外核层厚度比较成模18周后根皮素治疗组和糖尿病对照组小鼠视网膜外核层厚度较正常对照组下降(6.28~16.05)%和(20.41~35.38)%,然而根皮素治疗组的视网膜外核层厚度较糖尿病对照组小鼠厚(6.61~29.92)%,差异有统计学意义(P<0.05,见图2)。
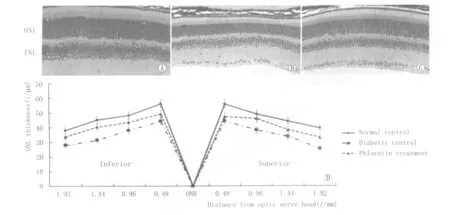
Figure 2 Outer nuclear layer thickness of three groups(HE,×400).A:Normal control group;B:Diabetic control group;C:Phloretin treatment group 3组小鼠的视网膜外核层厚度(HE染色,×400)。A:正常对照组;B:糖尿病对照组;C:根皮素治疗组
3 讨论
DR是糖尿病最常见和严重的并发症之一,其发病机制目前尚不明确,但美国糖尿病多中心试验研究DCCT揭示长时期高血糖是发生DR的决定性因素。现有研究发现视网膜高糖环境下产生的过量氧化应激、蛋白激酶C的激活、糖基化终末产物的合成等启动了视网膜组织细胞包括光感受器等神经细胞的损伤[5-6]。视杆细胞是光感受器的重要组成部分,它对光的敏感度较高,负责人们在弱光下的视觉即暗视觉,视杆细胞损伤将导致夜盲症等而直接影响患者生活质量[7],因此探索在糖尿病条件下对视杆细胞的保护以尽可能保全患者视功能意义重大。
既然糖尿病条件下视杆细胞所处的高糖微环境对其有损伤效应,那么控制视网膜组织含糖量可能是解决此问题的一把钥匙。视网膜中葡萄糖由血液转运而来,但葡萄糖由于其水溶性而无法通过哺乳动物细胞膜的磷脂双分子层,视网膜组织细胞摄取葡萄糖需依靠一类转运葡萄糖的载体蛋白即GLUT1[8],在视网膜中GLUT-1除分布于神经节细胞、光感受器细胞、Müller细胞、晶状体细胞等外,大部分存在于血-视网膜内屏障的血管内皮细胞和外屏障的视网膜色素上皮细胞,GLUT1是葡萄糖通过血-视网膜屏障的唯一载体[9]。而根皮素可以竞争性抑制GLUT1对葡萄糖的运输从而减少视网膜含糖量。本研究结果显示:建立糖尿病模型后18周,根皮素治疗组小鼠视网膜含糖量低于糖尿病对照组(P<0.01),证明根皮素可以有效限制葡萄糖转运进入视网膜。
暗适应ERG是闪光ERG检测内容的一部分,它是在暗适应条件下给予弱光刺激时视杆细胞产生的电位,可在角膜表面无创记录[10]。常用暗适应ERG反映视杆细胞的功能状态,研究已发现糖尿病大鼠在早期即出现暗适应ERG异常[11]。同样国内也有报道应用闪光ERG检查发现非增殖期DR患者在未出现眼底新生血管等微血管病变时已出现视网膜光感受器功能障碍,其中视杆细胞功能尤为明显[12]。本实验发现糖尿病对照组和根皮素治疗组小鼠暗适应ERG的a波及b波波幅均比正常对照组小鼠低,与前述研究一致,但根皮素治疗组比糖尿病对照组暗适应ERG的a波及b波高。提示我们应用根皮素后糖尿病小鼠视杆细胞的功能损害相对较轻,其原因可能是视网膜的相对低糖环境对视杆细胞产生了一定的保护作用。
视网膜外核层厚度主要反映视杆细胞的数量变化,动物实验证实糖尿病大鼠建模后其外核层厚度随着病程的延长而逐渐降低[13],视杆细胞的退行性变及死亡是糖尿病患者在未出现DR之前视功能异常的主要原因,也是DR的重要病理改变[14]。本实验同样发现18周后两组糖尿病模型小鼠的视网膜外核层厚度均小于正常对照组,提示我们本研究中糖尿病模型小鼠的视网膜视杆细胞在不断死亡,但根皮素治疗组各测量点的视网膜外核层厚度均较糖尿病对照组小鼠高,提示我们糖尿病小鼠在应用根皮素后视杆细胞死亡数量相对较少,其原因同样是低糖环境对视杆细胞的保护作用。
综上所述,应用GLUT1抑制剂根皮素后,糖尿病小鼠的视网膜含糖量下降,从而形成了一个视网膜相对低糖环境。在此环境下,视杆细胞的功能和形态学病变均较普通糖尿病小鼠有所缓解。这提示我们通过竞争性抑制GLUT1从而限制视网膜局部含糖量有可能成为未来防治DR的一个新方向。
1 Zhang X,Saaddine JB,Chou CF,Cotch MF,Cheng YJ,Geiss LS,etal.Prevalence of diabetic retinopathy in the United States,2005-2008[J].JAMA,2010,304(6):649-656.
2 李筱荣,主编.糖尿病眼病[M].北京:人民卫生出版社,2010:181-212.
3 Ibu JO,Short AH.The inhibitory effect of phlorhizin and phloretin on hexose transport in the liver[J].ScandJGastroenterolSuppl,1986,21(s124):75-81.
4 Fernandes R,Hosoya K,Pereira P.Reactive oxygen species dow-nregulate glucose transport system in retinal endothelial cells[J].AmJPhysiolCellPhysiol,2011,300(4):C927-936.
5 Geraldes P,Hiraoka-Yamamoto J,Matsumoto M,Clermont A,Leitges M,Marette A,etal.Activation of PKC-delta and SHP-1 by hyperglycemia causes vascular cell apoptosis and diabetic retinopathy[J].NatMed,2009,15(11):1298-1306.
6 兰文,陆燕,王春红,胡钦瑞,黄振平.糖尿病视网膜病变炎症的研究新进展[J].眼科新进展,2013,33(2):197-200.
7 Punzo C,Xiong W,Cepko CL.Loss of daylight vision in retinal degeneration:are oxidative stress and metabolic dysregulation to blame[J]?JBiolChem,2012,287(3):1642-1648.
8 Gospe SM 3rd,Baker SA,Arshavsky VY.Facilitative glucose transporter Glut1 is actively excluded from rod outer segments[J].JCellSci,2010,123(21):3639-3644.
9 Thorens B,Mueckler M.Glucose transporters in the 21st Century[J].AmJPhysiolEndocrinolMetab,2010,298(2):141-145.
10 黎晓新,赵家良.视网膜[M].天津:天津科技翻译出版公司,2011:180-203.
11 李琴,谢婷玉,陈雪艺,王清,郭乔茜,具尔提·哈第尔.臭氧灌肠改善糖尿病大鼠的视网膜电图表现[J].眼科新进展,2014,34(1):34-36.
12 方晏红.非增生性糖尿病视网膜病变的视网膜电图特征研究[D].重庆:重庆医科大学,2012.
13 Lai AK,Lo AC.Animal models of diabetic retinopathy:summary and comparison[J].JDiabetesRes,2013,2013:106594.
14 Verma A,Rani PK,Raman R.Is neuronal dysfunction an early sign of diabetic retinopathy? Microperimetry and spectral domain optical coherence tomography(SD-OCT) study in individuals with diabetes,but no diabetic retinopathy[J].Eye(Lond),2009,23(9):1824-1830.

