Apelin-13对压力超负荷大鼠心肌纤维化及TGF-β1/Smads信号通路的影响
王向兵,张 志,林朵朵,黄秀艳辽宁医学院附属第三医院 心内科,辽宁锦州 00;中国医科大学附属盛京医院 产科,辽宁沈阳0004
Apelin-13对压力超负荷大鼠心肌纤维化及TGF-β1/Smads信号通路的影响
王向兵1,张 志1,林朵朵1,黄秀艳21辽宁医学院附属第三医院 心内科,辽宁锦州 121001;2中国医科大学附属盛京医院 产科,辽宁沈阳110004
目的 观察血管紧张素Ⅱ1型受体相关蛋白内源性配体-13(Apelin-13)对压力超负荷大鼠心肌纤维化的影响,探讨其可能的影响机制。方法 40只成年雄性SD大鼠随机分为假手术组(Sham组)、模型组(AOB组)、Apelin-13组、阻断剂组(SB431542组)。假手术组游离但不结扎腹主动脉,其余3组于左肾动脉上方0.5 cm处行腹主动脉缩窄术建立压力超负荷模型,3 d后各组给予相应药物干预。4周后取材,计算大鼠心脏指数(H/B)和左心室质量指数(left ventricular mass index,LVMI);Masson染色光镜下观察心肌组织形态学改变,测算心肌胶原容积分数(collagen volume fraction,CVF);ELISA法测定血清转化生长因子-β1(transforming growth factor-β1,TGF-β1)浓度;Western-blotting检测TGF-β1及Ⅰ型、Ⅲ型胶原纤维的蛋白表达量;RT-PCR检测心肌组织Smad3 mRNA、Smad7 mRNA的表达水平。结果 与Sham组相比,AOB组大鼠H/B、LVMI、CVF、血清TGF-β1均明显升高(P<0.05),心肌组织TGF-β1、Ⅰ型胶原纤维、Ⅲ型胶原纤维及Smad3 mRNA表达水平亦显著升高(P<0.05);与AOB组相比,Apelin-13和SB431542干预组上述指标均明显下调(P<0.05)。Smad7 mRNA在各组间的表达呈相反趋势。结论 Apelin-13可通过部分抑制TGF-β1/Smads通路以减轻压力超负荷大鼠心肌纤维化。
Apelin-13;压力超负荷;心肌纤维化;转化生长因子-β1
高血压性心脏病(hypertensive heart disease,HHD)是高血压主要并发症之一。左心室肥厚和心肌纤维化(myocardial fibrosis,MF)是HHD的特征性病理学表现。研究表明,HHD患者心肌纤维化的发生和发展与肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system,RAAS)的异常激活及某些致纤维化因子的过度表达密切相关。现已证实,血清转化生长因子-β1(transforming growth factor-β1,TGF-β1)与脏器纤维化关系紧密,由TGF-β1及其下游Smads蛋白家族构成的TGF-β1/Smads信号通路是介导心肌纤维化的主要途径,现已成为治疗心肌纤维化的新靶点[1]。SB431542是TGF-β1Ⅰ型受体的特异性阻断剂,其通过阻断TGF-β1与Ⅰ型受体结合而抑制心肌纤维化的作用已明确[2]。Apelin是血管紧张素Ⅱ1型受体相关蛋白(putative receptor protein related to the angiotensinⅡtype 1 receptor,APJ)的内源性配体,是一种分布于机体多器官的脂肪细胞因子,包含多种亚型,Apelin-13是其中最具内分泌效应的肽段之一[3-4]。Apelin-13具有多重生物学活性,可通过减弱垂体后叶加压素的活性而起到利尿、改善心脏功能的作用[5]。同时可减轻心脏前后负荷、降低心肌耗氧量、增加心肌收缩储备而不引起心肌肥厚[6-7]。另有研究证实,Apelin-13可以降低氧自由基活性,减少心肌细胞活性氧的形成;近期研究示:Apelin-13经过激活PI3K/Akt/mTOR信号通路来起到减轻心肌细胞自噬的生物学效应[8-10]。我们前期研究发现,Apelin-13可减轻压力超负荷大鼠心肌纤维化的发生,但具体机制尚未明确[11]。本文通过观察Apelin-13对压力超负荷大鼠TGF-β1/Smads信号通路的影响,探讨其抑制心肌纤维化发生的可能机制。
材料和方法
1 主要试剂 Apelin-13(北京康肽生物科技有限公司);SB431542(上海艾黎化学科技有限公司);兔抗人TGF-β1抗体、兔抗人CollagenⅠ抗体、兔抗人CollagenⅢ抗体(北京博奥森生物技术有限公司);RT-PCR引物(宝生物工程大连有限公司合成);TGF-β1ELISA试剂盒(美国RB公司);Masson染色试剂盒(上海博谷生物科技有限公司)。
2 模型制备和实验分组 220 ~ 270 g雄性SD大鼠40只(辽宁医学院动物饲养中心供应),禁食水12 h,称体质量,10%水合氯醛(0.3 ml/100 g)腹腔注射麻醉,固定,剃毛,消毒。其中30只大鼠仿照Anversa等[12]方法,于左肋弓下脊柱旁1 cm处逐层打开腹腔,在左肾动脉上方分离出腹主动脉0.5 ~1 cm,于左肾动脉上方0.5 cm处用内径为0.70 mm U型银夹钳夹,使腹主动脉缩窄60% ~ 70%。检查腹腔无出血,腹腔给予庆大霉素1 mg/kg后将脏器复位后逐层关闭腹腔。术后6 h正常进食水,肌注庆大霉素1.5 mg/kg 3次/d,共3 d。造模过程中6只大鼠死亡,24只大鼠造模成功且术后存活良好,将其随机均分为主动脉缩窄(AOB)组8只、Apelin-13组8只、抑制剂(SB431542)组8只。其余10只大鼠术中不结扎腹主动脉,余处理同上,术后均存活良好,为假手术组。
3 药物干预 Apelin-13组给予腹腔注射Apelin-13 100 μg/(kg·d),抑制剂(SB431542)组腹腔注射SB431542 100 μg/(kg·d),连续给药4周。假手术组及AOB组均给予等量0.9%氯化钠注射液1次/d,腹腔注射。
4 心脏功能测定 20%乌拉坦(0.5 ml/100 g)腹腔注射麻醉,心电监护,气管插管,呼吸机辅助呼吸,迅速打开胸腔,心功能测定管插至左心室尖,生理记录仪监测左心室收缩压(left ventricular systolic pressure,LVSP)、左心室舒张末期压(left ventricular end diastolic pressure,LVEDP),等容收缩期左心室内压最大上升速率(+dp/dtmax,mmHg/s),等容舒张期左心室内压最大下降速率(-dp/dtmax,mmHg/s)。
5 心脏指数(H/B)与左心室质量指数(left ventricular mass index,LVMI)测定 心功能测定完毕后,迅速取出心脏,0.9%氯化钠注射液冲洗干净,滤纸吸干,称量心脏重量,修剪出室间隔、左心室游离壁作为左心室质量。全心重量与体质量的比值为心脏指数(H/B,mg/g),左心室质量与体质量的比作为左心室质量指数(LVMI,mg/g)。取部分心肌组织迅速冷冻于-80℃冰箱内以备Western blotting用,另取部分心尖组织4%甲醛溶液固定,用于Masson染色。
6 Masson染色 取左心室最大冠状切面心肌组织,常规石蜡切片脱蜡后,按Masson染色试剂盒说明染,脱水、包埋,镜下观察胶原分布形态,心肌胶原纤维、黏液被染成蓝色;胞质、肌纤维被染成红色;胞核则呈蓝褐色。通过图像分析系统,调节灰度以区别胶原和非胶原成分,测定心肌胶原容积分数(collagen volume fraction,CVF),CVF=胶原面积/总面积×100%,以CVF作为心肌纤维化指标,每张切片均随机选择5个视野测量,计算其均值。
7 血清TGF-β1水平测定 心功能测定完毕后从右心室取血5 ml,2 000 r/min,离心20 min,取上清液按照试剂盒说明书操作。
8 Western blotting检测蛋白表达 取适量心肌组织用干净眼科剪剪成碎块用PBS洗涤2次,加入细胞裂解液,低温机器匀浆混匀,移入离心管中10 000 r/min,低温离心10 min,取上清用BCA法行蛋白定量后制成蛋白样品。上样,进行SDS-聚丙烯酰胺凝胶电泳,取出电泳后的胶浸入转膜液平衡5 min,行半干法蛋白转膜,5% BSA-PBST室温封闭1 h。TGF-β1、Ⅰ、Ⅲ型胶原和β-actin一抗4℃孵育过夜,二抗室温孵育1 h。经洗涤、显影、灰度扫描后,用Scion Corporation分析软件对电泳条带进行测定,分别以目的条带灰度与内参条带β-actin灰度的比值表示TGF-β1、Ⅰ型和Ⅲ型胶原纤维的蛋白表达水平。
9 实时荧光定量PCR检测Smad3和Smad7 mRNA表达 按Trizol法进行左心室心肌总RNA提取,42℃反转录50 min,95℃ 5 min灭活反转录酶,合成cDNA。实时荧光定量PCR采用大连宝生物SYBR Green Realtime PCR试剂盒,反应条件:95℃ 60 s,1循环;95℃ 15 s、60℃ 15 s、72℃ 45 s、40个循环,于每个循环的第三步即72℃ 45s收集荧光信号。引物序列如下表所示:Smad3上游引物AGGGAAGGGGAAGAGCAACA,下游引物AAG TGAAGTGCTCGCACAGA;Smad7上游引物AACT GCAGACTGTCCAGAC,下游引物TTGGGAATCTGA AAGCCCCC;β-actin上游引物TCCTTCCTGGGTA TGGAATCCT,下游引物GCTCAGTAACAGTCCGC CTA。反应结束后,取PCR产物琼脂糖凝胶电泳,经溴化乙锭染色后在分析仪下根据相对分子质量的大小进行结果判断,用图像分析系统分析条带灰度,计算Smad3和Smad7与β-actin扩增产物的比值并以此比值表示mRNA的表达水平。
10 统计学分析 数据均采用SPSS19.0统计软件进行分析,计量资料以±s表示,多组间比较采用单因素方差分析,两组间比较采用q检验,P<0.05为差异有统计学意义。
结 果
1 各组H/B、LVMI比较 与Sham组相比,模型组大鼠H/B、LVMI显著升高(P<0.05);与模型组相比,Apelin-13组、SB431542组上述比值均显著降低(P<0.05)。见表1。
2 血流动力学指标比较 与Sham组比较,模型组+dp/dtmax、-dp/dtmax、LVSP均显著下降(P<0.05),LVEDP则显著升高(P<0.05);与模型组比较,Apelin-13及SB431542组+dp/dtmax、-dp/dtmax、LVSP均显著升高(P<0.05),LVEDP则显著降低(P<0.05)。见表2。
3 Masson染色胶原含量比较 Masson三色染色光镜下观察细胞核呈蓝褐色,心肌纤维呈红色,胶原纤维呈蓝色[13]。结果示:假手术组大鼠心肌只有血管周围存在少量的胶原纤维,排列呈条索状,分布均匀。与假手术组比较,其余3组心肌组织中胶原含量均明显增加,呈破碎状,分布不规则。与模型组比较,Apelin-13组、SB431542组胶原含量均明显减少。通过图像分析系统计算胶原含量发现,与假手术组比较,模型组CVF显著升高(P<0.05);与模型组比较,Apelin-13组、SB431542组CVF显著降低(P<0.05)。见图1、表3。
4 各组大鼠血清TGF-β1水平比较 与Sham组比较,AOB组血清TGF-β1水平明显升高(P<0.05);与AOB组比较,Apelin-13组和SB431542组TGF-β1水平均明显下降(P<0.05)。见表3。
表1 各组H/B、LVMI比较Tab. 1 Cardiac index and LVMI in different groups (±s)
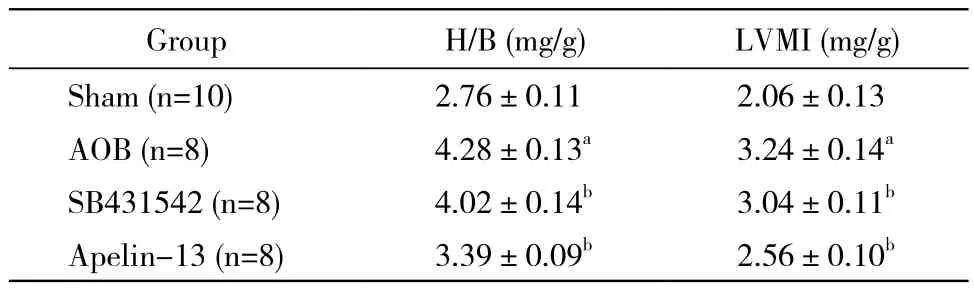
表1 各组H/B、LVMI比较Tab. 1 Cardiac index and LVMI in different groups (±s)
aP<0.05, vs sham group;bP<0.05, vs AOB group
GroupH/B (mg/g)LVMI (mg/g) Sham (n=10)2.76±0.112.06±0.13 AOB (n=8)4.28±0.13a3.24±0.14aSB431542 (n=8)4.02±0.14b3.04±0.11bApelin-13 (n=8)3.39±0.09b2.56±0.10b
表2 各组大鼠血流动力学指标比较Tab. 2 Hemodynamic index of rats in different groups (±s)

表2 各组大鼠血流动力学指标比较Tab. 2 Hemodynamic index of rats in different groups (±s)
aP<0.05, vs sham group;bP<0.05, vs AOB group
Group+dp/dtmax-dp/dtmaxLVSPLVEDP Sham (n=10)3 278±1083 079±47115±64.7±0.3 AOB (n=8)2 659±97a2 588±34a92±8a8.8±0.4aSB431542 (n=8)2 899±111b2 824±52b103±4b6.7±0.5bApelin-13 (n=8)3 101±84b2 891±29b115±3b5.1±0.5b
表3 各组大鼠CVF、血清TGF-β1水平的比较Tab. 3 CVF and TGF-β1protein expression levels in different groups (±s)

表3 各组大鼠CVF、血清TGF-β1水平的比较Tab. 3 CVF and TGF-β1protein expression levels in different groups (±s)
aP<0.05, vs sham group;bP<0.05, vs AOB group
GroupCVF (%)TGF-β1(pg/ml) Sham (n=10) 7.06±0.8339.22±0.96 AOB (n=8) 19.67±0.62a93.61±19.71aSB431542 (n=8)14.24±0.73b64.04±18.03bApelin-13 (n=8) 10.08±0.10b49.46±12.44b

图 1 心肌组织Masson染色(×200)Fig. 1 Masson staining of myocardial tissue from sham group (A), AOB group (B), SB431542 group (C), apelin-13 group (D)
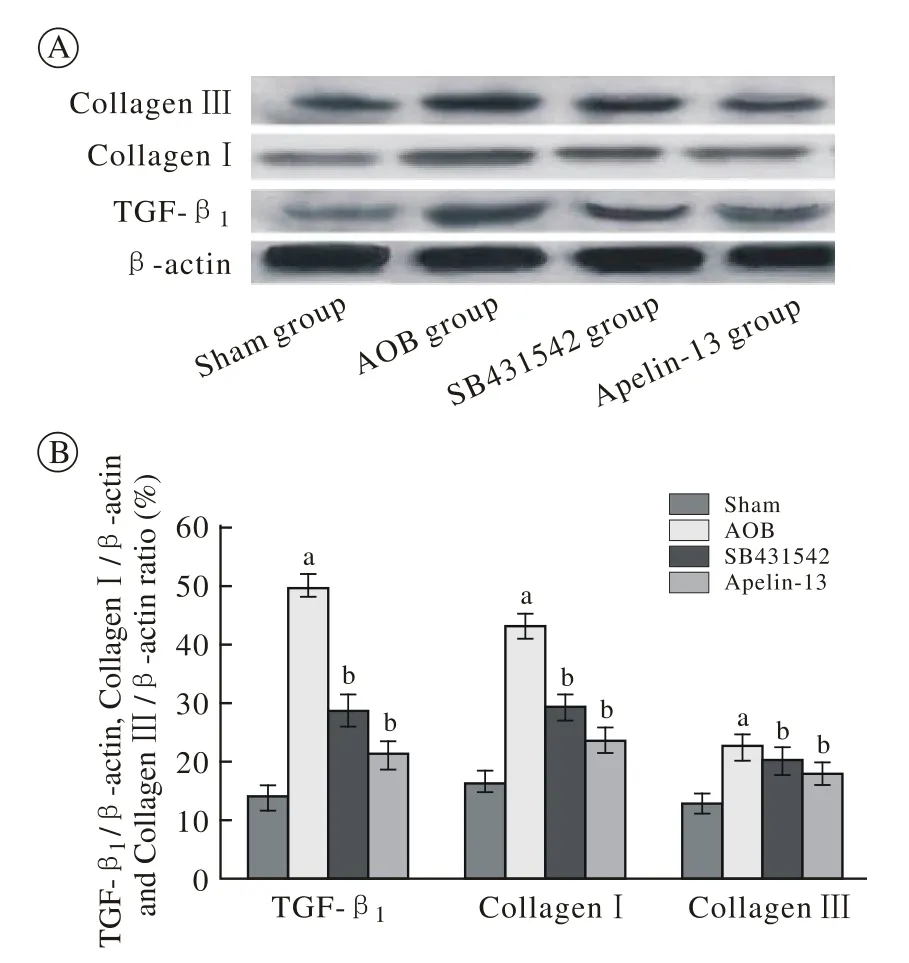
图 2 免疫印迹示TGF-β1、Ⅰ型、Ⅲ型胶原表达水平及量化表Fig. 2 Western-blotting showing expression level of protein TGF-β1, collagen Ⅰ and collagenⅢ(aP<0.05, vs sham group;bP<0.05, vs AOB group)
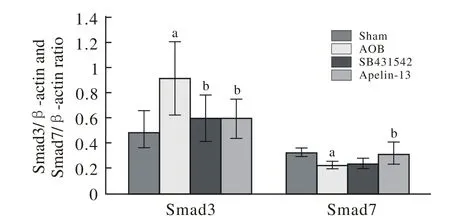
图 3 各组间Smad3、Smad7 mRNA表达量比较Fig. 3 Smad3 mRNA, Smad7 mRNA expression levels in different groups (aP<0.05, vs sham group;bP<0.05, vs AOB group)
5 TGF-β1、Ⅰ型和Ⅲ型胶原蛋白表达水平 与Sham组相比,模型组大鼠心肌组织TGF-β1、Ⅰ型和Ⅲ型胶原蛋白含量明显上升(P<0.05)。接受Apelin-13或SB431542治疗后上述指标较模型组则显著下调(P<0.05)。见图2。
6 各组间大鼠心肌Smads3 mRNA、Smads7 mRNA比较 AOB组的Smad3 mRNA表达量比Sham组明显上升,而Smad7 mRNA的表达量显著下降(P<0.05)。与模型组比较,Apelin-13组Smad3 mRNA表达量下调而Smad7 mRNA表达量明显回升(P<0.05);SB431542组Smad3 mRNA较模型组明显下调(P<0.05),Smad7 mRNA有所回升,但差异无统计学意义,Smad3 mRNA在Apelin-13、SB431542两组间差异无统计学意义。见图3。
讨 论
高血压性心脏病是长期心脏后负荷增加导致的心脏结构和功能改变的一种疾病,临床表现复杂多样[14]。心肌纤维化在HHD的发生和发展过程中起着至关重要的作用,表现为心肌细胞肥大、间质和冠状动脉外膜胶原纤维的异常堆积、Ⅰ型和Ⅲ型胶原排列紊乱及比例失调,成为心脏舒缩功能障碍、恶性心律失常等不良心血管事件的病理学基础[15]。本实验结果示:与假手术组相比,压力超负荷大鼠的H/B、LVMI明显升高;心脏收缩和舒张功能下降;Masson染色光镜下可见心肌纤维增粗、断裂,心肌胶原成分明显增多且排列紊乱,CVF值升高;Ⅰ型胶原纤维表达量亦明显上调。上述结果证实了本实验构建的压力超负荷大鼠存在明显的心肌纤维化,与前人研究成果相符。
研究表明,血压升高使血流动力学不稳定,致使心脏后负荷增加,可明显刺激心肌成纤维细胞对TGF-β1的合成与分泌,也可见纤维连接素、胶原纤维蛋白的表达升高,心肌组织特异性表达的TGF-β1能导致心肌肥厚和心肌纤维化[16-17]。我们的实验结果提示:压力超负荷大鼠血清和心肌组织中TGF-β1表达量均明显升高,与上述研究结果相符,验证了压力超负荷状态下TGF-β1的病理性高表达。现已证实,由TGF-β1、TGF-β1受体(TβR)及其下游的Smads蛋白家族构成的TGF-β1/Smads信号转导通路是HHD患者心肌纤维化的最强促发因素。TGF-β是调节多器官细胞生长分化的一类多肽,其生物学效应丰富多样,其中TGF-β1是在哺乳动物中含量最高且生物学活性最强的一种亚型。Smads蛋白是TGF-β1下游的信号分子,是TGF-β1唯一底物。活化的TGF-β1首先与TβR结合形成受体配体复合物,该复合物进一步磷酸化Smad2、Smad3分别形成p-Smad2、p-Smad3,后两者再与Smad4形成异源寡聚复合物,后者转移至胞核内,通过编码相关调控基因来介导TGF-β1致心肌纤维化效应。Smad7则是TGF-β1/Smads信号通路中的负性调节蛋白,Smad7由细胞核转位至胞质后可抑制蛋白激酶型受体TβR对Smad2/Smad3的磷酸化,阻断信号向核内转导,进而负性调节TGF-β1/Smads信号通路的致纤维化效应[18]。
我们的前期研究发现:Apelin-13可改善压力超负荷所致的心肌纤维化,并与剂量相关,但其抗MF的具体机制尚不清楚[11]。本实验在前期研究的基础上,同样采用腹主动脉缩窄术构建压力超负荷大鼠心肌纤维化模型,选用100 μg/(kg·d)浓度的Apelin-13进行预处理,以SB431542抑制TGF-β1/Smads信号通路的激活为参照,检测通路蛋白基因的表达情况。结果显示:模型组大鼠血清和心肌组织中TGF-β1表达量与假手术组相比明显增加,实时定量PCR检测示模型组大鼠心肌组织中Smad3 mRNA表达水平亦明显升高、Smad7 mRNA则下降;Apelin-13、SB431542处理组TGF-β1、Smad3 mRNA较模型组可见明显下调,Apelin-13处理组Smad7 mRNA与模型组相比明显回升,而SB431542处理组组无明显改变。本研究提示我们:Apelin-13可能通过降低血清TGF-β1的浓度,抑制Smad3的激活,同时上调TGF-β1/ Smads信号通路中纤维化负反馈调节信使Smad7的表达来抑制心肌纤维化的发生。
综上所述,压力超负荷致MF可能与心肌细胞内TGF-β1/Smads信号通路蛋白TGF-β1、Smad3、Smad7的表达紊乱密切相关,Apelin-13抗心肌肥厚及纤维化的作用可能是通过减弱此通路的异常激活实现的。
1 Schuppan D, Koda M, Bauer M, et al. Fibrosis of liver, pancreas and intestine: common mechanisms and clear targets?[J]. Acta Gastroenterol Belg, 2001, 63(4): 366-370.
2 刘芳,刘浩,宋丽秀,等.SB431542对HSC T6细胞Smad4蛋白细胞内转位及表达的影响[J].世界华人消化杂志,2012,20(18):1653-1656.
3 Chong KS, Gardner RS, Morton JJ, et al. Plasma concentrations of the novel peptide apelin are decreased in patients with chronic heart failure[J]. Eur J Heart Fail, 2006, 8(4): 355-360.
4 Atluri P, Morine KJ, Liao GP, et al. Ischemic heart failure enhances endogenous myocardial apelin and APJ receptor expression[J]. Cell Mol Biol Lett, 2007, 12(1): 127-138.
5 Japp AG, Cruden NL, Barnes G, et al. Acute cardiovascular effects of apelin in humans: potential role in patients with chronic heart failure[J]. Circulation, 2010, 121(16): 1818-1827.
6 焦慧,张志,马清华,等.Apelin-13对葡萄糖剥夺乳鼠心肌细胞自噬的影响及机制[J].解放军医学院学报,2013,34(2):167-171.
7 Barnes G, Japp AG, Newby DE. Translational promise of the apelin--APJ system[J]. Heart, 2010, 96(13): 1011-1016.
8 Zeng XJ, Zhang LK, Wang HX, et al. Apelin protects heart against ischemia/reperfusion injury in rat[J]. Peptides, 2009, 30(6):1144-1152.
9 任晓倩,张志.Apelin-13对葡萄糖剥夺诱导的乳鼠心肌细胞自体吞噬的影响[J].广东医学,2011,32(24):3176-3178.
10 Jiao H, Zhang Z, Ma Q, et al. Mechanism underlying the inhibitory effect of Apelin-13 on glucose deprivation-induced autophagy in rat cardiomyocytes[J]. Exp Ther Med, 2013, 5(3):797-802.
11 杨攀,张志.Apelin-13对肾上腹主动脉缩窄诱导的心力衰竭大鼠心肌纤维化的影响[J].山东医药,2013,53(11):19-21.
12 Anversa P, Olivetti G, Melissari M, et al. Morphometric study of myocardial hypertrophy induced by abdominal aortic stenosis[J]. Lab Invest, 1979, 40(3): 341-349.
13 沈蔷,陈莉,李昊,等.苦味酸-天狼猩红染色和MASSON染色评价心脏纤维化的比较[J].中国分子心脏病学杂志,2012,12(2):118-120.
14 Santos M, Shah AM. Alterations in cardiac structure and function in hypertension[J]. Curr Hypertens Rep, 2014, 16(5):428.
15 Díez J, López B, González A, et al. Clinical aspects of hypertensive myocardial fibrosis[J]. Curr Opin Cardiol, 2001, 16(6): 328-335.
16 Manabe I, Shindo T, Nagai R. Gene expression in fibroblasts and fibrosis: involvement in cardiac hypertrophy[J]. Circ Res, 2002,91(12): 1103-1113.
17 Rosenkranz S, Flesch M, Amann K, et al. Alterations of betaadrenergic signaling and cardiac hypertrophy in transgenic mice overexpressing TGF-beta(1)[J]. Am J Physiol Heart Circ Physiol, 2002, 283(3):H1253-H1262.
18 辛宇鹏,袁光亚,卢一平.β转化生长因子/smad信号通路与慢性移植肾肾病[J].中华移植杂志:电子版,2009,3(1):49-54.
Effect of apelin-13 on myocardial fibrosis in rats induced by pressure overload and TGF-β1/ Smads pathway
WANG Xiang-bing1, ZHANG Zhi1, LIN Duo-duo1, HUANG Xiu-yan21Department of Cardiology, Third Affiliated Hospital of Liaoning Medical University, Jinzhou 121001, Liaoning Province, China;
2Department of Obstetrical, ShengJing Hospital of China Medical University, Shenyang 110004, Liaoning Province, China
ZHANG Zhi. Email: ningcheng631@163.com
Objective To study the effect of apelin-13 on myocardial fibrosis in rats induced by pressure overload and clarify its mechanism. Methods Forty SD rats were randomly divided into sham-operation group, model group, apelin-13 group and SB431542 group, 10 in each group. Rats in the sham-operation group were only separated their abdomens aorta. The other three groups were made into the model of myocardial fibrosis successfully. Three days after modeling, rats in different groups were given corresponding medication interventions. 4 weeks later, their cardiac index and left ventricular mass index (LVMI) were estimated. Morphology of collagen in myocardial tissue was observed with Masson staining, collagen volume fraction (CVF) in left ventricular interstitial tissue was measured by image analysis and the serum transforming growth factor β1( TGF-β1) expression was detected using ELISA and expressions of TGF-β1protein, the collagenⅠ,Ⅲ were detected by Western-blotting. The Smad3 and Smad7 mRNA in myocardial tissue expressions were detected using real-time PCR. Results Compared with the Sham group, the cardiac index, LVMI, CVF in left ventricular interstitial tissue and the serum TGF-β1level of the AOB group significantly increased (P<0.05) and the TGF-β1, the collagenⅠ,Ⅲ protein expression levels were significantly higher than that of the Sham group (P<0.05). Compared with the AOB group, the cardiac index, LVMI, CVF, the serum TGF-β1level obviously decreased (P<0.05) and the TGF-β1, the collagen fibersⅠand Ⅲ expression levels significantly declined (P<0.05) in the Apelin-13 group and the SB431542 group. The Smad7 mRNA expression in each group displayed contrary tendency. Conclusion Apelin-13 can alleviate myocardial fibrosis induced by pressure overload in rats through partially inhibiting TGF-β1-Smads signal pathway.
apelin-13; pressure overload; myocardial fibrosis; transforming growth factorβ1
R 541
A
2095-5227(2014)10-1049-05
10.3969/j.issn.2095-5227.2014.10.021
时间:2014-07-18 10:17
http://www.cnki.net/kcms/detail/11.3275.R.20140718.1017.002.html
2014-06-09
辽宁省科学技术计划项目(2012225019)
Supported by the Science and Technology Plan Project of Liaoning Science and Technology Committee(2012225019)
王向兵,男,硕士。研究方向:心肌损伤与修复。Email: wangbing2423602@163.com
张志,男,博士,主任医师,主任。Email: ningcheng631@163.com

