促红细胞生成素对大鼠肢体缺血再灌注后肾血流的影响
刘彩树 李为朋 闫合燕 张亚萍 蔡森 门秀丽 孔小燕 李宏杰
促红细胞生成素对大鼠肢体缺血再灌注后肾血流的影响
刘彩树 李为朋 闫合燕 张亚萍 蔡森 门秀丽 孔小燕 李宏杰△
目的探讨促红细胞生成素(EPO)对大鼠肢体缺血再灌注(LIR)后肾血流的影响及可能作用机制。方法30只雄性SD大鼠随机分为Control组、LIR组和EPO+LIR组,每组10只;检测各组动物肾血流量、血浆肌酐(Cr)、尿素氮(BUN)含量、肾组织湿干比(W/D)、NO、一氧化氮能合成酶(NOS)及内皮素-1(ET-1)含量,采用免疫组织化学法检测肾组织细胞间黏附分子(ICAM-1)和血管细胞黏附分子(VCAM-1)的表达,光镜下观察肾组织形态学改变。结果LIR组较Control组肾血流量减少,血浆Cr、BUN、肾组织W/D、NO、ET-1、NOS活性、ICAM-1和VCAM-1的表达增高(P<0.05),镜下可见肾组织间隙增宽和炎细胞浸润等病理改变。EPO+LIR组较LIR组肾血流量增加,血浆Cr、BUN、肾组织W/D、NO、ET-1和NOS活性、ICAM-1和VCAM-1的表达均降低(P<0.05),肾组织病理学变化有所减轻。结论EPO可改善LIR后大鼠的肾功能,增加肾血流量,其机制可能与减轻肾水肿、调节肾血管舒缩功能、减轻炎症反应有关。
再灌注损伤;四肢;肾血浆流量,有效;红细胞生成素;大鼠,Sprague-Dawley;疾病模型,动物
肢体缺血再灌注损伤(limb ischemia reperfusion,LIR)可对缺血肢体及远隔器官造成损伤,肾脏是最易受累的器官之一[1]。研究表明,促红细胞生成素(EPO)可减轻肾移植后的缺血再灌注损伤[2]。本研究旨在观察LIR后大鼠肾血流的变化,探讨EPO预处理对大鼠LIR后肾血流的影响及可能机制。
1 材料与方法
1.1 材料SPF级雄性SD大鼠30只,体质量(250±20)g,购自北京华普康生物科技股份有限公司(SCXK京2009-0004)。人重组促红细胞生成素(rhEPO)由沈阳三生制药有限责任公司生产,NO、一氧化氮合成酶(NOS)及内皮素-1 (ET-1)检测试剂盒购自南京建成生物工程研究所。细胞间黏附分子(ICAM-1)、血管细胞黏附分子(VCAM-1)单克隆抗体、PV6001/6002二步法免疫组化检测试剂盒及浓缩二氨基联苯胺(DAB)试剂盒购自北京中杉金桥生物技术有限公司。
1.2 动物分组及给药30只SD大鼠采用随机数字表法分为3组,每组10只。(1)LIR组。参考文献[3]方法制作大鼠LIR模型,乙醚麻醉下将大鼠的双后肢根部用橡皮带环绕结扎,阻断血流4 h,恢复血流灌注4 h后处死,从腹主动脉取血,3 000 r/min离心20 min,取血浆,Eppendorf管分装,-70℃保存。取一部分左侧肾脏,冷生理盐水(NS)冲洗干净,滤纸吸干后放入4%中性甲醛固定,其余放入液氮速冻后,-70℃保存。(2)Control组。动物松弛结扎双后肢但不阻断血流,其余操作同LIR组。(3)EPO+LIR组。于再灌注前30 min腹腔注射用NS配制的EPO 3 000 U/kg,其余操作同LIR组。LIR组和Control组亦在再灌注前30 min腹腔注射等量NS。
1.3 观察指标(1)于再灌注4 h用激光多普勒灌注监测仪及Perisoft for Windows软件实时记录各组肾血流灌注量的变化。(2)全自动生化分析仪测定血浆肌酐(Cr)和尿素氮(BUN)含量。(3)取-70℃冻存的肾组织依试剂盒说明书测定NO、NOS、ET-1含量。(4)称取0.1 g肾组织于60℃烘干72 h,计算湿干重比值(W/D)。(5)经4%中性甲醛固定的肾组织,石蜡包埋、切片后,用免疫组织化学法及北航自动图像分析系统测定VCAM-1和ICAM-1蛋白平均光密度(OD)值。HE染色后观察组织的病理学变化。
1.4 统计学方法采用SPSS 15.0软件进行统计学分析。计量数据以均数±标准差(±s)表示,多组间比较用单因素方差分析,组间多重比较采用SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组血浆Cr、BUN、W/D及肾血流量的比较见表1。LIR组较Control组肾血流量降低(P<0.05),BUN、Cr和W/D升高(P<0.05);EPO+LIR组肾血流量低于Control组而高于LIR组,BUN、Cr和W/D高于Control组而低于LIR组(P<0.05)。
Tab.1 Comparison of renal blood flow,BUN,Cr and W/D ratios of renal tissue between three groups表1 各组肾血流量、BUN、Cr和W/D比较(n=30,±s)
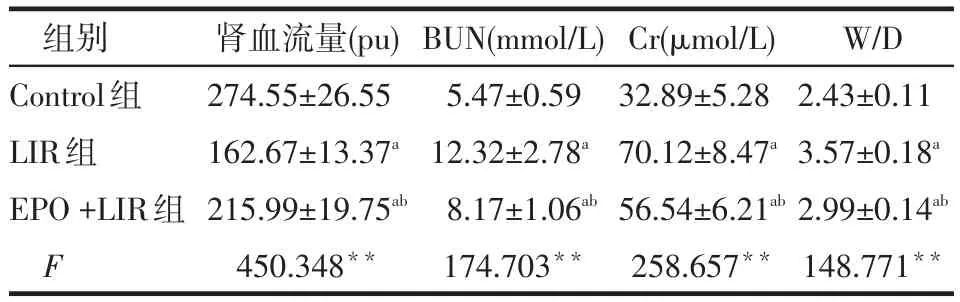
Tab.1 Comparison of renal blood flow,BUN,Cr and W/D ratios of renal tissue between three groups表1 各组肾血流量、BUN、Cr和W/D比较(n=30,±s)
*P<0.05,**P<0.01,a与Control组比较,b与LIR组比较,P<0.05;表2、3同;Pu指单位时间内检测到的血细胞数与血流速的乘积
组别Control组LIR组EPO+LIR组F肾血流量(pu) 274.55±26.55 162.67±13.37a215.99±19.75ab450.348**BUN(mmol/L) 5.47±0.59 12.32±2.78a8.17±1.06ab174.703**Cr(μmol/L) 32.89±5.28 70.12±8.47a56.54±6.21ab258.657**W/D 2.43±0.11 3.57±0.18a2.99±0.14ab148.771**
2.2 各组肾组织NO、NOS、ET-1比较LIR组NO、iNOS、tNOS和ET-1较Control组升高(P<0.05);EPO+LIR组NO、iNOS和tNOS、ET-1高于Control组而低于LIR组(P<0.01),见表2。
Tab.2 Values of NO,iNOS,tNOS and ET-1 of renal tissue in three groups表2 各组NO、iNOS、tNOS和ET-1含量(n=30,±s)
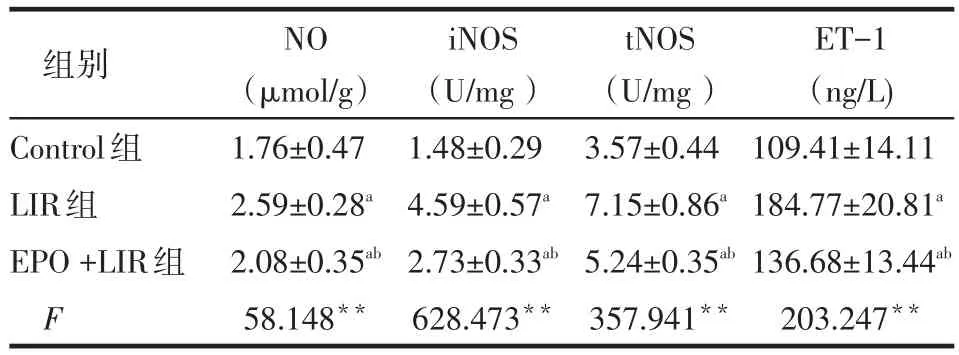
Tab.2 Values of NO,iNOS,tNOS and ET-1 of renal tissue in three groups表2 各组NO、iNOS、tNOS和ET-1含量(n=30,±s)
组别Control组LIR组EPO+LIR组F NO (μmol/g)1.76±0.47 2.59±0.28a2.08±0.35ab58.148**iNOS (U/mg)1.48±0.29 4.59±0.57a2.73±0.33ab628.473**tNOS (U/mg)3.57±0.44 7.15±0.86a5.24±0.35ab357.941**ET-1 (ng/L) 109.41±14.11 184.77±20.81a136.68±13.44ab203.247**
2.3 肾组织ICAM-1和VCAM-1蛋白表达情况Control组可见肾小管上皮细胞内有ICAM-1和VCAM-1的弱阳性表达;LIR组与Control组相比,ICAM-1和VCAM-1表达增强;EPO+LIR组ICAM-1 和VCAM-1的表达比LIR组减弱,但仍比Control组强。各组ICAM-1和VCAM-1表达差异均有统计学意义(P<0.01),见表3。
Tab.3 Values of average absorbance of ICAM-1 and VCAM-1 in three groups表3 肾脏ICAM-1和VCAM-1的平均OD值(n=10,±s)

Tab.3 Values of average absorbance of ICAM-1 and VCAM-1 in three groups表3 肾脏ICAM-1和VCAM-1的平均OD值(n=10,±s)
组别Control组LIR组EPO+LIR组F ICAM-1 0.135±0.016 0.406±0.025a0.267±0.021ab3 566.327**VCAM-1 0.198±0.031 0.513±0.048a0.324±0.029ab968.896**
2.4 肾组织形态观察结果Control组肾小球无水肿,形态完整,肾小管管腔开放良好,无狭窄变形和炎细胞浸润,肾组织结构基本正常。LIR组肾小球淤血水肿,肾间质有炎细胞浸润,肾小管上皮细胞肿胀,管腔扩张。EPO+LIR组较LIR组肾小管上皮细胞肿胀和炎细胞浸润所有减轻,见图1。
3 讨论
LIR常见于断肢再植、肢体挤压伤、四肢手术及游离肌瓣转移等术后的缺血肢体。LIR还会累及远隔器官,甚至造成多器官功能障碍综合征(MODS),其中肾血流量减少出现最早,进而引起肾脏损伤[1]。EPO是一种由肾脏分泌的酸性糖蛋白激素,通过与靶细胞上的促红细胞生成素受体结合发挥生物学效应[4]。有研究认为,EPO预处理能显著改善血流动力学和心肌酶谱,保护心肌细胞超微结构[5]。Genc等[6]在大脑及神经元缺血再灌注损伤研究中发现,EPO能抑制神经元凋亡,减少梗死面积,保护脑组织及神经。Moeini等[7]研究显示,在大鼠的肾脏缺血再灌注前2 h应用EPO可减轻大鼠肾脏损伤,但是其对远隔器官肺脏并无保护作用。
本研究结果显示,LIR组较Control组和EPO+ LIR组肾血流减少,血浆中Cr和BUN含量升高,光镜下可见基底膜增厚、间隙增宽及炎细胞浸润,表明大鼠LIR引发了远隔器官—肾脏的结构损伤和功能障碍,提示此可能与肾血流量减少有关。肾血流量减少的可能机制有:(1)肾组织水肿。LIR组肾组织W/ D较另2组增大,表明肾组织水肿,而水肿液可压迫肾血管,使肾血流量减少。(2)血管舒缩功能改变。LIR组缩血管物质ET-1较另2组增加显著,虽然具有扩血管作用的NO含量及促进NO合成的NOS的活性也有所增加,但LIR组NO/ET-1较Control组明显降低,因此肾血管收缩,肾血流量减少。(3)肾组织ICAM-1和VCAM-1表达增强。LIR组ICAM-1和VCAM-1均高于另2组,而ICAM-1和VCAM-1可介导细胞间的黏附及白细胞浸润、贴壁,促进炎症反应发生,并增大毛细血管后阻力,引起肾脏微循环障碍,降低血液流速,促进水肿发生。
EPO+LIR组与LIR组相比,肾血流量增加,肾脏的结构与功能均明显改善,表明EPO增加了肾血流量,对肾脏起到保护作用。考虑可能机制有:(1)减轻肾水肿。EPO+LIR组W/D减小,表明肾水肿减轻,提示EPO降低了水肿液对血管的压迫,使肾血流量增加。(2)促进血管活性物质平衡。EPO+LIR组NO、NOS、ET-1较LIR组均降低,但其NO/ET-1比LIR组大,表明EPO可促进肾血管舒张,有利于增加肾血流量。(3)减轻炎症反应。EPO+LIR组肾组织ICAM-1和VCAM-1表达较LIR组减弱,表明EPO可减轻白细胞贴壁及炎症反应,降低毛细血管后阻力,改善肾脏微循环,使肾血流增多,肾功能得以改善。
综上所述,EPO预处理可在LIR后对肾脏起到保护作用,可为临床预防和治疗LIR继发的肾功能衰竭提供新途径。

Fig.1 The pathological changes of renal tissue under light microscope(HE×200)图1 光镜下肾组织的病理学改变(HE×200)
[1]汪涛,周业庭.急性肢体缺血再灌注损伤的研究进展[J].中华实验外科杂志,2012,29(12):2628-2632.
[2]van Rijt WG,van Goor H,Ploeg RJ,et al.Erythropoietin-mediated protection in kidney transplantation:nonerythropoietic EPO derivatives improve function without increasing risk of cardiovascular events[J]. 2013,27(3):241-248.
[3]赵利军,孔小燕,门秀丽,等.丹参对大鼠肢体缺血再灌注后多器官水肿的预防作用[J].天津医药,2012,40(8):806-808.
[4]皮欣灵,甘华.EPO的组织保护作用临床应用研究进展[J].安徽医药,2013,17(1)137-139.
[5]王媛媛,曹建,陈勤,等.促红细胞生成素对小鼠心肌缺血损伤的心脏保护作用及机制[J].中国当代医药,2013,20(24):20-22.
[6]Genc S,Koroglu TF,Genc K.Erythropoietin as a novel neuroprotectant[J].Restor Neurol Neurosci,2004,22(2):105-119.
[7]Moeini M,Nematbakhsh M,Fazilati M,et al.Protective role of recombinant human erythropoietin in kidney and lung injury following renal bilateral ischemia-reperfusion in rat model[J].Int J Prev Med,2013,4(6):648-655.
(2013-11-04收稿2014-02-20修回)
(本文编辑陆荣展)
The Influence of Erythropoietin in Renal Blood Flow after Limb Ischemia Reperfusion in Rats
LIU Caishu,LI Weipeng,YAN Heyan,ZHANG Yaping,CAI Sen,MEN Xiuli,KONG Xiaoyan,LI Hongjie Department of Pathophysiology,Basic Medical College of Hebei United University,Tangshan 063000,China LI Hongjie,E-mail:hongrixuan@sina.com
ObjectiveTo investigate the influence and mechanism of erythropoietin(EPO)in renal blood flow after limb ischemia reperfusion(LIR).MethodsThirty male SD rats were randomly divided into control group,LIR group and EPO+LIR group with ten in each group.The values of renal blood flow,plasma creatinine(Cr),urea nitrogen(BUN)content in plasma,kidney tissue wet to dry ratio(W/D),nitric oxide(NO),nitric oxide synthase(NOS)and endothelin-1(ET-1)in renal tissue were detected in three groups.The immunohistochemistry assay was used to detect the expression of intercellular adhesion molecule(ICAM-1)and vascular cell adhesion molecule(VCAM-1)in renal tissue.The morphological changes of renal tissue were observed with light microscope.ResultsThe renal blood flow was significantly decreased,while the values of Cr,BUN,W/D,NO,ET-1,NOS,expressions of ICAM-1 and VCAM-1 was significantly increased in LIR group than those of control group(P<0.05).Broaden interstitial and infiltration of inflammatory cells were observed in the renal tissue under light microscope.In the EPO+LIR group,the renal blood flow increased,the values of Cr,BUN,W/D,NO,ET-1 and NOS,expressions of ICAM-1 and VCAM-1 decreased significantly compared with those of LIR group(P<0.05).The pathological changes were alleviated in EPO+LIR group.ConclusionEPO can improve renal function,increase renal blood flow in rats after LIR.The mechanism may be related to the decreased edema,changed renal vasomotor function and decreased inflammation.
reperfusion injury;extremities;renal plasma flow,effective;erythropoietin;rats,Sprague-Dawley;disease models,animal
R363.2;R977.1
A
10.3969/j.issn.0253-9896.2014.07.010
河北联合大学大学生创新性实验计划资助项目(X2013037);河北联合大学培育基金项目(LDPYS05,GP201301)
唐山,河北联合大学基础医学院(邮编063000)
△通讯作者E-mail:hongrixuan@sina.com

