黄秋葵花提取物体外抗氧化活性的研究
朱艳芳,马应波,刘东华,张爱民,2,薛建平,2,盛 玮,2
(1.淮北师范大学 生命科学学院,安徽 淮北 235000;2.资源植物生物学安徽省重点实验室,安徽 淮北 235000;3.昆山东海农业发展有限公司,江苏 昆山 215301)
黄秋葵(Abelmoschus esculentus(L.)Moench)属于锦葵科秋葵属一年生草本植物,别名补肾草、秋葵和羊角豆等.相关研究表明,可食用的嫩果营养成分丰富,富含蛋白质、多糖、黄酮、不饱和脂肪酸、维生素等多种化合物,是一种营养型保健蔬菜[1-3],美国人称其为“植物伟哥”,日本人称其为“绿色人参”,经常食用可增强人体体质,所以被许多国家定为运动员的首选蔬菜.许多研究还表明,黄秋葵的嫩果具有抗疲劳[4-5]、治疗烧(烫)伤[6]等功能,黄秋葵多糖具有结合胆酸[7]及抗氧化[8]等作用.黄秋葵既是营养丰富的保健型蔬菜,又是疗效显著的常用中药,其花、叶、芽、果均可食用.花、种子和根还可入药,有滋阴补阳的功能,是一种名副其实的菜、药、花兼用型植物[9].因此,黄秋葵具有很高的开发价值.
黄秋葵原产于非洲东部地区,现广泛栽培于热带和亚热带地带,上世纪90年代初黄秋葵被引入我国内陆.目前,我国大陆南北方各地均有黄秋葵的分布与栽培,种植较多的有北京、广东、上海、山东、江苏、浙江、海南、云南、安徽、福建等省市.目前对黄秋葵的果实研究比较多,但是,作为黄秋葵的副产物其花也含有多种营养成分,我们主要对黄秋葵花提取物的抗氧化活性进行初步研究,为黄秋葵花的开发利用提供依据.
1 材料和方法
1.1 材料与仪器
黄秋葵花由江苏省昆山东海农业发展有限公司提供.
六氰合铁酸钾(K3[Fe(CN)6])、K2HPO4、KH2PO4、三(羟甲基)氨基甲烷、三氯乙酸(TCA)、FeCl3、95%乙醇、邻二氮菲、邻苯三酚、FeSO4、过氧化氢(H2O2)、HCl等均为国产分析纯(购于上海国药集团),DPPH·(二苯代苦味酰基自由基)(购于Sigma公司).
UV-4802型紫外可见分光光度计(尤尼科上海仪器有限公司),ANO124电子天平(上海民桥精密科学仪器有限公司),RE52-98型旋转蒸发仪(上海亚容生化仪器厂).
1.2 方法
1.2.1 黄秋葵花提取物制备
称取一定量的干燥黄秋葵花,碾碎成粉末,过20目筛,按料液比为1:25加入65% 乙醇,在70 ℃水浴中浸提1.5 h,过滤得提取溶液,减压浓缩后,真空冷冻干燥,即得黄秋葵花提取物粉未.
1.2.2 黄秋葵花提取物还原能力测定
将5 mL 不同浓度黄秋葵花提取液放于试管中,加入5 mL pH 6.6 的磷酸盐缓冲液(0.2 mol/L)和5 mL 1% 的 K[3Fe(CN)6],摇匀,50 ℃ 水浴保温 20 min,快速冷却,再加入 5 mL 的 10% TCA,混匀,6 000 r/min 离心10 min,取5 mL 上清于试管中,再依次加入5 mL 蒸馏水和1 mL 0.1% FeCl3,充分混匀,静置10 min,以蒸馏水为对照,分光光度计测定700 nm处的吸光度值A700nm,即可表示还原能力的强弱,A700nm越大还原能力越强[10-11].
1.2.3 黄秋葵花提取物对DPPH·的清除能力测定
在5 mL DPPH· 溶液(6.5×10-5mol /L)中分别加入不同浓度的黄秋葵花提取物溶液1 mL,混匀后室温静置30 min,测定在517 nm 处的吸光度值,计算黄秋葵花提取物对DPPH· 的清除率[12]:
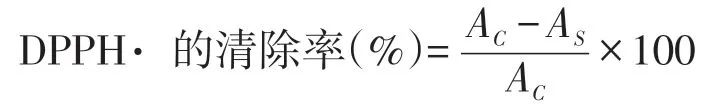
式中:AS为加入黄秋葵提取物在517 nm 处吸光度;AC为未加入样品在517 nm 处吸光度.
1.2.4 黄秋葵花提取物对羟自由基(·OH)的清除能力测定
采用邻二氮菲-Fe2+的方法[13]测定黄秋葵花提取物对·OH 的清除能力,步骤为:加入邻二氮菲溶液、150 mmol/L pH 7.4磷酸盐缓冲液和黄秋葵花提取物溶液(损伤管及未损伤管不加黄秋葵花提取物,用蒸馏水补充体积),摇匀,加入FeSO4溶液快速摇匀,再加入H2O(2未损伤管不加),达到终浓度为:邻二氮菲0.15%、FeSO40.75 mmol/L、H2O20.3%,总体积10 mL.37 ℃恒温水浴1 h,测定各管在536 nm波长下的吸光度值A536nm,不同浓度黄秋葵花提取物对·OH的清除率按下式计算[14].

其中A样为加入黄秋葵花提取物和H2O2在536 nm的吸光度值,A损为加入H2O2在536 nm的吸光度值,A未损为不加入黄秋葵花提取液和H2O2在536 nm的吸光度值.
1.2.5 黄秋葵花提取物对超氧阴离子自由基(O2·-)的清除能力测定[15]
在不同浓度黄秋葵花提取物中加入50 mmol/L pH 8.4 的Tris-HCl 缓冲液,混匀后25 ℃水浴保温20 min,加入25 ℃预热的100 mmol /L邻苯三酚溶液0.1 mL,快速混匀,启动反应后每30 s测一次325 nm处的吸光度值A325nm,至4.5 min为止.将A325nm值与时间(min)进行回归分析,其斜率为V0.不同浓度黄秋葵花提取物对O2·-的清除率按下式计算:

1.2.6 黄秋葵花提取物对由H2O2引起的小鼠红细胞溶血的保护作用测定[16]
取成年昆明小鼠血用肝素钠抗凝,低速离心取沉淀红细胞,预冷生理盐水洗涤数次,制备0.5%的红细胞悬液.取1 mL 红细胞悬液,加入0.5 mL 不同浓度的黄秋葵花提取物,以0.5 mL 0.05mol/L pH 7.4的磷酸盐缓冲液作为阳性对照组,再加入0.5 mL的50 mmol/L H2O2开始反应.37 ℃下反应1 h后,生理盐水稀释5倍,4 000 r/min离心10 min,取上清液,分光光度计测415 nm处的吸光度值A415nm,按下式计算黄秋葵花提取物对由H2O2引起溶血的抑制率:

2 结果与分析
2.1 黄秋葵花提取物的还原能力测定
还原力是评价物质潜在抗氧化活性的重要指标,还原力大小与抗氧化力大小呈正相关.还原力强的物质是良好的电子和氢的供体,可以通过提供电子使自由基变为稳定的物质,终止自由基的链式反应.同时,可与过氧化物的前体物质作用,阻止过氧化物的产生,进而起到抗氧化的作用[16].在黄秋葵花提取物还原能力测定试验中,提取物中黄酮类等还原性物质将六氰合铁酸钾中的Fe3+还原为Fe2+,Fe2+可生成在700 nm处有最大吸光度的Perl普鲁士蓝,分光光度计测定700 nm处的吸光度值来间接反映抗氧化剂还原能力的大小.由图1可知,黄秋葵花提取物的还原能力随着浓度的增大而增强,且呈明显的量效关系.提取物浓度与还原力的线性方程为y=1.642 4x+0.030 1,相关系数R2为0.994 8,EC50(吸光度0.5 时样品的质量浓度)为0.286 1 mg/ mL.

图1 黄秋葵花提取物的还原能力Fig.1 Reducing activities of the extracts from okra flower
2.2 黄秋葵花提取物对DPPH·的清除效果
二苯代苦味酰基自由基(DPPH·)是一种较稳定的自由基,能与有供氢能力的化合物反应,其溶液呈深紫色,在517 nm波长处有最大吸收.当有抗氧化剂存在时,抗氧化剂与DPPH·反应使其吸光度值减小甚至消失,此变化与抗氧化剂的抗氧化能力及其数量呈定量关系.样品的抗氧化活性可通过清除DPPH·的量来确定[17].由图2可知不同浓度的黄秋葵花提取物对DPPH· 均有一定的清除作用,且随着浓度的增加清除率随之增加.线性回归分析表明,黄秋葵花提取物对DPPH·的清除率与提取物浓度符合一元二次方程模型,其方程为y=-105.76x2+145.56x+27.984,相关系数R2为0.997 8,半数清除浓度为0.173 mg/mL,说明黄秋葵花提取物具有较强的清除DPPH·的作用.

图2 黄秋葵花提取物对DPPH· 的清除能力Fig.2 Scavenging activities of the extracts from okra flower on DPPH·
2.3 黄秋葵花提取物对·OH的清除效果
生物体内羟自由基是造成组织脂过氧化,蛋白质解聚、聚合,核酸断裂,多糖解聚的重要活性氧.羟自由基清除率是反映物质抗氧化作用的重要指标[13].橙红色的邻二氮菲-Fe2+被反应生成的·OH氧化成邻二氮菲-Fe3+,在536 nm波长处的最大吸收峰消失,可利用邻二氮菲-Fe2+的褪色程度来衡量·OH的清除量.由图3可知,不同浓度的黄秋葵花提取物对反应中生成的·OH有一定的清除能力,且随着黄秋葵花提取物浓度的升高,对·OH清除效果逐渐增强.多项回归分析表明,黄秋葵花提取物对·OH的清除作用具有一定的量效关系,其关系方程为y=-299.68x2+360.48x-18.624,相关系数R2为0.984 4,半数清除浓度为0.237 mg/mL,说明黄秋葵花提取物是一种较强的羟基自由基(·OH)清除剂.

图3 黄秋葵花提取物对·OH的清除作用Fig.3 Scavenging activities of the extracts from okra flower on ·OH
2.4 黄秋葵花提取物对超氧阴离子自由基(O2·-)的清除效果
邻苯三酚在弱碱性条件下发生自氧化反应,不断生成超氧阴离子自由基(O2·-)及有色中间产物.抗氧化剂能将超氧阴离子自由基(O2·-)歧化分解为H2O2和O2,从而抑制邻苯三酚的自氧化反应.中间产物积累浓度与时间呈线性关系,因此测定特定波长下的吸光度值变化,可得到加抗氧化剂后邻苯三酚的自氧化速率,进而间接求得提取物清除超氧阴离子自由基(O2·-)的能力[17].由图4可知,不同浓度的黄秋葵花提取物对超氧阴离子自由基(O2·-)有一定的清除作用,随着浓度的增加清除率随之增加.线性回归分析表明,黄秋葵花提取物对O2·-的清除效果与提取物浓度关系方程为y=-30.566x2+97.545x-2.141,相关系数R2为0.999,半数清除浓度为0.679 mg/mL
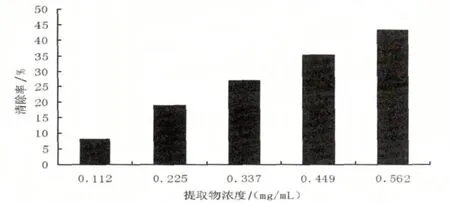
图4 黄秋葵花提取物对O2·-的清除作用Fig.4 Scavenging activities of the extracts from okra flower on O2·-
2.5 黄秋葵花提取物对溶血反应的抑制能力测定
由图5可知,黄秋葵花提取物能有效地抑制红细胞膜的破裂,保护红细胞膜结构的完整性,并显示出一定的量效关系.线性回归分析表明,黄秋葵花提取物对红细胞保护效果与提取物浓度之间关系符合一元二次方程模型,其方程为y=-63.996x2+125.35x+2.610 9,相关系数R2为0.987 9,对H2O2引起的红细胞溶血半数抑制浓度为0.511 7 mg/mL.

图5 黄秋葵花提取物对溶血的抑制能力Fig.5 Inhibition of hemolytic reaction of the extracts from okra flower
3 结论
本试验结果表明,黄秋葵花提取物对清除羟自由基(·OH)、清除超氧阴离子自由基(O2·-)和二苯代苦味酰基自由基(DPPH·)等活性氧具有较强的清除作用,并呈明显的量效关系.在测定的质量浓度范围内,黄秋葵花提取物对羟自由基(·OH)的清除能力大于对超氧阴离子自由基(O2·-)的清除能力.羟自由基是造成组织细胞损伤的主要活性氧之一,能引起膜过氧化,蛋白质交联变性,核酸损伤等,许多疾病如肿瘤、炎症、癌症、衰老、动脉硬化等的引发大多数和羟自由基(·OH)有关[18].黄秋葵花提取物对羟自由基有很强的清除作用,是一种很有前景的待开发的抗氧化活性物质.本文只研究讨论其体外抗氧化的部分试验,至于黄秋葵花提取物在生物体内的抗氧化活性如何,我们将继续深入研究.总之,对黄秋葵花提取物的生物抗氧化活性进行深入研究,论证黄秋葵花在功能性茶及功能性食品上具有很好的应用前景,从而提高黄秋葵种植的经济效益.
[1]刘娜.黄秋葵的综合利用及前景[J].中国食物与营养,2006(6):27-30.
[2]董彩文,梁少华.黄秋葵的功能特性及综合开发利用[J].食品研究与开发,2007,28(5):180-182.
[3]覃世成.药食兼用保健蔬菜—黄秋葵[J].农业新技术,2003,4(4):195.
[4]李建华,陈珊.黄秋葵水提取液抗疲劳的药效学观察[J].中国运动医学杂志,2004,23(2):196-197.
[5]王君耀,周峻,汤谷平.黄秋葵抗疲劳作用的研究[J].中国现代应用药学杂志,2003,20(4):316-317.
[6]张忠堤.秋葵用湿润暴露疗法治疗烧(烫)伤73例报告[J].现代医药卫生,1995,11(S1):75-76.
[7]任丹丹,陈谷.黄秋葵多糖的提取、分离及其体外结合胆酸盐能力的分析[J].食品科学,2010,31(13):110-113.
[8]赵焕焕,贾陆,裴迎新.黄秋葵粗多糖体外抗氧化活性测定[J].郑州大学学报:医学版,2012,47(1):40-43.
[9]高振茂,高冠亚,杜丽红.天然佳蔬黄秋葵的营养与食用方法[J].上海蔬菜,2005(2):26-27.
[10]罗祖友,严奉伟,薛照辉,等.藤茶多糖的抗氧化作用研究[J].食品科学,2004,25(11):291-295.
[11]严奉伟,罗祖友,吴季勤,等.菜籽多糖的抗氧化作用与机制研究[J].中国农业科学,2005,38(1):157-162.
[12]SHIMADA K,FUJIKAWA K,YAHARA K,et al.Antioxidative properties of xanthin on autoxidation of soybean oil in cyclodextrin emulsion[J].Journal of Agricultural and Food Chemistry,1992,40:945-948.
[13]金鸣,蔡亚欣,李金荣,等.邻二氮菲-Fe2+氧化法检测H2O2/Fe2+产生的羟自由基[J].生物化学与生物物理进展,1996,23(6):553-555.
[14]盛玮,吴灵玮,谢笔钧.黑糯玉米色素的抗氧化活性研究[J].中国粮油学报,2008,23(6):85-88.
[15]邹国林,桂兴芳,钟晓林,等.一种SOD的测活方法[J].生物化学与生物物理进展,1986,13(4):71-73.
[16]MEIR S,KANNER J,AKIR B,et al.Determination and involvement of aqueous reducing compounds in oxidative defense systems of various senescing leaves[J].Journal of Agricultural and Food Chemistry,1995,43:1813-1815.
[17]曹玉娜,宋志前,魏征,等.抗氧化剂的抗氧化活性测定方法研究进展[J].中国药房,2013,24(1):86-88.
[18]OZSOY N,CAN A,YANARDAG R,et al.Antioxidant activity ofSmilax excelsaL.leaf extracts[J].Food Chem,2008,110(3):571.

