苯唑西林钠与胃蛋白酶相互作用的光谱研究
季婉茹,程 可,葛 凯,邵从英
(淮北师范大学 化学与材料科学学院,安徽 淮北 235000)
药物小分子与蛋白质结合作用的研究是介于生命科学和化学之间的一种新型课题,也是化学、生命科学以及医学界共同关注的问题[1-4].胃蛋白酶(Pepsin)存在于哺乳动物胃肠道中,是重要的消化性蛋白酶,在酸性环境中具有较高活性.在中性或碱性的溶液中,因发生解链而丧失活性,在医疗和医药方面研究较多.
苯唑西林钠(Oxacillin Sodium 简写为OXCL)属于内酰胺类半合成青霉素类抗生素,它主要用于治疗产青霉素酶葡萄球菌的感染,亦可用于治疗化脓性链球菌或者是肺炎球菌和耐青霉素葡萄球菌所形成的混合型感染.抗菌作用方式和青霉素相似,它对青霉素酶葡萄球菌显示了良好的抗菌活性,其通过抑制细菌的细胞壁合成而发挥杀菌作用.本实验探讨苯唑西林钠与胃蛋白酶的主要作用力类型和热力学函数的变化,同时计算反应结合常数k与结合位点数n,利用紫外吸收光谱法来考察苯唑西林钠对蛋白质构象的影响.
1 实验部分
1.1 仪器与试剂
FP-8300 型(日本岛津)荧光分光光度计;TU-1901 型(北京普析)双光束紫外可见分光光度计;pHS-3D 型(上海虹益)精密pH 计;HH-4 型(国华电器)数显恒温水浴锅;苯唑西林钠(2.08×10-4mol·L-1)(99.0%纯度):准确称取0.459 1 g苯唑西林钠(分子量441.44)(苏州二叶制药有限公司)用去离子水溶解稀释配制50 mL 的备用液,取1.00 mL 该溶液转移到100 mL 容量瓶中,定容摇匀;胃蛋白酶(2.08 ×10-4mol·L-1):准确称取1.820 2 g胃蛋白酶(分子量35 000,南京海辰药业有限公司)用去离子水溶解稀释,定容于250 mL容量瓶中(溶液保存到冰箱中待用);B-R缓冲溶液:在三酸混合液0.1 L(磷酸、乙酸、硼酸,均为0.04 mol·L-1)中,加入0.2 mol·L-1的NaOH溶液调整pH至1.81,用酸度计测定;冰箱1-4 ℃保存;实验所用试剂均为分析纯,实验用水为去离子水.
1.2 实验方法
在10 mL的一系列比色管中依次加入pH为1.81的B—R缓冲溶液1.00 mL,胃蛋白酶溶液1.00 mL,再依次加入不同体积的苯唑西林钠溶液,以去离子水定容至10.00 mL,摇匀,静置20 min,分别记录在290-500 nm范围内不同温度下(288 K、298 K和308 K)的荧光发射光谱(以276 nm为激发波长,激发狭缝5 nm,发射狭缝也为5 nm).在298 K时,记录Δλ=15 nm与Δλ=60 nm的同步荧光光谱.
2 结果与讨论
2.1 胃蛋白酶的荧光光谱

图1 苯唑西林钠与胃蛋白酶荧光淬灭光谱Fig 1 Fluorescence quenching of pepsin(2.08×10-4 mol·L-1)in the presence of OXCL
对胃蛋白酶预扫描,得到胃蛋白酶的荧光最大发射峰为340 nm,固定胃蛋白酶浓度,向其中不断加大苯唑西林钠的浓度,结果见图1,发现胃蛋白酶荧光强度不断降低,最大荧光发射波长也有较明显的蓝移,说明苯唑西林钠能淬灭胃蛋白酶的内源荧光,苯唑西林钠与胃蛋白酶之间发生相互作用.
2.2 荧光淬灭的机理
荧光淬灭的过程可以分为静态淬灭过程与动态淬灭过程[5].动态淬灭过程是淬灭剂对荧光物质的激发态分子发生了相互作用,而静态淬灭过程则是淬灭剂对荧光物质的基态分子发生作用,淬灭的数据可以通过Stern-Volmer方程[6]进行分析:

式中F0和F分别为加入淬灭剂前后混合溶液的荧光强度,[Q]为淬灭剂的浓度,τ0为生物大分子平均荧光寿命(荧光淬灭剂不存在),一般生物大分子荧光寿命值大约为10-8s[7],Kq为双分子碰撞淬灭常数,Ksv为Stern-Volmer淬灭常数.
一个荧光淬灭过程是动态淬灭过程还是静态淬灭过程可以通过在不同温度下,淬灭常数Ksv的变化情况加以判断.若是动态淬灭过程,随着温度的不断增加,Ksv的值也会不断递增,若是静态淬灭过程,随着温度的不断升高,而复合物的稳定性会不断降低,且对应的淬灭常数也会随之而降低[8-9].
苯唑西林钠对胃蛋白酶的荧光淬灭的机理,分别测定在pH1.81温度分别为288 K,298 K,308 K时苯唑西林钠对胃蛋白酶的荧光淬灭光谱.根据Stern-Volmer 方程,以F0/F对[Q]作图,见图2.

图2 不同温度下苯唑西林钠对胃蛋白酶淬灭的Stern-Volmer曲线Fig.2 Stern-Volmer plots for the binding of oxacillin sodium to pepsin at different temperatures
由图2所得的淬灭常数及相关系数见表1.
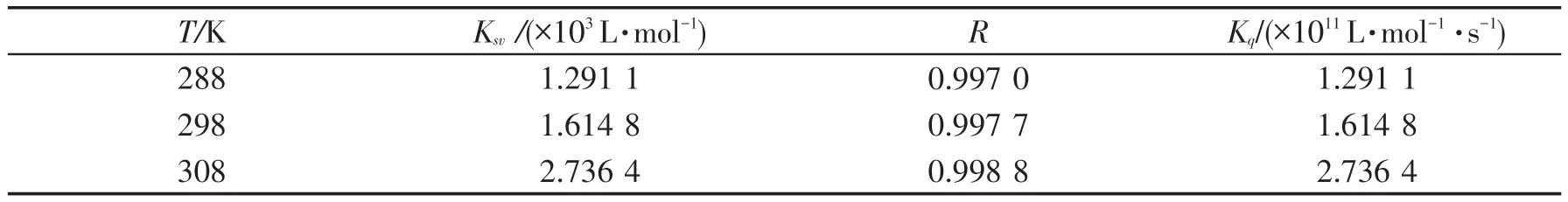
表1 288 K,298 K和308 K时,OXCL和pepsin体系的淬灭常数和相关系数Table 1 Quenching constants and the correlation coefficients for the system of oxacillin sodium-pepsin at 288 K,298 K,308 K
表1表明:随着温度的升高,Stern-Volmer的斜率不断增大,说明随着温度升高,OXCL 对pepsin的淬灭程度增大,该淬灭过程是动态淬灭过程.
2.3 结合常数和结合位点数的确定
对于动态淬灭而言,可以用下面方程来计算结合常数K和结合位点数n[10].

该式中,F0和F分别为加入淬灭剂前后混合溶液的荧光强度,[Q]为淬灭剂浓度,K为胃蛋白酶与苯唑西林钠的结合常数,n是其结合位点数.以lg[(F0-F)/F]对lg[Q]作图见图3.

图3 不同温度下苯唑西林钠对胃蛋白酶体系的 log[(F0-F)/F]对 log[Q]的关系曲线Fig 3 plots for the system of oxacillin sodium-pepsin at different temperatures
胃蛋白酶与苯唑西林钠的结合常数K以及结合位点数n可以通过图3中直线的截距和斜率得到,见表2.

表2 不同温度下苯唑西林钠对胃蛋白酶的表观结合常数K以及结合位点数nTable 2 Quenching constants and number of binding site for pepsin-oxacillin sodium system at different temperatures
由表2知,胃蛋白酶与苯唑西林钠的结合常数K的值随着温度的升高而增大,表明该淬灭过程是动态淬灭过程,胃蛋白酶与苯唑西林钠的结合位点数n的值可推断出胃蛋白酶与苯唑西林钠之间有一个结合位点.
2.4 热力学参数的计算和作用力类型的确定
蛋白质与药物之间的作用力主要包括氢键、疏水作用力、范德华力和静电相互作用.蛋白质和药物之间相互作用的主要类型可以通过它们反应前后的热力学焓变和熵变的相对大小值来加以判断.而热力学焓变和熵变的值可以根据以下热力学公式求得[11-12],


根据生物大分子以及小分子的结合力性质和系统中热力学参数的关系[13~15],ΔH<0 以及ΔS<0,其主要作用类型为氢键和范德华力;ΔH>0 与ΔS>0,主要作用类型则为疏水作用力;ΔH<0 而ΔS>0,主要作用类型则为静电引力.由表2可知,ΔH>0 以及ΔS>0,因此苯唑西林钠对胃蛋白酶的作用力类型主要为疏水作用力,而ΔG<0,苯唑西林钠与胃蛋白酶的作用过程是自发进行.
2.5 能量转移、结合位置的计算
根据Förster 偶极-偶极非辐射能量转移的理论,若发生非辐射能量转移,则需满足供能体发射荧光和受能体的吸收光谱有足够的重叠亦或供能体与受能体可以足够接近而且最大的距离小于8 nm.苯唑西林钠的紫外-可见吸收光谱图与苯唑西林钠对胃蛋白酶的物质的量1:1时的荧光光谱见图4,由此可得两光谱之间有一定的重叠.

图4 苯唑西林钠的紫外-可见吸收光谱b与苯唑西林钠对胃蛋白酶的物质的量1:1时的荧光光谱a的重叠光谱Fig 4 The overlap of the oxacillin sodium’s UV absorption spectrum of b with the fluorescence emission spectrum of pepsin a when the amount of substance ratio is 1:1
能量转移效率(E)、供体和受体间的距离R以及临界能量转移距离R0可由以下公式计算[16-17]:

式中R0:临界距离(50%的能量转移效率);K2为偶极空间取向因子;N为折射指数(介质);Φ为荧光两字产率(给予体);J为重叠积分(供体荧光发射光谱和受体吸收光谱),在实验条件下K2=2/3,N=1.336,Φ=0.118[18].J的值可根据下式计算得出

式中,在波长λ时,F(λ)为荧光强度(荧光给体);ε(λ)为摩尔吸光系数(受体).胃蛋白酶的内源荧光主要是由色氨酸残基产生的,将图4中的胃蛋白酶的荧光光谱图和苯唑西林钠的紫外吸收光谱图的重叠部分(阴影部分)按式(7)可求得光谱的重叠积分J=6.12×10-18cm3·L·mol-1,R0=0.71 nm,E=0.662,R=0.64 nm.因此,苯唑西林钠在胃蛋白酶的结合位点与胃蛋白酶分子中的色氨酸残基的距离为0.64 nm,小于8 nm,说明胃蛋白酶与苯唑西林钠作用过程中发生了非辐射能量转移.
2.6 OXCL与pepsin构象的影响
苯唑西林钠和胃蛋白酶相互作用时的同步荧光见图5.同步荧光光谱图a(Δλ=15 nm)显示了胃蛋白酶中酪氨酸残基的光谱特性(见图5a),而同步荧光光谱图b(Δλ=60 nm)只显示了胃蛋白酶中色氨酸残基的光谱特性[19](见图5b).

图5 苯唑西林钠和胃蛋白酶的同步荧光光谱Fig.5 The synchronous fluorescence spectra of pepsin in the present of oxacillin sodium
由图5的荧光数据可知,酪氨酸残基的内源荧光强度明显小于色氨酸残基,说明色氨酸残基是引起胃蛋白酶内源荧光的主要因素.酪氨酸残基所引起的最大荧光发射波长随着苯唑西林钠浓度的增大而发生明显的蓝移,说明由于苯唑西林钠的加入使得荧光性质发生了改变,使荧光基团的疏水性[20]增加,从而极性减弱,而色氨酸残基所引起的最大荧光发射波长随着溶液中苯唑西林钠浓度的增加而发生较明显的红移,说明苯唑西林钠的加入使得荧光基团的疏水性减小,从而极性增大,更进一步说明苯唑西林钠和胃蛋白酶之间发生了相互作用,随着苯唑西林钠的不断加入,二者之间相互结合,形成复合物,引起了胃蛋白酶的二级结构改变,从而导致构象的变化[21].
3 结论
本文利用紫外吸收光谱、荧光光谱研究在生理条件下苯唑西林钠对蛋白质的相互作用.研究表明:苯唑西林钠对胃蛋白酶的作用力主要是疏水作用力,二者的结合过程自发进行,淬灭类型为动态淬灭,苯唑西林钠与胃蛋白酶的相互作用使胃蛋白酶的构象发生了变化.
[1]GENTILI P L,ORTICA F,FAVARO G.Static and dynamic interaction of a naturally occurring photochromic mole⁃cule with bovine serum albumin studied by UV-visible absorption and fluorescence spectroscopy[J].Phys Chem B,2008,112:16793-16801.
[2]KANDAGAL P B,ASHOKA S,SEETHARMAPPA J.Study of the interaction of an anticancer drug with human and bovine serum albumin:Spectroscopic approach[J].Pharmaceut Biomed,2006,41:393-399.
[3]CHENG Zhengjun,ZHANG Yuntao.Spectroscopic investigation on the interaction of salidroside with bovine serum al⁃bumin[J].Mol Struct,2008,889:20-27.
[4]TIMERBAEV A R,HARTINGER C G,ALEKSENKO S S,et al.Interactions of antitumor metallodrugs with serum pro⁃teins:Advances in characterization using modern analytical methodology[J].Chem Rev,2006,106:2224-2248.
[5]蒋志强,迟燕华,庄稼,等.牛血清白蛋白与锌试剂作用机理的荧光法研究[J].光谱学与光谱分析,2007,27:986-990.
[6]MOTE U S,BHATTAR S L,PATIL S R,et al.Interaction between felodipine and bovine serum albumin:fluorescence quenching study[J].Luminescence,2010,25:1-8.
[7]LAKOWICA J R,WEBER G.Quenching of flurescence by oxygen.Probe for structural fluctuations in macromolecules[J].Biochemistry,1973,12:4161-4170.
[8]LAKOWICZ J R.Principles of fluorescence spectroscopy[M].Plenum Press,2006:372-265.
[9]DEWEY T G.Biophysical and biochemical aspects of fluorescence spectroscopy[M].Plenum Press,1991:1-41.
[10]WARE W R.Oxygen quenching of fluorescence in solution:an experimental study of the diffusion process[J].Phys Chem,1962,66:455-458.
[11]TIAN Jianniao,LIU Jiaqin,ZHANG Jiyou,et al.Fluorescence studies on the interactions of barbaloin with bovine se⁃rum albumin[J].Chem Pharm Bull(Tokyo),2003,51:579-582.
[12]IRVING M K,JEAN M U.The binding of organic ions by proteins.effect of temperature[J].Am Chem Soc,1949,71:847-851.
[13]ROSS P D,SUBRAMANIAN S.The modynamics of protein association reactions forces contributing to stability[J].Biochem,1981,20:3096-3102.
[14]NEMETHY G,SCHERAGA H A.The structure of water and hydrophobic bonding in proteins.Ⅲ.The thermodynamic properties of hydrophobic bonds in proteins1,2[J].J Phys Chem,1962,66:1773-1789.
[15]HU Yanjun,LIU Yi,ZHANG Lixia,et al.Studies of interaction between colchicine and bovine serum albumin by flu⁃orescence quenching method[J].Journal of Molecular Structure,2005,750:174-178.
[16]CRISTOBAL G,DOS R,PIERRE D J M.Fluorescence resonance energy transfer spectroscopy is a reliable“Ruler”for measuring structural changes in proteins:dispelling the problem of the unknown orientation factor[J].Struct Biol,1995,115:175-185.
[17]SAHA D C,RAY K,MISRA T N.Energy transfer in triton-X 100 micelles:a fluorescence study[J].Spect Acta A,2000,56:797-801.
[18]BERTUCCI C,DOMENICI E.Reversible and covalent binding of drugs to human serum albumin:methodological ap⁃proaches and physiological relevance[J].Curr Med Chem,2002,9:1463-1481.
[19]邵爽,马博英,王学杰,等.头孢地嗪钠与牛血清白蛋白相互作用研究[J].物理化学学报,2005,21:792-795.
[20]马立军,梁英超,刘磊,等.新型含芘荧光探针分子与蛋白质相互作用的光谱研究[J].光散射学报,2008,20(3):273-277.
[21]王守业,徐小龙,刘清亮,等.荧光光谱在蛋白质分子构想研究中的应用[J].化学进展,2001,13(4):257-267.

