含氮姜黄素类似物的合成及其酪氨酸酶抑制效应
韦星船,霍梦月,郑成,段彦飞,杨前程,蔡伟平
(广州大学化学化工学院,广东 广州 510006)
含氮姜黄素类似物的合成及其酪氨酸酶抑制效应
韦星船,霍梦月,郑成,段彦飞,杨前程,蔡伟平
(广州大学化学化工学院,广东 广州 510006)
通过芳香醛与4-乙酰基吡啶在酸碱条件下催化缩合,合成了4个单羰基姜黄素类似物A1~A4,并研究了其对酪氨酸酶的抑制活性。结果表明,3-(4-羟基-3,5-二甲氧基苯基)-1-(4-吡啶基)-2-烯-1-酮对酪氨酸酶具有强抑制活性,半数抑制浓度(IC50)为45.1µmol/L,是姜黄素(IC50= 97.1µmol/L)的抑制活性的2.2倍。抑制动力学研究表明,3-(4-羟基-3,5-二甲氧基苯基)-1-(4-吡啶基)-2-烯-1-酮对酪氨酸酶的抑制作用类型属于竞争性抑制。
姜黄素类似物;合成;酪氨酸酶抑制活性;抑制动力学
酪氨酸酶是多酚氧化酶的一种,同时也是结构相当复杂的含有多亚基与铜的氧化还原酶,在各种薯类、菇类以及人体等动植物中广泛存在,少量的微生物中也含有酪氨酸酶,又称多酚氧化酶、酚氧化酶、儿茶酚氧化酶[1]。最早发现的酪氨酸酶具有两种基本功能:作为单酚酶羟基化单酚生成邻二酚;邻二酚又被双酚酶氧化成醌[2]。由于酪氨酸酶的这种双重催化作用控制着黑色素的合成[3],酪氨酸酶与果蔬的氧化褐变,昆虫发育及伤口愈合,人的衰老有着密切的关系[4],抑制其活性可抑制黑色素的生成。因此,酪氨酸酶抑制剂可用于化妆品中作为增白剂,也可以治疗过量的黑色素沉着引起的皮肤病,黄褐斑、老年斑等;酪氨酸酶抑制剂也被用作食品保鲜剂、新型生物杀虫剂、天然染发剂[5-9]。鉴于酪氨酸酶抑制剂在食品、医疗、农业等行业的广泛应用,寻找性能优异的酪氨酸酶抑制剂,研究其抑制机理、抑制动力学以及其应用成为国内外学者的研究热点。
姜黄素属于植物多酚,主要是从姜黄、天南星科中的部分植物(如菖蒲)的根茎中提取出来,是姜黄发挥药理作用最重要的活性成分;姜黄素是具有对称酮的二酮类化合物,是植物界中一种非常罕见的色素,是由双(羟基、甲氧基苯基、烯烃、酮基)构成的对称酮,其主链为不饱和脂肪族及含羟基芳香族基团,结构式如图1,为橙黄色结晶性粉末,熔点为183℃。研究表明,姜黄素是一种新型的酪氨酸酶抑制剂,同时具有抗炎、抗菌、抗氧化、清除自由基、抗肿瘤等广泛的药理作用[10-15]。此外,对黑素瘤细胞同样有一定的抑制作用[16-17]。但由于姜黄素结构不稳定,水溶性差,血药浓度低,在人体内容易被分解,导致其生物活性利用率极低,且姜黄素本身对酪氨酸酶的抑制活性不高,这些严重妨碍了姜黄素在医疗方面作为酪氨酸酶抑制剂的进一步研究应用。一些科学家为增加其水溶性而制备出纳米姜黄素颗粒[18],同时为了发现有价值的化合物,国内外科学家们对其结构进行了改造,发现了一系列酪氨酸酶抑制活性较高的姜黄素类似物。如2,5-双(2,4-二羟基苯亚甲基)环戊酮(结构如图2)[19]。
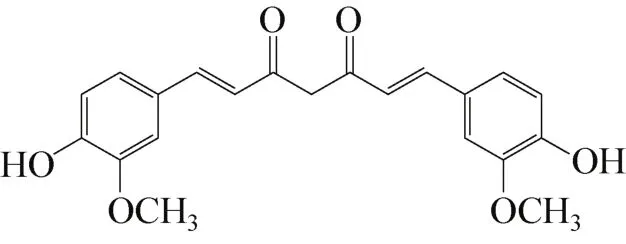
图1 姜黄素结构
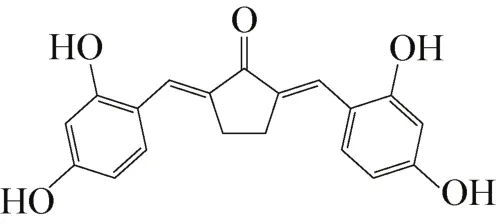
图2 2,5-双(2,4-二羟基苯亚甲基)环戊酮结构
本文作者设计合成了4个单羰基姜黄素类似物A1、A2、A3、A4,研究了其对酪氨酸酶的抑制活性和抑制动力学类型。经SciFinder 数据库检测,其中A4为未见报道的新化合物。
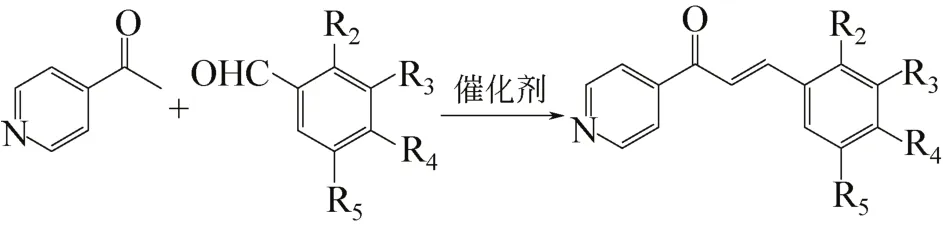
4个姜黄素类似物的合成路线如式(1)。
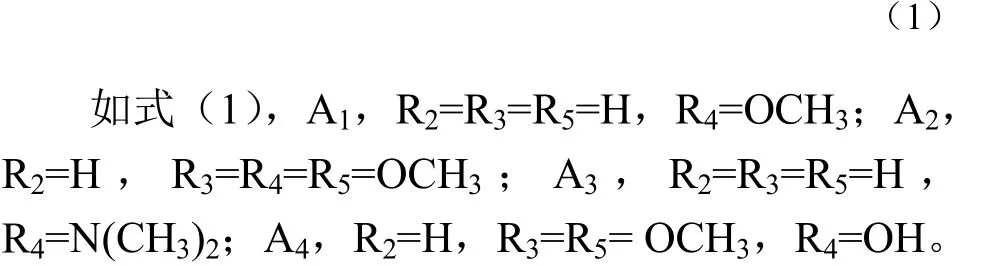
1 实验材料和方法
1.1 主要试剂与仪器
4-乙酰基吡啶,分析纯,上海aladdin有限公司;取代苯甲醛,分析纯,美国AcrosOrganics公司;L-多巴,分析纯,Worthington Biochem公司;酪氨酸酶,比活力为3933 U/mg,Worthington Biochem公司;其他试剂均为分析纯。
硅胶薄层色谱板(TLC),青岛海洋化工厂;双目镜X-5型显微熔点测定仪,北京泰京仪器有限公司;电子分析天平,上海第二天平仪器厂;AVANCE-DPX300型核磁共振仪:1H NMR谱300MHz,瑞士Bruker公司;PHS-25数显pH计,上海精密科学仪器有限公司;ESQUIRE 3000型质谱分析仪,德国Bruker光谱仪器公司;UV-1102PC型紫外分光光度仪,日本岛津制作所;SDZF-6021型真空干燥箱,河南天驰仪器设备有限公司。
1.2 含氮姜黄素类似物的合成
含不同取代基的芳香醛与4-乙酰基吡啶在酸性或碱性条件下催化反应,合成4种化合物A1~A4[20-24]。A1,1-(4-吡啶基)-3-(4-甲氧基苯基)-2-烯-1-酮;A2,1-(4-吡啶基)-3(3,4,5-三甲氧基苯基)-2-烯-1-酮;A3,3-(4-二甲胺基苯基)-1-(4-吡啶基)-2-烯-1-酮;A4,3-(4-羟基-3,5-二甲氧基苯基)-1-(4-吡啶基)-2- 烯-1-酮。
1.2.1 化合物A1~A4的合成
分别称取0.01mol的取代苯甲醛、0.005mol的4-乙酰基吡啶,置于50mL圆底烧瓶中,四氢呋喃作为反应溶剂,常温常压下,缓慢滴加催化剂,搅拌30min,溶液由淡黄色转变为深黄色,静置3天,溶液呈现比之前更深的黄色。过硅胶柱分离提纯,旋转蒸发,加入三氯甲烷重结晶得目标产物A1~A4,其中A1~A3以2mL 40%的氢氧化钠水溶液作为催化剂,A4以2mL吗啉作为催化剂。
1.3 含氮姜黄素类似物对酪氨酸酶抑制活性、抑制率测试
酪氨酸酶抑制活性测定是采用蘑菇酪氨酸酶多巴速率氧化法检测,在Matsuda等[25-28]报道的酶学测定方法基础上稍加改进进行。以0.5mmol/L L-DOPA为底物;分别取适当量的样品(溶于DMSO中),960 μL底物,24 μL酶,用缓冲液将体系补充到4000 μL得测活体系,以不加酶只加抑制剂和底物为空白,室温下测定反应1min内测活体系在波长475 nm紫外光照射下吸光度随时间的变化曲线,得斜率qi。并将斜率qi与不加抑制剂时用相同方法测得的q0相比得一百分数,即为酪氨酸酶剩余酶活力。然后以样品在混合溶液中终浓度为横坐标,剩余酶活力为纵坐标作图,图中酶活力下降50%时抑制剂的浓度即为半数抑制浓度IC50,IC50值越小,抑制作用越强。测活体系中酪氨酸酶的终浓度为37.2mg/L,DMSO的终体积分数≤2%。
1.4 含氮姜黄素类似物对酪氨酸酶抑制动力学测试
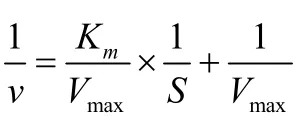
固定酪氨酸酶为24μL,抑制剂的浓度分别为0、26µmol/L、53µmol/L、80µmol/L时,改变底物L-DOPA的浓度,在含底物、酪氨酸酶、抑制剂、0.05mol/L磷酸缓冲液(pH = 6.8)的测活体系中,用上述方法测定不同浓度含氮姜黄素类似物对酪氨酸酶活力的影响,采用Lineweaver-Burk双倒曲线判定抑制类型。
2 实验结果与讨论
2.1 含氮姜黄素类似物的结构表征
A1:产率71.4%,熔点120~121℃。1H NMR(DMSO-d6,300MHz),δ:8.75 (d,J=4.8 Hz,2H)7.69(d,J=4.5 Hz,2H),7.54(t,1H),7.23(d,J=15.6 Hz,2H),6.88 (d,J=0.6 Hz,2H),6.86(s,1H),3.78(d,J=1.5 Hz,3H);13C NMR (CDCl3,75MHz),δ(ppm) 189.77,162.24,150.64,146.78,144.83,130.64,121.57,114.57,55.48; IR(cm-1):3068,2977,1737, 1598,804,1664.
A2:产率53.1%,熔点96~97℃。1H NMR(DMSO-d6,300MHz) δ:8.78(d,J=3.9,2H),7.71(t,2H),7.52 (t,3H),7.23(t,3H),6.87(d,J=0.6 Hz,2H),3.78(t,9H).13C NMR(CDCl3,75MHz),δ:188.16,150.72,146.75,143.19,141.02,133.13,130.65,121.56, 118.77,111.15,55.49. IR(cm-1):3031,2939,1672,1608,465,840.
A3:产率63.2%,熔点125~126℃。1H NMR(DMSO-d6,300MHz) δ:8.69(m,2H),7.65(m,2H) 7.44(m,1H),7.13 (t,2H),7.08(t,1H),6.56(m ,2H),2.94(t,6H) .13C NMR(CDCl3,75MHz),δ:189.52,152.43,150.50,147.87,145.48,130.92,121.91,121.56,115.62,111.76,40. 07. IR(cm-1):3068,2977,1737,1664,1598,842.
A4:产率56.4%,熔点 116~117℃。1H NMR(DMSO-d6,300MHz). δ:8.91(t,2H),7.95(s,2H),7.55(t,1H),6.71(m,1H),6.21(t,2H),5.01(s,1H),3.86(t,6H).13C NMR(CDCl3,75MHz),δ:191.93,152.21,150.52,143.15,141.07,130.53,128.01,122.89,120.54,106.53,56.426. IR(cm-1): 3234,3045,2908,1712,1546,1446.
2.2 含氮姜黄素类似物对酪氨酸酶抑制活性
以L-DOPA为底物,检测化合物对酪氨酸酶的抑制活性,测试结果见图3及表1。图3中的(a)、(b)、(c)、(d)、(e)分别为姜黄素、合成物A1、A2、 A3、A4对酪氨酸酶的抑制作用曲线图。表1中抑制率是在抑制剂浓度为100µmol/L时测得。
由表1可知,4个含氮姜黄素类似物对酪氨酸酶都有一定的抑制作用,抑制活性强弱顺序为A4>A2>A3>A1>姜黄素,其抑制作用均比姜黄素的抑制作用强。其中化合物3-(4-羟基-3,5-二甲氧基苯基)-1-(4-吡啶基)-2-烯-1-酮(A4)的抑制活性最强,是姜黄素的2.2倍。A4的苯环连接—OH,可见,芳香环上的—OH能增强姜黄素类似物对酪氨酸酶的抑制活性,但并不是唯一活性基团;姜黄素的对称结构及碳链上的活泼亚甲基不是维持其酪氨酸酶抑制活性的唯一有效基团;同时姜黄素中的苯环被吡啶环取代,引入N杂原子,使基团的吸电子能力增强,从而增强化合物的酪氨酸酶抑制活性;在4-位甲氧基的邻位引入两个甲氧基形成含有3个甲氧基的基团,能使化合物的活性增强,但同时化合物的毒性增强,不利于其进入临床应用,需要进一步的研究,使毒性降低。
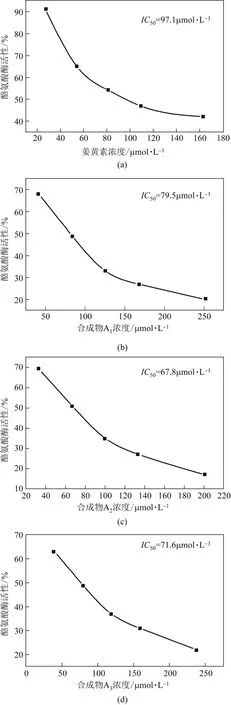
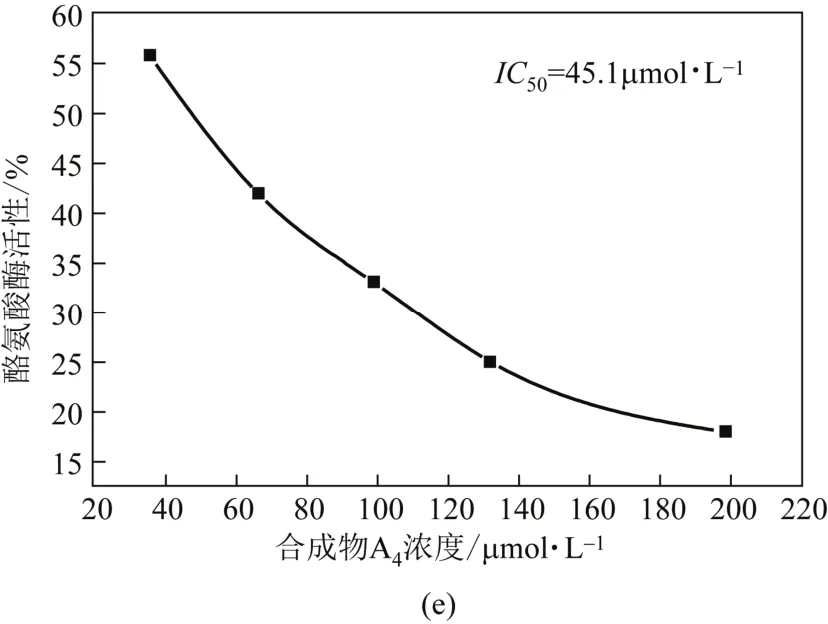
图3 化合物对酪氨酸酶的抑制作用曲线

表1 含氮姜黄素类似物对酪氨酸酶的抑制活性
2.3 含氮姜黄素类似物对酪氨酸酶的抑制动力学
姜黄素类似物A4对酪氨酸酶催化氧化L-DOPA抑制作用的Lineweaver-Burk曲线如图4所示,图中横坐标为底物L-DOPA浓度的倒数,纵坐标为反应速度的倒数值(1min内吸光度随时间变化值的倒数)。图4的曲线1、2、3、4分别是抑制剂浓度为0、26µmol/L、53µmol/L、80µmol/L时的测试结果。
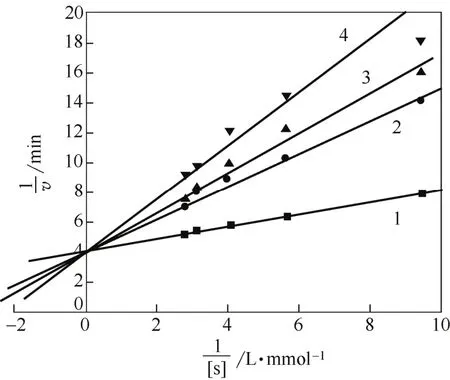
图4 合成物A4抑制酪氨酸酶催化氧化L-DOPA的Lineweaver-Burk曲线
由图4可知,抑制剂3-(4-羟基-3,5-二甲氧基苯基)-1-(4-吡啶基)-2-烯-1-酮的Lineweaver-Burk双倒数图为交于纵轴一点的一组直线,各直线横轴截距随化合物浓度的变化而改变,其抑制类型属于竞争性抑制。该化合物主要通过与酪氨酸酶中的双铜离子作用导致其活性减弱[31]。该抑制剂I(A4)的化学结构与酶作用的底物S(L-DOPA)十分类似,它们都能与酪氨酸酶的活性中心结合,两者对酶的结合有竞争作用;结合后分别形成EI或ES复合物。形成EI后酶不具催化作用,由此导致反应系统中游离酶浓度降低并使酶活性抑制。此时只要增加底物浓度就增加了底物与酶形成ES的可能性。因此反应系统中加入的底物浓度足够高,就有可能使全部EI解离为E和I,E和底物形成ES,从而恢复酶的全部活性。
3 结 论
酪氨酸酶抑制剂广泛应用于医药、化妆品、食品保鲜等行业,其来源只要有以下三方面:①从天然植物组织分离提取;②从商品化合物中筛选;③有机合成出新的化合物。当今社会以绿色环保为发展宗旨,合成活性良好、安全无毒的活性物质是国内外学者的研究热点,用简便易行的方法合成单羰基姜黄素类似物,测试其抑制酪氨酸酶活性,并探讨其作用机理。结果显示,本文合成的含氮单羰基姜黄素类似物比姜黄素具有更强的抑制活性,芳香环上的—OH能增强合成物对酪氨酸酶的抑制活性。因此,进行深入研究,建立构效关系模型,有针对性的合成更多对酪氨酸酶有强抑制活性的姜黄素类似物,开发可应用于医药、化妆品、食品保鲜、杀虫剂等行业的酪氨酸酶抑制剂,具有广泛的应用价值。
[1] Sánche-Ferrer A,Rodríguez-López J N,García-Cánovas F,et al. Tyrosinase:A comprehensive review of its mechanism[J].Biochim. Biophys. Acta,1995,1247(1):1-11.
[2] 赵希荣,李松林. 酪氨酸酶在壳聚糖生物改性中的应用[J]. 化工进展,2011,30(11):2509-2516.
[3] Kamahldin H,Engw T. Direct spectrophotometric assay of monooxygenase and oxidase activities of mushroom tyrosinase in the presence of synthetic and natural substrates[J].Analytical Biochemist,2003,312(l):23-32.
[4] Ito S,Wakamatsu K,Ozeki H. Chemical analysis of melanins and its application to the study of the regulation of melanogenesis[J].Pigm.Cell Res.,2000,13(Suppl 8):103-109.
[5] 宋康康,邱凌,黄璜,等. 熊果甙作为化妆品添加剂对酪氨酸酶抑制作用[J]. 厦门大学学报:自然科学版,2003,42(6):791-794.
[6] 韩强,林惠芬,朱玲莉. 几种中药提取物对酪氨酸酶活性的抑制[J]. 香料香精化妆品,1998,12(4):22-24.
[7] McEvily A J,Iyengar R,Otwell W S.Sulfite alternative prevents shrimp melanosis[J].Food Technology,1991,45:80-86.
[8] 张宗炳. 新杀虫药剂的探索与展望[J]. 化工进展,1986,5(6):1-6.
[9] 孙红军,陈俊南,刘敬镛. 染发剂开发的现状与展望[J]. 化工进展,1988,7(6):30-39.
[10] Sreetayan,Rao M N. Nitric oxide scavenging by curcuminoids[J].J. Pharm. Pharmaeol.,1997,49:105-107.
[11] Brouet I,Ohshima H. Curcumin,an anti-tumour promoter and anti-inflammatory agent,inhibits induction of nitric oxide synthase in activated macmphages[J].Biochem. Biophys. Res. Commun.,1995,206:533-540.
[12] Dikshit M,Rastogl L,Shukla R,et al. Prevention of ischaemia-induced biochemical changes by curcumin & quinidine in the cat heart[J].Indian J. Med. Res.,1995,101:31-35.
[13] Qureshishah A H,Ageel A M. Toxicity studies on alpiniagalanga and curcuma longa[J].Planta Med.,1992,58:124-127.
[14 ] 邓兵,杜志云,唐煌,等. 姜黄素类似物的合成及其清除自由基的研究[J]. 化学研究与应用,2005,18(9):1124-1126.
[15 ] Priyadarsini K I,Maity D K,Naik G H,et al. Role of phenolic O—H and methylene hydrogen on the free radical reactions and antioxidant activity of Curcumin[J].Free Radic. Biol. Med.,2003,35(5):475-484.
[16] Aniruddha B,Jayati C,Aparaa M,Amitava C. Effect of curcumin on gelatinase A(MMP-2) activity in B16FI0 melanoma cells[J].Cancer Lett. ,2004,211(2):235-242.
[17] Wen Yu-Der,Ho Yun-Lung,Shiau Rong-Jen,et al. Synergistic antitumor effect of curcumin and dinitrosyliron complexes for against melanoma cells[J].Organomet.Chem.,2010,695(3):352-359.
[18] 赵述芳,王文坦,胡银玉,等. 搅拌釜内液-液混合溶析沉淀法制备纳米姜黄素颗粒[J]. 化工学报,2013,64(3):841-848.
[19] 莫容清,杜志云,涂增清,等. 姜黄素类似物2,5-双(2,4-二羟基苯亚甲基)环戊酮的合成及酪氨酸酶抑制活性[J]. 化学试剂,2012,34(2),101-103;107
[20] Agarwal Anu ,Srivastava Kumkum ,Purib S K,et al. Antimalarial activity of 2,4,6-trisubstituted pyrimidines[J].Bioorg. Med. Chem. Lett.,2005,15(7):1881-1883.
[21] Naresh Sundurua,Anu Agarwala,Sanjay Babu Katiyara,et al. Synthesis of 2,4,6-trisubstituted pyrimidine and triazine heterocycles as antileishmanial agents[J].Bioorg. Med. Chem.,2006,14(23):7706-7715.
[22] Anu Agarwal,Kumkum Srivastava,Purib S K,et al. Synthesis of 4-pyrido-6-aryl-2-substituted amino pyrimidines as a new class of antimalarial agents[J].Bioorg. Med. Chem.,2005,13(22):6226-6232.
[23] Zakharychev V V, Kuzenkov A V. Synthesis of substituted 1-(2-arylvinyl)-2-azolyl-1-pyridylethanols-1[J].Chemistry of Heterocyclic Compounds,2007,43(8):989-995.
[24] Matsuda H,Higashino M,Nakaip Y,et al. Studies of cuticle drugs from natural sources .Ⅳ. Inhibitory effects of some Aretostaphylos plants on melanin biosynthesis[J].Bio. Pharm. BuIl.,1996,19:153-156.
[25] 韦星船,叶海碧,霍梦月,等. 吡啶基姜黄素类似物对酪氨酸酶的抑制活性[J]. 食品科技,2013,38(5):266-269.
[26] Sachiko S,Miyazaki K,Aiyama R,et al. Tyrosinase inhibitors from crude drugs[J].Biol. Pharm. Bull.,1994,17:266-269.
[27] 柯尊柱,张晓晖,陈小龙. 一种嗜热嗜碱过氧化氢酶的分离纯化和固定化[J]. 化工学报,2011,62(10):2885-2892.
[28] 涂增清,杜志云,张炕,等. 姜黄素多酚类似物对酪氨酸酶抑制活性的研究[J]. 日用化学工业,2011,41(1):27-31.
[29] 宋康康. 抑制剂对酪氨酸酶的效应及其对黑色素生成调控的研究[D]. 厦门:厦门大学,2007.
[30] 张春乐. 抑制剂对蘑菇酪氨酸酶的抑制效应及抗菌活性[D]. 厦门:厦门大学,2007.
[31] Soliman K,Ohad N,Ramadan M,et al. Chalcones as potent tyrosinase inhibitors:The importance of a 2,4-substituted resorcinol moiety[J].Bioorg. Med. Chem.,2005,13(2):433-441.
Synthesis and tyrosinase inhibitory effect of curcumin analogues containing nitrogen
WEI Xingchuan,HUO Mengyue,ZHENG Cheng,DUAN Yanfei,YANG Qiancheng,CAI Weiping
(School of Chemistry and Chemical Engineering,Guangzhou University,Guangzhou 51006,Guangdong,China)
Four pyridyl asymmetrical curcumin analogues were synthesized by 4-acetyl pyridine and appropriate aromatic aldehyde with alkaline and acid catalytic condensation respectively. Their inhibition activity on tyrosinase was evaluated. The results indicate that 3-(4-hydroxyl-3,5-dimethoxyphenyl)-1-(4-pyridyl)-2-en-propanone has the strongest inhibition on tyrosinase,semi inhibitor concentration is 45.1 µmol/L which is 2.2 times of curcumin (IC50= 97.1 µmol/L). Study on inhibitive kinetics discovers that the inhibition on tyrosinase belong to competitive model.
curcumin analogues;synthesis;tyrosinase inhibitory activity;kinetic study
TQ 463
A
1000-6613(2014)08-2155-06
10.3969/j.issn.1000-6613.2014.08.036
2014-03-05;修改稿日期:2014-04-13。
广东省科技计划项目(2011B050400028)。
及联系人:韦星船(1964—),女,教授,博士,硕士生导师。E-mail xing6363@126.com。

