一株猪源致病性蜡样芽孢杆菌的分离与鉴定
赵振宇,戴荣四,刘东友,邓治邦,李润成,尹崇*
(1.湖南农业大学 a.动物科学技术学院;b.动物医学院,湖南 长沙 410128;2.澳大利亚皇家病理学院质保所,新南威尔士 2052)
一株猪源致病性蜡样芽孢杆菌的分离与鉴定
赵振宇1a,戴荣四1a,刘东友2,邓治邦1b,李润成1b,尹崇1b*
(1.湖南农业大学 a.动物科学技术学院;b.动物医学院,湖南 长沙 410128;2.澳大利亚皇家病理学院质保所,新南威尔士 2052)
无菌采集流行性腹泻耐过仔猪的肝脏样本,经无氧及有氧培养获得一株疑似蜡样芽孢杆菌的纯培养物,命名为HN1203。16SrDNA序列(GenBank登录号为JX294967)分析表明,HN1203为蜡样芽孢杆菌群第7基因型菌株。生化鉴定结果表明,该菌的生化特性符合蜡样芽孢杆菌群成员的特征。药敏试验和伴孢晶体蛋白检测结果表明,该菌对链霉素和四环素敏感,对青霉素不敏感,其芽孢不形成伴孢晶体。多位点序列分型(MLST)检测结果表明,该菌带有蜡样芽孢杆菌看家基因pta新的等位基因pta153,序列基因型为ST611。毒素基因的PCR检测结果表明,该菌携带肠毒素基因(hbl、nhe和entFM)和细胞毒素K基因(cytK)。综合以上结果,分离菌为一株新的蜡样芽孢杆菌,且提示分离培养蜡样芽孢杆菌时,不宜采用常用的有氧条件。进一步动物试验结果表明,该分离菌株能够致死实验小白鼠。提示生产实践中应该重视监控猪源致病性蜡样芽孢杆菌的潜在危害。
仔猪;蜡样芽孢杆菌;流行性腹泻;分离;鉴定
蜡样芽孢杆菌(Bacillus cereus)是一种广泛分布 于土壤、水、空气、植物、饲料和各类食品的兼性厌氧、产芽孢杆菌[1]。根据全基因信息,蜡样芽孢杆菌与昆虫病原菌苏云金杆菌(B. thuringiensis)和人畜病原菌炭疽芽孢杆菌(B. anthracis)同属于蜡样芽孢杆菌群[2]。蜡样芽孢杆菌与苏云金杆菌的区别在于苏云金杆菌的芽孢携带具有杀虫作用的伴孢晶体蛋白;与炭疽杆菌的区别在于炭疽杆菌对青霉素敏感、需氧生长并产生炭疽毒素[2]。
有的蜡样芽孢杆菌菌株可用作益生菌添加到食品和饲料中;有的菌株则为条件致病菌,容易污染食物,引起人畜肠道疾病,甚至严重的系统性感染,也是引起牛乳房炎,子宫内膜炎的常见病原菌[3–4],但还未见猪感染该菌的报道。
2012年3月,湖南怀化某猪场爆发哺乳仔猪腹泻,仔猪在出生后3 d发病,死亡集中在发病后1星期内,死亡率60%以上。有实验室诊断为冠状病毒引起的仔猪流行性腹泻病(PED)。耐过仔猪生长不良、消瘦,剖检可见腹腔充满淡黄色的清亮腹水,肝、肺和脾脏等器官被白色纤维素膜覆盖,因而怀疑耐过仔猪可能有细菌继发感染,送湖南农业大学兽医微生物实验室进行细菌学诊断。采取发病仔猪肝脏样品进行检查,结果分离出一株兼性厌氧芽孢杆菌,经过细菌学和分子生物学鉴定,以及动物致病性试验,确定为一株新的致病性蜡样芽孢杆菌。现将结果报道如下。
1 材料与方法
1.1 细菌的分离
从湖南怀化某爆发哺乳仔猪腹泻的猪场无菌采集一例断奶2周的腹泻耐过仔猪的肝脏组织,分别接种到 GAM肉汤培养基(青岛海博生物技术有限公司),5%血清肉汤培养基、鲜血琼脂培养基和巧克力琼脂培养基[5–6],于37 ℃同时进行需氧和厌氧培养48 h,结果仅从GAM肉汤培养基中分离到芽孢杆菌。对分离菌用以上4种培养基进行需氧及厌氧培养,以进一步分离纯化细菌及革兰氏染色镜检[5–6]。在显微镜下观察细菌的运动性,具体方法为:取生长24 h菌悬液滴于载玻片,加盖玻片后进行观察。
1.2 引 物
检测细菌16S rDNA,溶血型肠毒素基因(hbl)、非溶血型肠毒素基因(nhe)、肠毒素 FM 基因(entFM)、细胞毒素 K基因(cytK)的引物见表 1。7个看家基因(glpF,gmk,ilvD,pta,pur,pycA,tpi)的多位点序列分型(MLST)检测引物见网址 http:// pubmlst.org/bcereus。以上引物均由上海生工生物工程技术服务有限公司合成。

表1 16SrDNA及毒素基因PCR扩增引物Table 1 Primers used for amplifying 16SrDNA and toxigenic genes
1.3 16S rDNA的检测
提取分离到的芽孢杆菌第一代细菌纯培养物的DNA[9],作为模板,用引物对8F和1542R进行PCR扩增。扩增产物送上海生工生物工程技术服务有限公司进行测序。测序结果提交GenBank,并与其他芽孢杆菌成员进行比对,确定16S基因型[7]。
1.4 生化鉴定
按传统细菌鉴定方法[5–6],将获得的分离菌株接种各种糖发酵培养基进行糖发酵试验,同时进行吲哚试验、甲基红试验、VP试验、触酶试验、硫化氢试验,观察生化反应特性。
1.5 药敏试验
采用药敏纸片(杭州微生物试剂有限公司)法检测分离菌株的药物敏感性。
1.6 伴孢晶体蛋白检测
将分离菌在普通琼脂培养基[5–6]上 37 ℃培养72 h,待芽孢形成后,用考马斯亮蓝染色,在普通显微镜下检测是否有伴孢晶体蛋白。
1.7 MLST分析
按照 1.3的方法制备分离菌株的 DNA。用MLST引物进行PCR检测。PCR产物送上海生工生物工程技术服务有限公司进行测序。测序结果与数据库(http://pubmlst.org/bcereus)相应基因比对,确定基因型。如果有新的等位基因则向该网站提供原始测序数据,由网站指定分离菌的基因型。
1.8 毒素基因的PCR检测
按照1.3的方法制备分离菌株的DNA。用毒素基因的特异性引物(表1)进行PCR扩增。扩增产物用1%琼脂糖凝胶电泳检测DNA片段长度。
1.9 动物试验
将分离菌接种在GAM肉汤培养基,37 ℃摇床培养18 h,应用平板活菌计数法和湿重法相结合计数。致病性试验选用4周龄雌性健康昆明小白鼠(购自湖南斯莱克景达实验动物有限公司),设3个组:对照组、正常试验组和抑制组。对照组8只小鼠,正常试验组和抑制组均分6个小组,每个小组8只小鼠。对照组的小鼠腹腔注射生理盐水,0.2 mL/只;正常试验组6组小鼠分别腹腔注射104、105、106、107、108、109CFU/mL的蜡样芽孢杆菌,0.2 mL/只;抑制组小鼠的注射方式同正常试验组,抑制组小鼠在细菌接种前4 d腹腔注射环磷酰胺(0.25 g/kg)以降低机体免疫能力。接种后每天观察记录小白鼠发病死亡情况,并于接种后第7天捕杀4只未死亡小鼠,第 15天捕杀未死亡全部小鼠,用心血和肝脏接种普通肉汤和普通琼脂培养基,37 ℃培养后进行细菌革兰氏染色镜检。
2 结果与分析
2.1 细菌培养特征
在无菌采集的肝脏样品所接种的 4种培养基中,只有GAM肉汤厌氧条件培养48 h时有细菌生长,该菌的继代培养能够适应有氧条件,并在 5%血清肉汤培养基、鲜血琼脂培养基和巧克力琼脂培养基生长良好(图1–A),37 ℃培养8 h,即可形成圆形光滑菌落,24 h形成5~8 mm边沿不整齐的大型菌落,细菌水浸片在显微镜下可见细菌活跃运动;在鲜血琼脂培养基上呈明显β型溶血;培养特性初步表明分离菌株为蜡样芽孢杆菌群细菌,命名为HN1203。革兰氏染色呈阳性,可形成芽孢(图1–B)。
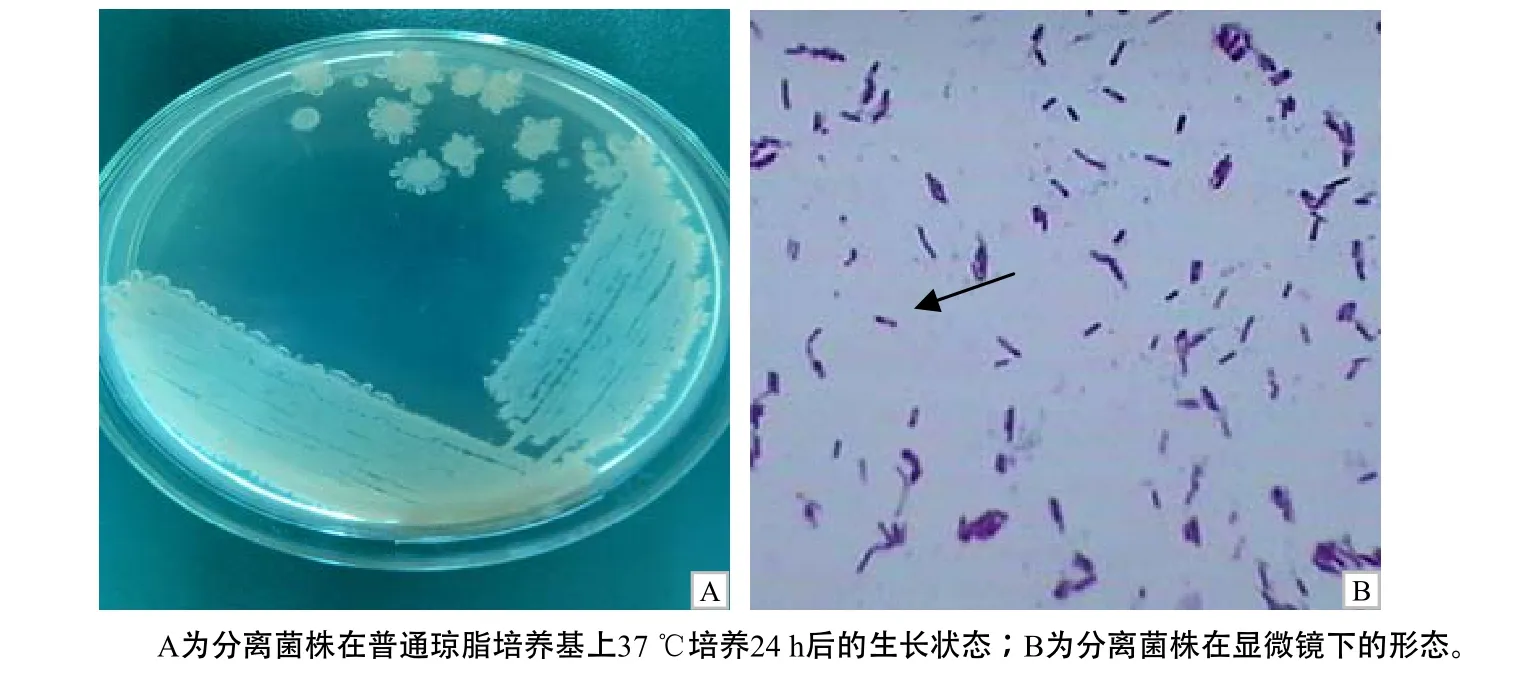
图1 分离菌株的生长状态和在显微镜下的形态Fig. 1 Growth state of the isolated strain and its morphology under microscope
2.2 细菌16SrDNA分析
蜡样芽孢杆菌群成员有13个基因型[7],根据16SrDNA序列差异性分析,确定 HN1203菌株16SrDNA序列(GenBank登录号为 JX294967)为蜡样芽孢杆菌群第7基因型。这一基因型同时包含蜡样芽孢杆菌和炭疽杆菌(好氧菌,对青霉素敏感)的菌株。苏云金杆菌另包含于基因型3和11。初步确定该分离菌株为蜡样芽孢杆菌或炭疽杆菌。
2.3 生化特性
生化试验发现,HN1203菌株能发酵葡萄糖、蔗糖和麦芽糖,不发酵乳糖、木糖、甘露醇和果胶糖。过氧化氢酶试验、甲基红试验(M.R.)和乙酰甲基甲醇试验(V–P)为阳性,吲哚试验和硫化氢试验为阴性。分离菌的这些生化特性符合蜡样芽孢杆菌
群成员的特征。
2.4 药敏试验结果
药敏试验结果显示,HN1203菌株对链霉素和四环素敏感,对青霉素不敏感,再加上兼性厌氧的特点,表明该菌为蜡样芽孢杆菌,排除了该菌为炭疽杆菌的可能性。
2.5 伴孢晶体检测结果
伴孢晶体检测结果显示,HN1203在形成芽孢后不形成伴孢晶体,进一步证明该菌为蜡样芽孢杆菌,而非苏云金杆菌。
2.6 MLST分析
MLST分析显示,分离菌7个看家基因中有6个为已有等位基因,其中pta为新的等位基因,提交测序原始数据后被指定为pta153。分离菌株被指定为基因型ST611(http://pubmlst.org/bcereus),确定HN1203菌株为蜡样芽孢杆菌新菌株。利用该网站提供的工具绘制基因型进化树(图2)。结果显示分离菌与引起人严重肠道疾病的蜡样芽孢杆菌致病性菌株ST91、ST140和ST141[10]具有高度同源性。
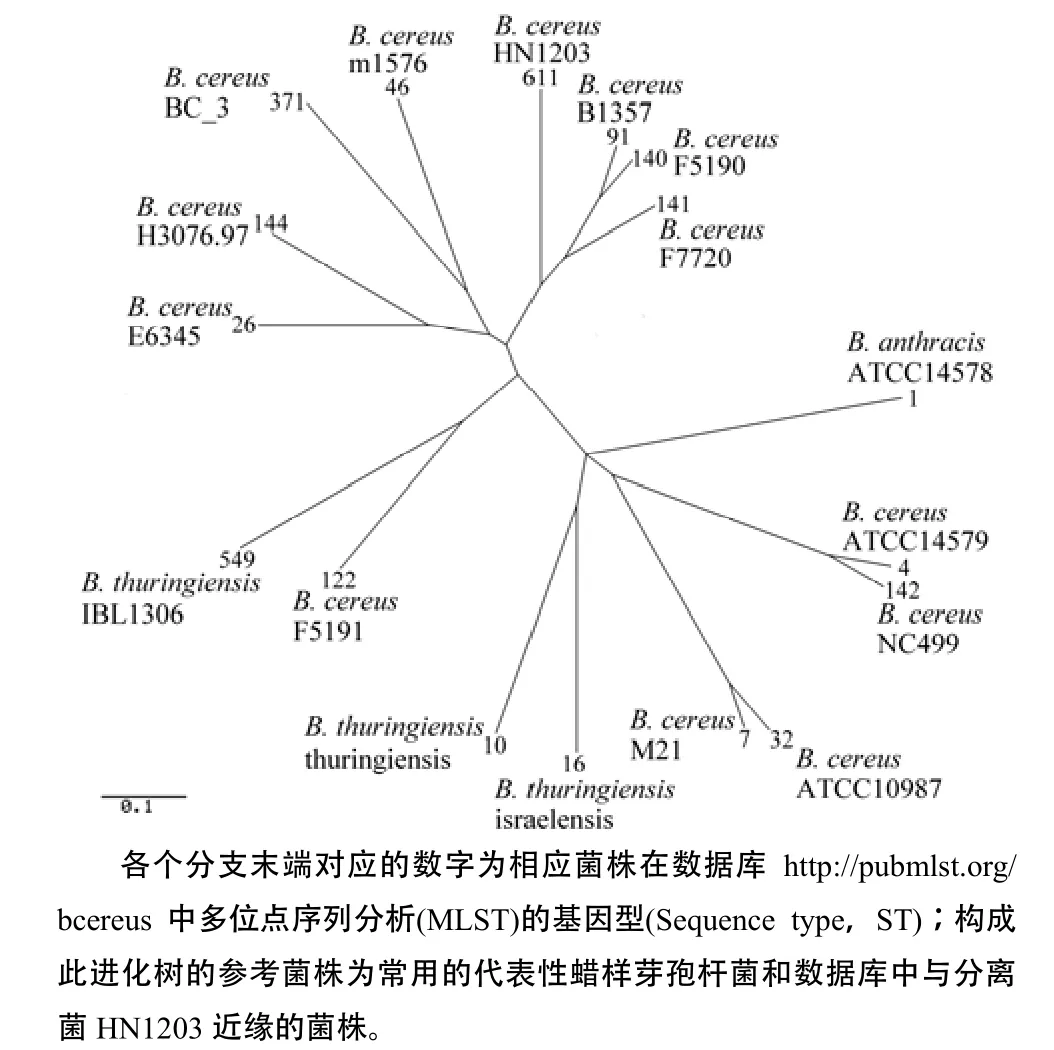
图2 菌株HN1203与其他蜡样芽孢杆菌的进化树Fig.2 Phylogenetic tr ee of B. c ereus HN1203 an d ot her Bacillus spp.
2.7 毒素基因的PCR检测结果
与蜡样芽孢杆菌致病性相关的毒素中,溶血性肠毒素(HBL)和非溶血性肠毒素(NHE)都是由 3个亚基构成的复合蛋白,肠毒素(entFM)和细胞毒素K(cytK)为单体蛋白。Ngamwongsatit等[8]用PCR检测了612株细菌,他们设计的引物能够同时检测到编码这些毒素的基因hblC、D、A,nheA、B、C、entFM和cytK。但是,本研究引用该方法不能检测到HN1203的毒素亚基基因hblD 和 nheA,而这2个亚基可以用另一发表的 hblD、nheA[9](表 1)检测得到(图3),说明HN1203菌株的肠毒素是由不同等位基因编码的亚基经过特异性重组而成。

图3 分离菌HN1203毒素基因的PCR产物的电泳结果Fig. 3 Electrophoresis of PCR products of virulence genes in B. cereus HN1203
2.8 动物试验结果
对照组的小白鼠在试验期内一直未发病,并且心血和肝组织均检测不到细菌。抑制组和正常试验组的小白鼠的菌检结果及死亡情况见表 2。腹腔注射107~109CFU/mL 蜡样芽孢杆菌HN1203的抑制组小白鼠全部在36 h内出现腹泻,随后全部死亡;腹腔注射104~106CFU/mL HN1203的抑制组小白鼠在试验期内没有死亡。正常试验组小白鼠中,只有腹腔注射109CFU/mL 蜡样芽孢杆菌HN1203的小白鼠在36 h内出现腹泻,随后死亡,其他注射剂量的小白鼠在试验期内没有死亡。第7天捕杀抑制组和正常试验组的小白鼠各4只,从心血及肝脏内分离到蜡样芽孢杆菌,显示该细菌在动物体内呈败血症感染,第15天捕杀各组剩余的4只小白鼠,只有注射105和104CFU/mL HN1203的正常试验组小白鼠的肝脏和心血中分离不到接种的细菌,而其他正常试验组和抑制组的小白鼠均能分离到接种菌。注射环磷酰胺时,各组小鼠平均体重为18.5 g/只,4 d后接种细菌时,抑制组平均体重没有明显增加,平均体重为18.6 g/只,其他各组平均体重已经达到20 g/只。通过动物试验,说明蜡样芽孢杆菌HN1203具有致病性,且对免疫机能损伤的动物有更强的感染性,提示流行性腹泻耐过仔猪,因免疫能力下降,继发感染了蜡样芽孢杆菌。
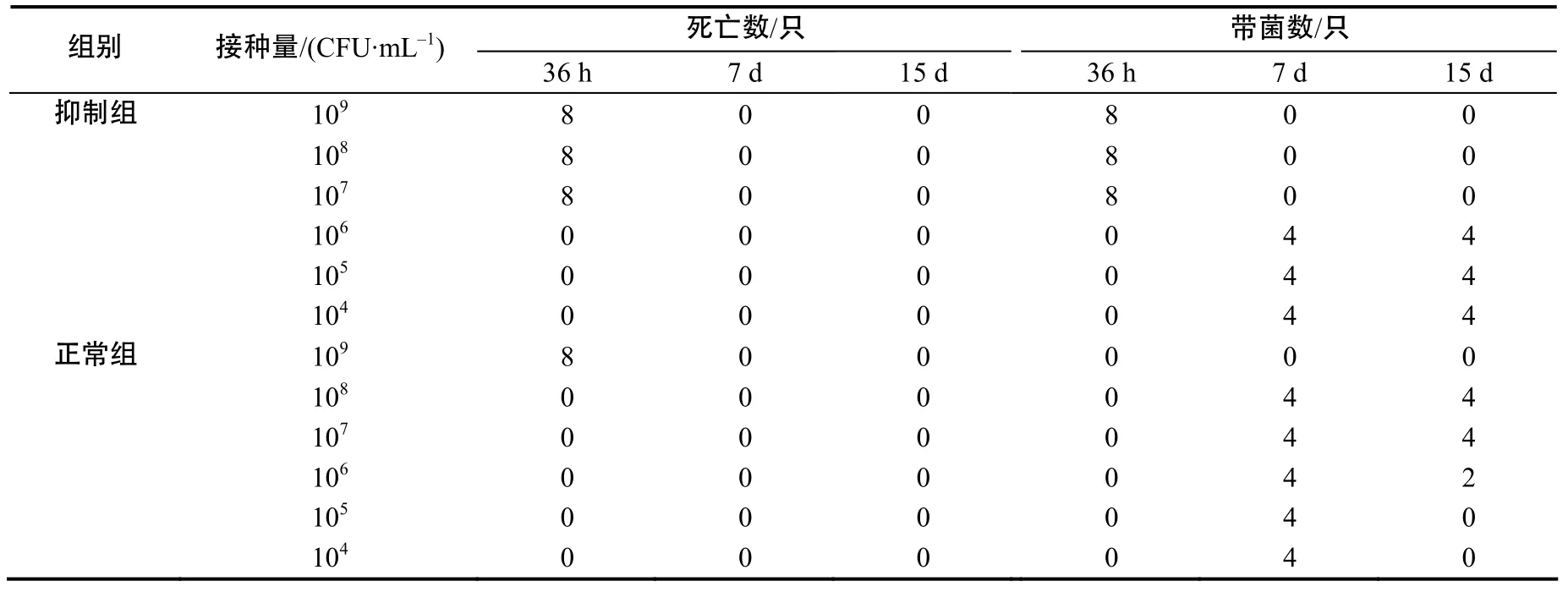
表2 小白鼠腹腔接种蜡样芽胞杆菌HN1203检测结果Table 2 Results of mice inoculation test with Bacillus cereus HN1203
3 讨 论
a. 通过常规细菌学方法和分子生物学方法的检测,本研究从仔猪流行性腹泻耐过仔猪肝脏分离到一株新的蜡样芽孢杆菌,命名为HN1203。
b. 用病猪肝脏样品进行细菌分离培养时,除GAM 厌氧肉汤以外,其他培养基未见该菌生长,而分离菌继代培养时该菌对有氧条件的适应表明该菌具有兼性厌氧特征,同时也说明从流行性腹泻耐过病猪实质器官分离培养蜡样芽孢杆菌时,不宜采用常用的有氧条件,这也可能是一直未见猪感染蜡样芽孢杆菌的报道的原因之一。从HN1203体外第一代GAM厌氧肉汤培养物提取的DNA能够作为PCR模板,用来检测16SrDNA序列和进行MLST分析,说明肝脏样品不经分离培养即可获得该菌的纯培养物。另外,由于该菌具有潜在的病原性,可能是本例流行性腹泻耐过病猪生长不良和消瘦的重要原因。HN1203与人病原性菌株[11]高度同源,含有多种毒素基因,以及能够致死试验动物,均证实了该分离菌株的病原性的存在。
c.猪源性蜡样芽孢杆菌致病菌株 HN1203的分离鉴定,提示人们应该重视猪源致病性蜡样芽孢杆菌的潜在危害,加强蜡样芽孢杆菌用作益生菌时的安全性检测,以及有必要进行猪群中病原性蜡样芽孢杆菌的流行病学调查和猪肉相关食品卫生检测。
[1] 周帼萍,袁志明.蜡样芽孢杆菌污染及其对食品安全的影响[J].食品科学,2007,28(3):357–361.
[2] Rasko D A,Altherr M R,Han C S,et al.Genomics of the Bacillus cereus group of organisms[J].FEMS Microbiology Review,2005,29(2):303–329.
[3] Ozawa K.Sepsis and meningoencephalitis caused by Bacillus cereus in a patient with myelodysplastic syndrome[J].Internal Medicine,2013,52:1987–1990.
[4] 魏建功,王梅岩,蔡妙英,等.蜡样芽孢杆菌对骆驼的致病性研究[J].中国兽医杂志,1990,16(4):10–11.
[5] Lanyi B.Classical and rapid identification methods for medically important bacteria[J].Methods in Microbiology, 1988,19(1):1–67.
[6] 曾晓希,周洪波,刘飞飞,等.一株胶质芽孢杆菌的筛选和鉴定[J].湖南农业大学学报:自然科学版,2006,32(3):246–247.
[7] Sacchi C T,Whitney A M,Mayer L W,et al.Sequencing of 16S rRNA gene:A rapid tool for identification of Bacillus anthracis[J].Emerging Infectious Diseases,2002,8(10):1117–1123.
[8] Ngamwongsatit P,Buasri W,Pianariyanon P,et al.Broad distribution of enterotoxin genes (hblCDA,nheABC,cytK,and entFM) among Bacillus thuringiensis and Bacillus cereus as shown by novel primers[J]. International Journal of Food Microbiology,2008,121(3):352–356.
[9] Hansen B M,Hendriksen N B.Detection of enterotoxic Bacillus cereus and Bacillus thuringiensis strains by PCR analysis[J].Applied and Environmental Microbiology,2001,67(1):185–189.
[10] Hoffmaster A R,Novak R T,Marston C K,et al.Genetic diversity of clinical isolates of Bacillus cereus using multilocus sequence typing[J].BMC Microbiology,2008,8(6):191–200.
[11] Han C S,Xie G,Challacombe J F,et al.Pathogenomic sequence analysis of Bacillus cereus and Bacillus thuringiensis isolates closely related to Bacillus anthracis[J].Journal of Bacteriology,2006,188(9):3382–3390.
责任编辑:罗 维
英文编辑:罗 维
Isolation and characterization of a pathogenic Bacillus cereus from a piglet with diarrhea
ZHAO Zhen-yu1a,DAI Rong-si1a,LIU Dong-you2,DENG Zhi-bang1b,LI Run-cheng1b,YIN Chong1b*
(1.a.College of Animal Science and Technology; b.College of Veterinary Medicine, Hunan Agricultural University, Changsha 410128, China; 2.Royal College of Pathologists of Australasia Quality Assurance Programs, New South Wales 2052, Australia)
Through aerobic and anaerobic cultivation, pure culture of a bacterial strain named HN1203 suspected to be Bacillus cereus (B. cereus) was isolated from liver sample of a piglet recovered from severe post-wean diarrhea syndrome. Analyzing of 16S rRNA sequence (GenBank accession number JX294967) of HN1203 showed this strain belongs to type 7 of Bacillus cereus group. Biochemical identification indicated biochemical characteristics of HN1203 are accord with that of the strains of B. cereus group. Drug susceptibility testing and parasporal crystal protein test showed that this strain was sensitive to tetracycline and streptomycin, resistant to penicillin, and no parasporal crystal was formed on the spore of HN1203. Multilocus sequence typing (MLST) assays revealed a new allele of house-keeping gene pta, which was assigned a new sequence type (ST) of 611. PCR detection showed HN1203 harbors virulence-coding genes hblCDA, nheABC, cytK and entFM. These results showed HN1203 is a now B. cereus strain, and isolation of which indicated that normally used aerobic condition is not suitable for isolation of B. cereus. Further animal test showed HN1203 could be fatal to mice. These findings highlight the need of increased awareness of pathogenic B. cereus in pig and its zoonotic potential.
piglet; Bacillus cereus; epidemic diarrhea; isolation; characterization
10.13331/j.cnki.jhau.2014.03.017
S852.61+6
A
1007−1032(2014)03−0311−05
2014–02–13
国家自然科学基金项目(C050103);湖南农业大学人才科学基金项目(07WD05;09WD06)
赵振宇(1989—),女,湖南澧县人,硕士研究生,主要从事水产动物医学研究,460593498@qq.com;*通信作者,chongy@ hunau.edu.cn
投稿网址:http://www.hunau.net/qks

