启动子对木糖异构酶基因在谷氨酸棒杆菌中表达的影响*
杨 柳,许敬亮,陈小燕,袁振宏
(1. 中国科学院广州能源研究所,广州 510640;2. 中国科学院大学,北京 100049)
启动子对木糖异构酶基因在谷氨酸棒杆菌中表达的影响*
杨 柳1,2,许敬亮1†,陈小燕1,袁振宏1
(1. 中国科学院广州能源研究所,广州 510640;2. 中国科学院大学,北京 100049)
以大肠杆菌的强启动子Ptrc和谷氨酸棒杆菌ATCC 13032的内源强启动子Pgro作为大肠杆菌的木糖异构酶基因xylA在谷氨酸棒杆菌中表达的转录起始元件,通过实验表明谷氨酸棒杆菌自身的强启动子Pgro能有效促使外源基因xylA在谷氨酸棒杆菌ATCC 13032中的表达,同时,核糖体结合位点RBS序列的优化对目的基因的表达水平有一定的影响。
谷氨酸棒杆菌;木糖异构酶基因;穿梭表达载体;启动子;核糖体结合位点
0 引 言
利用廉价、储量丰富的木质纤维素类生物质生产液体燃料,对于解决当前能源危机和环境问题具有重大意义。木质纤维原料经预处理和水解后可产生大量的葡萄糖和木糖[1,2],其中木糖比例最高可达20%,然而自然界中的微生物大多不能以木糖作为发酵底物,这一问题已成为发展木质纤维原料生物炼制的主要瓶颈[3,4]。谷氨酸棒杆菌(Corynebacterium glutamicum,C. g)是当前氨基酸和核酸工业生产的主要菌株,由于其细胞壁较厚,对木质纤维原料预处理过程中产生的抑制物具有良好的耐受性,但目前分离出的谷氨酸棒杆菌都由于缺失木糖异构酶的编码基因xylA而不能代谢木糖[1,5]。此外,由于谷氨酸棒杆菌与大肠杆菌等革兰氏阴性菌在基因表达、调控机制上存在差异,往往会导致来自革兰氏阴性菌的外源基因在谷氨酸棒杆菌中表达量低甚至不表达[6,7]。
近年来,随着基因工程技术的不断发展和完善,国内外科研工作者已成功构建了一系列谷氨酸棒杆菌工程菌,建立了高效的异源DNA转化谷氨酸棒杆菌方法,并通过DNA重组技术实现了谷氨酸棒杆菌代谢途径的定向改造。研究表明,克隆来自宿主菌本身的强启动子,是构建高效表达载体的关键。谷氨酸棒杆菌 ATCC 13032groES基因(Gene ID:1018601)的启动子Pgro是一个内源强启动子,能有效启动异源基因在谷氨酸棒杆菌中的转录[8-10],拟通过 SOE PCR技术(Gene Splicing by Overlap Extension)[11],研究启动子Pgro和groES基因上游的核糖体结合位点(Ribosome binding sites, RBS)对木糖异构酶基因xylA在谷氨酸棒杆菌中表达的影响。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
实验中用到的菌株、质粒及其相关特性见表1。

表1 本实验所用的菌株及质粒Table 1 Bacterial strains and plasmids used in this study
1.1.2 培养基
大肠杆菌LB培养基组分浓度(W/V):1%胰蛋白胨,0.5%酵母提取物,1% NaCl;谷氨酸棒杆菌LBG培养基为添加了0.5% glucose的LB培养基。谷氨酸棒杆菌感受态的制备所用培养基的配制参照文献[7,12](固体培养基添加2.2%琼脂)。
1.1.3 酶及试剂
D-木酮糖、溶菌酶、三氯乙酸、X-gal、IPTG、卡那霉素、氨苄青霉素购自SIGMA;KOD-plus Taq DNA聚合酶购自Toyobo公司;Taq DNA Polymerase高温聚合酶以及其他PCR相关试剂购自上海生工生物工程有限公司;T4 DNA连接酶、限制性内切酶购自Fermentas公司;其余试剂均为国产或者进口分析纯或生化级。
1.2 方法
1.2.1 引物设计
本实验中使用的引物序列及其酶切位点设计见表 2。引物 F-3/R-6下划线处序列分别为NdeI和BamHI酶切位点;引物R-4斜体序列为与xylA基因5′ 端起始密码子附近的序列反向互补;引物 F-5斜体序列为与启动子Pgro3′ 端附近的序列相对应;引物F-7下划线处为替换的RBS序列;引物R-8下划线处序列与替换的RBS序列反向互补。
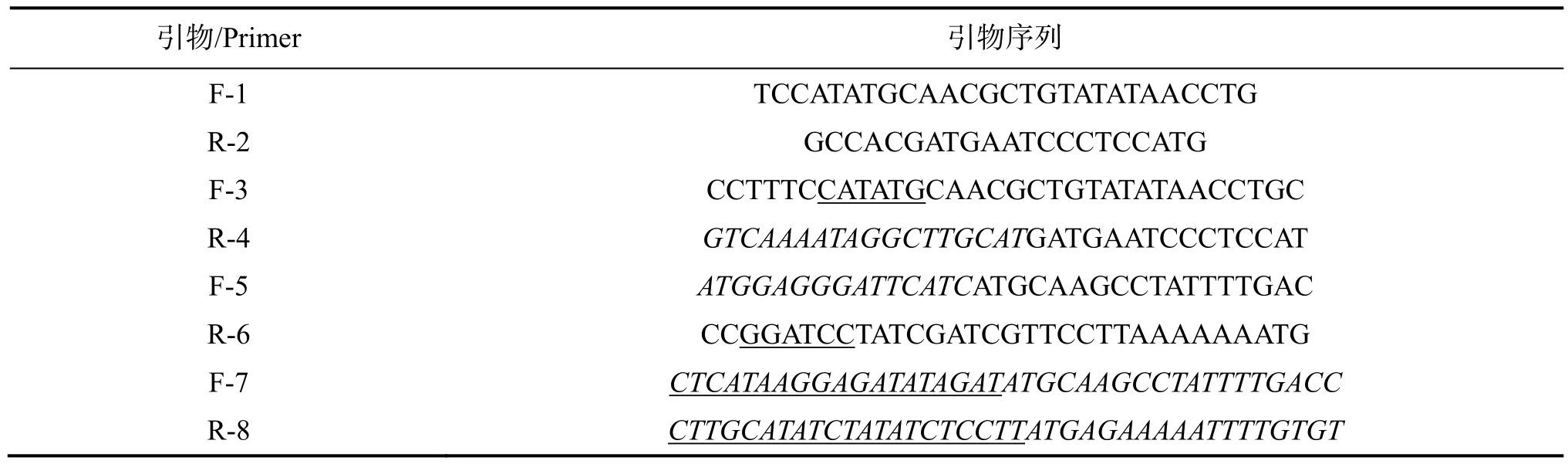
表2 本实验中的引物及其序列Table 2 Primers oligonucleotides used in this study
1.2.2 载体的构建
SOE PCR技术示意图如图1所示。
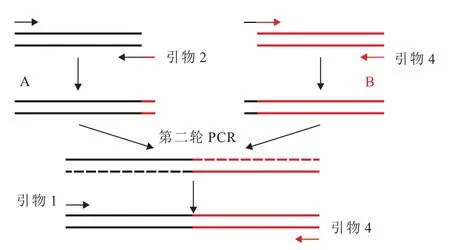
图1 SOE PCR技术示意图Fig. 1 SOE PCR technology
根据GeneBank中已报道的基因groES序列以谷氨酸棒杆菌的基因组为模板、F-1/R-2为引物扩增启动子Pgro,连接至复制质粒pEASY。然后分别以质粒 pEASY-Pgro为模板、F-3/R-4为引物扩增Pgro启动子片段,以质粒 pEASY-xylA为模板、F-5/R-6为引物扩增xylA基因,第二轮 PCR通过引物F-3/R-6完成基因Pgro-xylA的重组。
根据在谷氨酸棒杆菌中表达异源基因时使用的其他RBS序列的碱基长度以及碱基组成,结合原核表达载体的优化设计原则[13-15],将groES基因上游的 RBS序列 GGAGGGATTCATC 置换为AAGGAGATATAGAT。同理,分别使用引物对F-7/R-8和F-7/R-6扩增Pgro′片段和xylA′ 基因,所得PCR产物Pgro-xylA′。
最后利用限制性内切酶NdeI和BamHI消化穿梭载体pEC-XK99E和上述融合片段,通过T4 DNA连接酶连接,获得重组质粒 pEC-Pgro-xylA和pEC-Pgro-xylA′。
1.2.3 质粒转化及检测
将构建好的表达载体 pEC-Pgro-xylA、pECPgro-xylA′分别转化谷氨酸棒杆菌ATCC 13032,并以空载体pEC-XK99E(lacI-) 作为对照。谷氨酸棒杆菌ATCC 13032感受态细胞制备与转化参考文献[8,13]。以含卡那霉素终浓度为 50 μg/mL的平板为筛选条件,挑选转化子通过酶切和PCR验证是否为阳性。
1.2.4 木糖异构酶的表达与酶活测定
取过夜培养的菌液2 mL,在4℃下,5 000 × g离心5 min,收集菌体。重悬液转入1.5 mL EP管,置于冰水浴中进行超声破碎。超声处理时,将变幅杆(型号φ2)没于液面和管底中间,超声功率80 W,处理5 s间歇5 s直至重悬液变澄清,重复该过程5~10 min。将超声处理后的菌悬液在4℃下,20 000 × g离心30 min,收集上清液,转入干净离心管中,进行SDS-聚丙烯酰胺凝胶电泳。由于谷氨酸棒杆菌是革兰氏阳性菌,较难破壁,因此菌体用双蒸水洗涤2次后,加入1 mL溶菌酶液,37℃处理1 h后再进行超声波破碎。将上述获得的粗酶液通过半胱氨酸-咔唑法测定木糖异构酶(XI)活性[16,17]。木糖异构酶酶活单位定义为:在给定的实验条件下,每10 min催化产生 1 μmol D-木酮糖所需的酶量为一个酶活单位(即1 U)。
2 结果与分析
2.1 目的融合片段Pgro-xylA扩增
以谷氨酸棒杆菌基因组为模板,F-1/R-2为引物进行PCR扩增,用 1.2%的琼脂糖凝胶电泳检测有特异的单一条带(图2),大小与理论值(213 bp)接近,经测序比对基因序列正确。
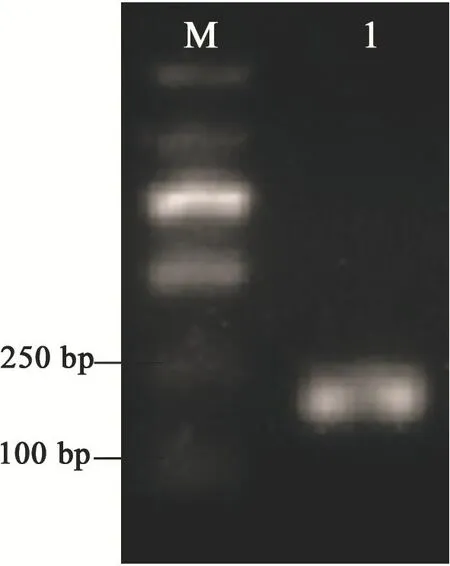
图2 启动子PgroPCR产物Fig. 2 PCR amplification ofPgro
分别以F-3/R-4和F-5/R-6引物对扩增Pgro启动子片段和xylA基因片段,以F-7/R-8和F-7/R-6引物对扩增Pgro′启动子片段和xylA′
基因片段,电泳检测有特异的单一条带(图3),并且各核酸片段大小与理论值接近,通过测序比对确认基因序列正确。
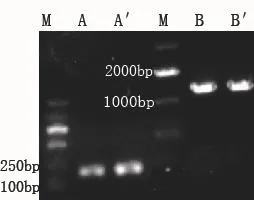
图3 SOE PCR第一轮产物Fig. 3 SOE PCR product in the first round
第二轮 PCR 以 F-3/R-6引物对完成基因Pgro-xylA和pEC-Pgro-xylA′的融合,由电泳结果可见约1 600 bp的目的条带(图4),与该基因的理论大小接近,测序结果显示基因融合成功。
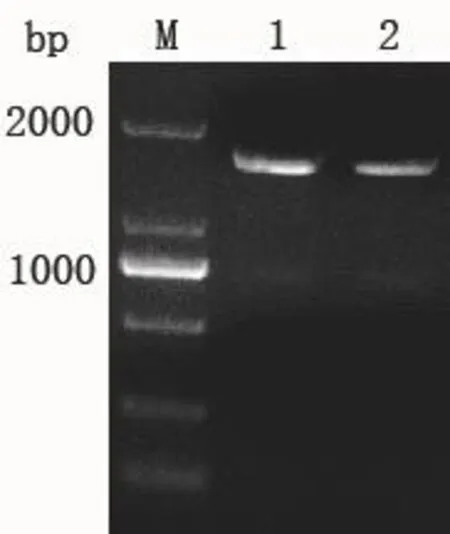
图4 SOE PCR第二轮产物Fig. 4 SOE PCR product in the second round
2.2 表达载体构建
重组质粒pEC-Pgro-xylA和pEC-Pgro-xylA′,转化大肠杆菌Trans-T1感受态细胞。将阳性转化子提质粒进行NdeI/BamHI小量双酶切验证,酶切产物理论大小为5 251 bp和1 600 bp。电泳结果如图5所示,确认表达载体pEC-Pgro-xylA和pEC-Pgro-xylA′构建成功。
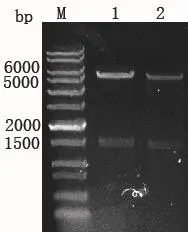
图5 酶切验证Fig. 5 Restriction digestion analysis
2.3 表达载体电转化谷氨酸棒杆菌
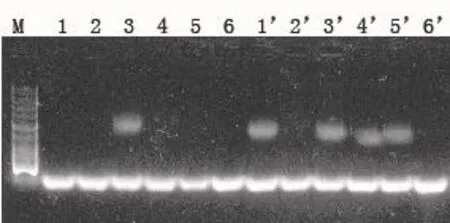
图6 谷氨酸棒杆菌ATCC 13032 PCR验证Fig. 6 Colony PCR verification forC.glutamicumATCC 13032
将表达载体pEC-Pgro-xylA、pEC-Pgro-xylA′分别转化谷氨酸棒杆菌ATCC 13032,转化结果通过菌落PCR验证,如图6所示,可初步判断pEC-Pgro-xylA(#3)、pEC-Pgro-xylA′ (#1′、#3′~5′)、pEC-XK99E(lacI-) (#9、#10)号为阳性转化子。
2.4 蛋白质电泳及酶活测定
选取谷氨酸棒杆菌 ATCC 13032阳性转化子pEC-Pgro-xylA-#3、 pEC-Pgro-xylA′-#4′和 pECXK99E(lacI-)-#9,进行XI酶活测定和蛋白质SDS-聚丙烯酰胺凝胶电泳。结果如表3和图7所示。在样品总蛋白含量基本一致的条件下,相较于转化空载体pEC-XK99E(lacI-) 粗酶液电泳结果,含有质粒pEC-Pgro-xylA和 pEC-Pgro-xylA′的粗蛋白液在44.3 KDa附近出现颜色加深的条带,与目标蛋白XylA大小一致。相应地,本实验只在转化了xylA基因表达载体的重组菌株中检测到木糖异构酶酶活,分别为0.182 U/mg和0.237 U/mg蛋白,这表明启动子Pgro能有效启动xylA基因在谷氨酸棒杆菌ATCC 13032中的表达,RBS序列的优化能有效地提高xylA基因的表达水平。
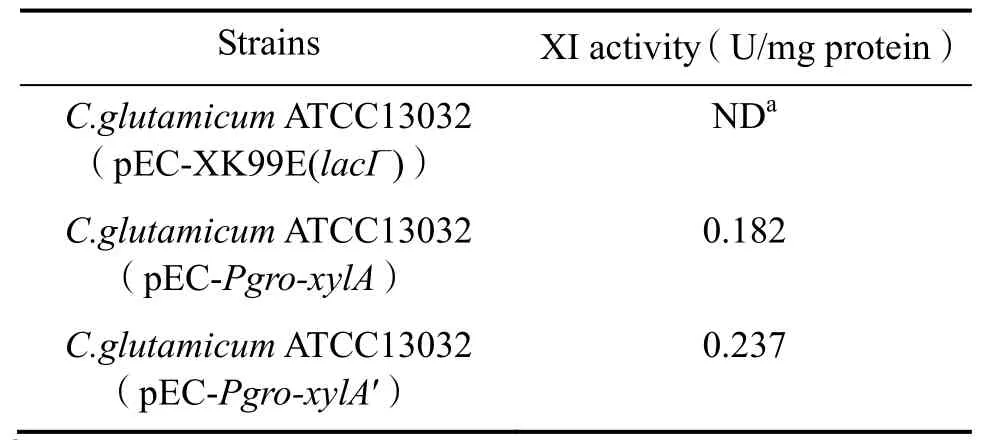
表3 谷氨酸棒杆菌ATCC 13032转化子XI酶活测定结果Table 3 XI activity ofCorynebacterium glutamicumATCC 13032 transformants
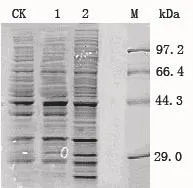
图7 谷氨酸棒杆菌ATCC 13032转化子胞内总蛋白SDS-PAGE图Fig. 7 SDS-PAGE of total intracellular proteins from
3 结 论
实验通过 SOE PCR技术,以谷氨酸棒杆菌ATCC 13032内源基因groES的启动子Pgro作为xylA基因的转录起始元件,构建了两个含不同核糖体结合位点序列的表达载体 pEC-Pgro-xylA和pEC-Pgro-xylA′,其中一个核糖体结合位点序列是基因groES自身的 RBS,另一个是谷氨酸棒杆菌ATCC 13032中另一高表达基因的核糖体结合位点序列。由实验结果可知,启动子和核糖体结合位点序列的改变对该异源基因在谷氨酸棒杆菌中的表达水平有一定影响。
当然,pEC-XK99E作为大肠杆菌-谷氨酸棒杆菌穿梭表达载体,它在这两种宿主细胞内的拷贝数不同,在谷氨酸棒杆菌中的拷贝数较低,对xylA基因的表达量也有一定影响[18]。除此之外,影响木聚糖异构酶基因表达的原因还包括重组基因的稳定性以及表达条件等。为此,接下来的研究可以从构建高拷贝质粒,将基因同源重组整合到谷氨酸棒杆菌ATCC 13032基因组以及优化表达条件几个方面进行。以此提高木糖异构酶基因在谷氨酸棒杆菌的表达,实现工程菌株对木质纤维原料水解液的高效转化利用。
[1] Kawaguchi H. Engineering of a xylose metabolic pathway inCorynebacterium glutamicum[J]. Applied and environmental microbiology, 2006, 72(5): 3418-3428.
[2] 顾方媛. 纤维素酶的研究进展与发展趋势[J]. 微生物学杂志, 2008, 28(1): 83-87.
[3] Jeffries T W. Utilization of xylose by bacteria, yeasts, and fungi[M]. Springer, 1983.
[4] Görke B, and Stülke J. Carbon catabolite repression in bacteria: many ways to make the most out of nutrients[J]. Nature Reviews Microbiology, 2008, 6(8): 613-624.
[5] Yukawa H. Comparative analysis of theCorynebacterium glutamicumgroup and complete genome sequence of strain R[J]. Microbiology, 2007, 153(4): 1042-1058.
[6] Gopinath V, Murali A, Dhar K S, et al.Corynebacterium glutamicumas a potent biocatalyst for the bioconversion of pentose sugars to value-added products[J]. Applied Microbiology and Biotechnology, 2011, 93(1): 95-106.
[7] Eggeling L, and Bott M. Handbook ofCorynebacterium
glutamicum[M]. CRC press, 2010.
[8] Schäfer A, Schwarzer A, Kalinowski J, et al. Cloning and characterization of a DNA region encoding a stress-sensitive restriction system fromCorynebacterium glutamicumATCC 13032 and analysis of its role in intergeneric conjugation withEscherichia coli[J]. Journal of bacteriology, 1994. 176(23): 7309-7319.
[9] Kröger B, Zelder O, Klopprogge C, et al. Pgro expression units[P]. US 2009/0246836 A1, 2009. 1-83.
[10] Pátek M, Nešvera J, Guyonvarch A, et al. Promoters ofCorynebacterium glutamicum[J]. Journal of biotechnology, 2003. 104(1): 311-323.
[11] Kawaguchi H, Vertès A A., Okino S, et al. Engineering of a xylose metabolic pathway inCorynebacterium glutamicum[J]. Applied and environmental microbiology, 2006, 72(5): 3418-3428.
[12] 余秉琦, 沈微, 诸葛健, 等. 适用于异源 DNA高效整合转化的谷氨酸棒杆菌电转化法[J]. 中国生物工程杂志, 2005, 25(2): 78-81.
[13] Kröger B, Zelder O, Klopprogge C, et al. PEF-TU expression units[P]. US 7785779 B2, 2010, 1-122.
[14] Xu D, Tan Y, Huan X, et al. Construction of a novel shuttle vector for use inBrevibacterium flavum,an industrial amino acid producer[J]. Journal of Microbiological Methods, 2010, 80(1): 86-92.
[15] Liu Q, Ouyang S P, Kim J, et al. The impact of PHB accumulation on l-glutamate production by recombinantCorynebacterium glutamicum[J]. Journal of biotechnology, 2007, 132(3): 273-279.
[16] Dische Z. Spectrophotometric method for the determination of free pentose and pentose in nucleotides[J]. Journal of Biological Chemistry, 1949, 181(1): 379-392.
[17] 周世宁, 李甘霖. 嗜热脂肪芽孢杆菌耐热木糖异构酶的特性[J]. 微生物学通报, 1998, 25(5): 271-274.
[18] Primrose S, Twyman R, Old B著. 基因操作原理(第六版)[M]. 瞿礼嘉, 顾红雅译. 北京: 高等教育出版社, 2003.
Effects of Promoter Modification on Xylose Isomerase Gene xylA Expression in Corynebacterium glutamicum
YANG Liu1,2, XU Jing-liang1, CHEN Xiao-yan1, YUAN Zhen-hong1
(1.Guangzhou Institute of Energy Conversion, Chinese Academy of Sciences, Guangzhou 510640, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China)
The exogenous genexylAfromE. coliMG1655 was expressed inCorynebacterium glutamicumATCC 13032 with the strong promoterPtrcofE. coliand the endogenous promoterPgroofCorynebacterium glutamicumas transcription start components separately. The experiment result shows thatPgrocan be effective in the starting expressionxylAinCorynebacterium glutamicumATCC 13032. In addition, the sequence of RBS also has an impact on the gene expression level.
Corynebacterium glutamicum; xylose isomerase gene; shuttle vector; promoter; ribosome binding site
TK6;Q503
A
10.3969/j.issn.2095-560X.2014.05.005
2095-560X(2014)05-0353-05
杨 柳(1989-),女,硕士研究生,主要从事生物质能方向研究。
许敬亮(1977-),男,研究员,博士,硕士生导师,主要从事纤维素生物醇和酶工程研究。
陈小燕(1981-),女,研究助理,硕士,主要从事生物化学与分子生物学研究。
袁振宏(1953-),男,博士,研究员,博士生导师,长期从事生物质能技术的研究、开发与管理工作。
2014-06-06
2014-06-23
国家自然科学基金(2117623和21211140237);国家高技术研究发展计划(863计划,2013AA065803);中科院院地合作项目和广州市科技攻关项目(2013J4300026)
† 通信作者:许敬亮,E-mail:xjl@ms.giec.ac.cn

