FKBP12和FKBP52在肝细胞癌中的表达及临床意义
李传伟 王雪迪 张 智 李东东 余国堂 徐 静
作者单位:530021 南宁 广西医科大学研究生学院;△广西医科大学第一附属医院肝胆外科
临床研究
FKBP12和FKBP52在肝细胞癌中的表达及临床意义
李传伟 王雪迪 张 智 李东东 余国堂 徐 静△
作者单位:530021 南宁 广西医科大学研究生学院;△广西医科大学第一附属医院肝胆外科
目的 分析FKBP12和FKBP52在肝细胞癌(hepatocellular carcinoma,HCC)组织中的表达,并探讨其与HCC临床病理因素的关系。方法 应用免疫组化SP法检测FKBP12和FKBP52在60例HCC组织、60例癌旁组织、10例肝血管瘤组织和10例正常肝组织中的表达水平,并结合临床病理因素分析其临床意义。结果 在HCC组织、癌旁组织、肝血管瘤组织和正常肝组织中FKBP12的阳性表达率分别为66.7%、30.0%、20.0%和40.0%,FKBP12在HCC组织中的表达明显高于癌旁组织、肝血管瘤组织和正常肝组织中的表达(P均<0.05)。在HCC组织、癌旁组织、肝血管瘤组织和正常肝组织中FKBP52的阳性表达率分别为63.3%、26.7%、40.0%和20.0%,FKBP52在HCC组织中的表达明显高于癌旁组织和正常肝组织中的表达(P均<0.05),与肝血管瘤组织中的表达比较差异无统计学意义(P>0.05)。FKBP12和KBP52在HCC组织中的表达比较差异无统计学意义(P>0.05)。FKBP12在HCC组织中的表达水平与患者年龄、性别、合并肝硬化和乙肝病毒感染无明显关系(P均>0.05),而与肿瘤直径、病理分级和血清中AFP的水平有关(P均<0.05)。FKBP52在HCC组织中的表达水平与患者年龄、性别、肿瘤直径、合并肝硬化和血清中AFP的水平无明显关系(P均>0.05),而与病理分级、乙肝病毒感染有关(P均<0.05)。结论 FKBP12和FKBP52的高表达与HCC的发生、发展密切相关。FKBP12可能参与HCC癌细胞的增殖以及分化过程,并且可能与HCC患者血清中AFP水平的升高有关;FKBP52可能参与HCC的分化过程,并且可能与乙肝病毒感染密切相关。
肝肿瘤;肝细胞癌;FKBP12;FKBP52;免疫组织化学
FKBP52和FKBP12同属于FK506结合蛋白的家族,具有肽基脯氨酰顺反异构,其分子酶(PPIase)活性量分别为52kD和12kD。FKBP52N端结构域(FKBP52-N,140个氨基酸)与FKBP12的序列同源性高达49%,可与FK506结合。FKBP12除了作为免疫抑制剂FK-506的受体参与免疫抑制功能之外,还具有顺式/反式肽脯氨酸异构酶(PPIase)活性、脱乙酰激酶(Deacetylase)活性[1]和伴侣样蛋白的重折叠活性[2],而且又可结合理阿诺碱(Ry)受体、三磷酸肌醇(IP3)受体和转化生长因子受体(transforming growth factor receptor,TGFR)等,因而具有Ca2+通道调节和细胞周期调节等重要的生理功能[3~5],这些FKBP12的生理作用对研究肿瘤血管形成的机制和肿瘤细胞的增殖过程提供了一个新的途径。Liu等[6]的研究表明,FKBP52在小鼠肝组织和人肝癌组织以及血清中高表达。目前国内外已有较多关于FKBP12和FKBP52在肿瘤组织中的表达及其相关研究的报道[7,8],但在原发性肝癌组织中的表达研究仍较为缺乏,因此本研究旨在观察和分析FKBP12和FKBP52在肝细胞癌(hepatocellular carcinoma,HCC)组织中的表达水平,并探讨其与HCC临床病理因素的关系。
1 资料与方法
1.1 一般资料
60例HCC组织标本均为2011年9~12月在广西医科大学第一附属医院行肝肿瘤切除术获得,取其癌组织及相应癌旁组织(距离癌组织边缘至少2 cm),所有病例均经术后病理检查证实为HCC。其中男性50例,女性10例,年龄29~73岁,中位年龄51岁。另收集10例肝血管瘤组织标本作为对照组,其中男性5例,女性5例。10例正常肝组织作为正常对照组。本研究所取的组织标本均经患者签署知情同意书,并通过广西医科大学第一附属医院医学伦理委员会批准。
1.2 研究方法
免疫组化采用链霉菌抗生物素蛋白-过氧化物酶连结法(SP法),兔抗人FKBP12抗体和兔抗人FKBP52抗体均购自美国BD公司,SABC免疫组化染色试剂盒和DAB显色试剂盒均购自武汉博士德生物工程有限公司。免疫组化染色的主要步骤:石蜡组织切片经脱蜡水化后,用0.01 mol/L柠檬酸盐缓冲液高压修复抗原30 min,以山羊血清封闭20 min,FKBP12抗体和FKBP52抗体分别按1∶200和1∶400稀释后,4℃保存过夜,羊抗兔二抗37℃孵育1 h,DAB显色1 min,苏木素复染,透明,干燥,封片。以PBS缓冲液代替一抗作阴性对照,用已知的阳性切片作阳性对照。
1.3 结果判断
采用人工计数法,由3名研究生根据染色强度进行独立判定,细胞核和(或)细胞质出现黄色、棕黄色或棕褐色颗粒者为阳性细胞。阳性反应强度的分级兼顾染色深浅和阳性细胞所占百分比,根据判断标准[9],每张切片随机选取5个高倍视野(×400),每个视野数100个细胞,先按阳性细胞所占百分比评分:≤25%为1分,26%~50%为2分,51%~75%为3分,≥76%为4分;再按染色强度评分:不着色或者淡黄色为1分,棕黄色为2分,棕褐色为3分。最后将二者乘积数>3定为阳性。
1.4 统计学方法
采用SPSS 19.0统计软件进行相关数据分析和处理。计数资料的比较用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 免疫组化SP法检测FKBP12和FKBP52的表达
FKBP12在HCC组织中的表达以细胞质为主,呈棕黄色,阳性表达率为66.7%,在部分癌旁组织、肝血管瘤组织和正常肝组织中亦有少量表达,其阳性表达率分别为30.0%、20.0%和40.0%,应用统计学软件对FKBP12在HCC组织、癌旁组织、肝血管瘤组织和正常肝组织中的表达进行比较,结果显示FKBP12在HCC组织中的表达明显高于癌旁组织、肝血管瘤组织和正常肝组织中的表达,差异均具有统计学意义(P均<0.05)。见表1、图1。
FKBP52在HCC组织中的表达以细胞质为主,呈棕黄色,其阳性表达率为63.3%,在部分癌旁组织、肝血管瘤组织和正常组织中也有少量表达,其表达率分别为26.7%、40.0%和20.0%,应用统计学软件对FKBP52在HCC组织、癌旁组织、肝血管瘤组织和正常肝组织中的表达进行比较,结果显示FKBP52在HCC组织中的表达明显高于癌旁组织和正常肝组织中的表达,两组间的差异均有统计学意义(P均<0.05),FKBP52在HCC组织中的表达高于肝血管瘤组织的表达,两组间的差异无统计学意义(P>0.05)。见表1、图1。
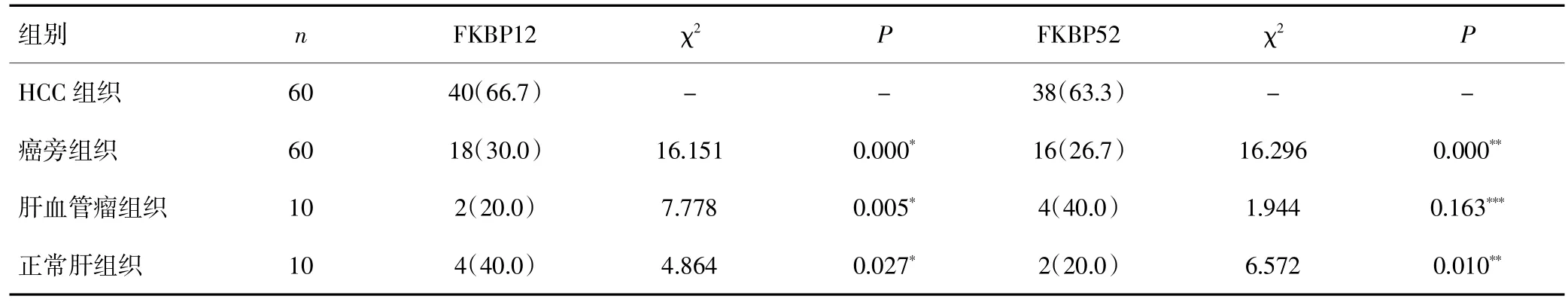
表1 FKBP12和FKBP52在HCC组织、癌旁组织、肝血管瘤组织和正常肝组织中的阳性表达情况[n(%)]
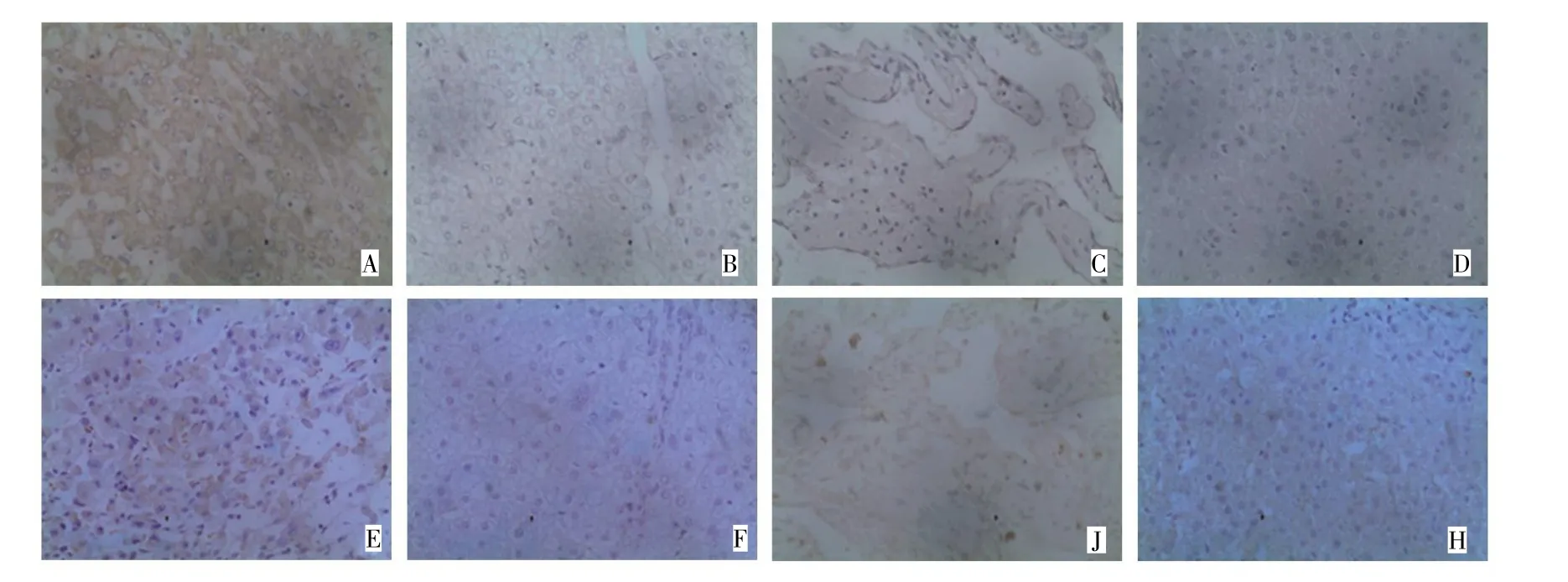
图1 免疫组化SP法检测FKBP12和FKBP52在HCC组织、癌旁组织、肝血管瘤组织和正常肝组织中的表达(SP×400)
2.2 FKBP12和FKBP52在HCC组织中表达的比较
FKBP12和FKBP52在HCC组织中均有较高的表达,FKBP12在HCC组织中的阳性表达率(66.7%)高于FKBP52在HCC组织中的阳性表达率(63.3%),两组比较差异无统计学意义(P>0.05)。见表2。

表2 FKBP12和FKBP52在HCC组织中的阳性表达比较[n(%)]
2.3 FKBP12和FKBP52在HCC组织中的阳性表达与临床病理因素的关系
FKBP12在HCC组织中的阳性表达水平与患者年龄、性别、合并肝硬化、乙肝病毒感染无明显关系(P均>0.05);而与肿瘤直径、病理分级、血清中AFP的水平有关(P均<0.05)。FKBP52在HCC组织中的阳性表达水平与患者年龄、性别、肿瘤直径、合并肝硬化、血清中AFP的水平无明显关系(P均>0.05);而与病理分级和乙肝病毒感染有密切关系(P均<0.05)。见表3。
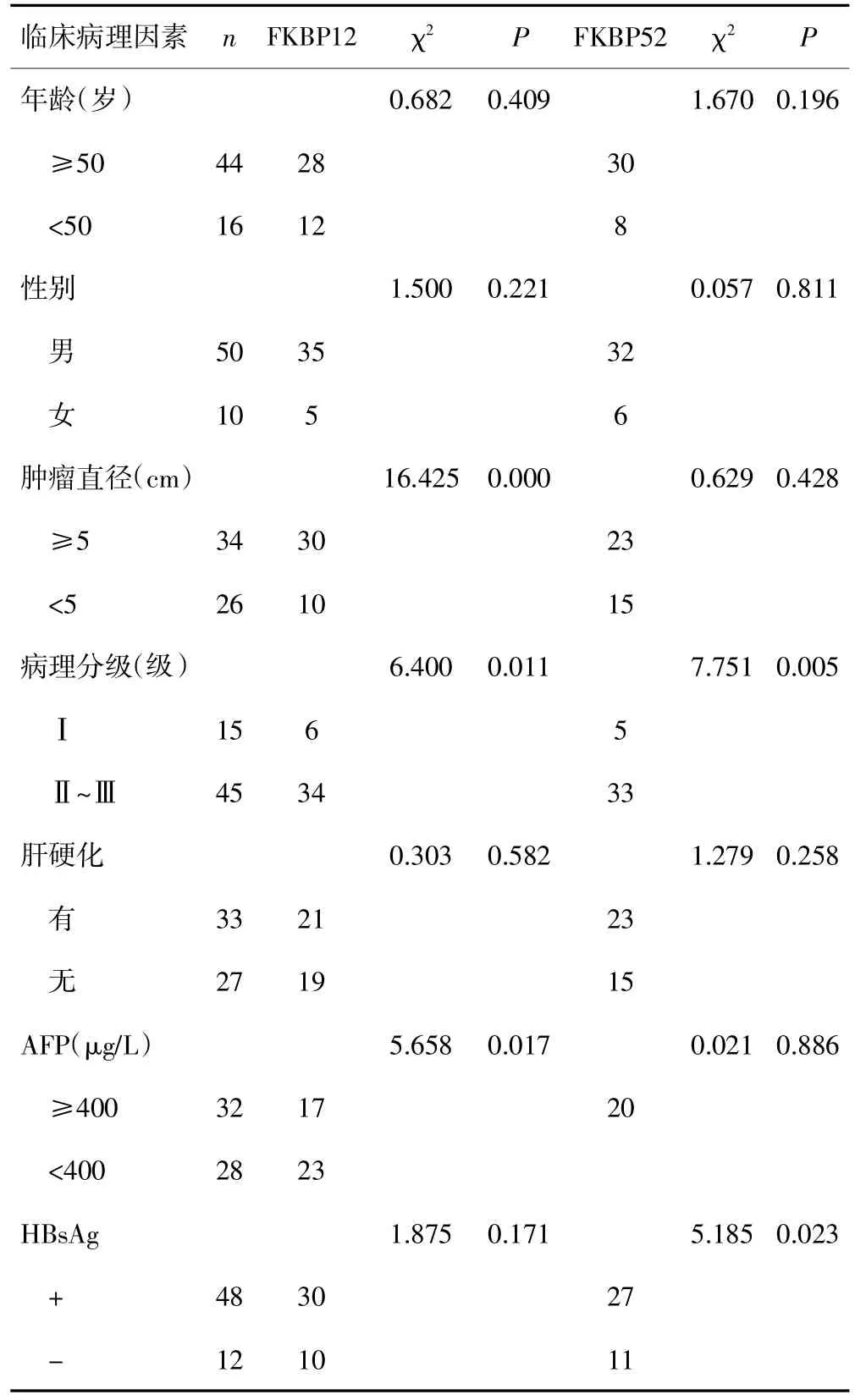
表3 FKBP12和FKBP52的阳性表达与患者临床病理因素的关系
3 讨论
HCC是世界上最常见的恶性肿瘤之一,其发病率和死亡率在所有癌症中分别占第5位和第2位。目前关于HCC的发病机制尚未确定,但其发病的主要危险因素包括患者年龄、性别、饮食、烟酒、乙型病毒性肝炎、肝硬化和血清中AFP水平及遗传易感因素等[10~12]。近年来随着医疗技术水平的提高,HCC患者的5年生存率已达50%~70%,目前HCC主要的治疗手段包括肝肿瘤切除术、肝介入治疗术、射频消融术以及肝移植等[13~15]。但是肝癌术后复发及转移率仍然维持在较高的水平,因此研究并探讨肝癌的发生、发展机制,并寻找新的肝癌治疗靶点仍然是一项艰巨而迫在眉睫的任务。
Shou等[16]研究发现FKBP12缺陷的小鼠细胞停滞在细胞周期G1期中,这些细胞能被转染的FKBP12激活。FKBP12可抑制由TGF-βR信号的过度活动引起的p21上调和细胞周期停滞。TGF-βR对基因表达的信号通过SMAD、p38和ERK/MAP激酶的途径介导。SMAD的信号传导在FKBP12缺陷细胞中下调。抑制ERK/MAP激酶不能导致p21上调。相反,在FKBP12缺陷细胞中氧化磷酸化的p38显著地增加,而且p21上调可被p38的抑制剂阻止。因此在正常情况下FKBP12通过下调TGF-βR信号传导调节细胞生理周期。Higgins等[17]应用CD31、CD34和FKBP12对59种血管瘤进行免疫组化和Western blot分析,结果显示,与CD31和CD34相比,FKBP12的相对敏感性为94.9%,特异性为96.5%,提示FKBP12在良恶性血管内皮中表达丰富,并认为FKBP12可作为血管或血管内皮细胞鉴定的另一标志物。肿瘤的增生和分化与肿瘤供血血管的增生和细胞周期有密切联系,鉴于FKBP12在细胞周期和血管增生中的生物学特性,提示其可能在肿瘤的增生方面发挥重要作用。
本研究通过免疫组化SP法检测FKPB12在HCC组织中的表达,结果显示,HCC组织中FKBP12的阳性表达率高于癌旁组织、肝血管瘤组织和正常肝组织,差异比较均具有统计学意义(P均<0.05),提示FKBP12可能参与HCC的发生,并且具有阳性表达的特异性,同时肿瘤直径大的HCC组织FKBP12的表达率高;高分化的HCC组织FKBP12的表达水平亦高,提示FKBP12参与肝癌细胞的增殖和分化,但具体机制有待进一步研究。血清中AFP水平的检测有助于早期肝癌的诊断,本研究结果显示血清中AFP水平高的HCC组织其FKBP12的表达水平也较高,提示FKBP12可能与血清中AFP水平的升高有关系,测定FKBP12的表达有助于HCC的诊断。
Kumar等[7]研究显示FKBP52在乳腺癌细胞中的表达高于正常乳腺组织,认为FKBP52与乳腺癌细胞的增殖密切相关。Lin等[8]研究证实FKBP52在前列腺癌组织中的表达高于前列腺增生组织,提示FKBP52与前列腺癌细胞的增殖有关。Liu等[6]的研究表明FKBP52在小鼠和人HCC组织和血清中高表达,认为FKBP52与肝癌细胞的增殖和分化有关。以上这些研究均表明FKBP52与肿瘤的发生、发展密切相关。本研究结果显示FKBP52在HCC中的表达明显高于癌旁组织和正常肝组织中的表达,两组差异有统计学意义(P均<0.05),从而进一步证实了FKBP52的这一生物学特性。同时本研究结果显示FKBP52的高表达与病理分级和乙肝病毒感染有关,高分化HCC组织其FKBP52的表达亦高,合并有乙肝感染的HCC患者,其癌组织FKBP52的表达水平高,提示FKBP52可能参与HCC的分化并且与乙肝病毒感染有关,但其具体机制有待进一步研究。
4 小结
FKBP12和FKBP52的高表达与HCC的发生、发展密切相关。FKBP12可能参与肿瘤细胞的增殖及分化过程;FKBP12的表达可能与HCC患者血清中AFP的水平升高有关系。FKBP52可能与HCC的分化有关,并且与乙肝病毒感染有密切关系。针对FKBP12和FKBP52在HCC中的表达及其与临床病理因素的关系,我们将采用蜂毒素等中药单体干预并探讨其对肝癌细胞株的影响,为中西医结合治疗HCC探索新的治疗途径。
[1] Zohlnhofer D,Klein CA,Richter T,et al.Gene expression profiling of human stent-induced neointima by cDNA array analysis of microscopic specimens retrieved by helix cutter atherectomy:Detection of FK506-binding protein 12 upregulation[J].Circulation,2001,103(10):1396-1402.
[2] Yano M,Ono K,Ohkusa T,et al.Altered stoichiometry of FKBP12.6 versus ryanodine receptor as a cause of abnormal Ca2+leak through ryanodine receptor in heart failure[J].Circulation,2000,102(17):2131-2136.
[3] Chaube R,Hess DT,Wang YJ,et al.Regulation of the skeletal muscle ryanodine receptor/Ca2+-release channel RyR1 by S-Palmitoylation[J].J Biol Chem,2014,289(12):8612-8619.
[4] MacMillan D.FK506 binding proteins:cellular regulators of intracellular Ca2+signalling[J].Eur J Pharmacol,2013,700(1-3):181-193.
[5] Doi M,Yano M,Kobayashi S,et al.Propranolol prevents the development of heart failure by restoring FKBP12.6-mediated stabilizati on of ryanodine receptor[J].Circulation,2002,105(11):1374-1379.
[6] Liu Y,Li C,Xing Z,et al.Proteomic mining in the dysplastic liver of WHV/c-myc mice-insights and indicators for early hepatocarcinogenesis[J].FEBS J,2010,277(19):4039-4053.
[7] Kumar P,Mark PJ,Ward BK,et al.Estradiol-regulated expression of the immunophilins cyclophilin 40 and FKBP52 in MCF-7 breast cancer cells[J].Biochem Biophys Res Commun,2001,284(1):219-225.
[8] Lin JF,Xu J,Tian HY,et al.Identification of candidate prostate cancer biomarkers in prostate needle biopsy specimens using proteomic analysis[J].Int J Cancer,2007,121(12):2596-2605.
[9] 于 萍,步 宏,王 华,等.免疫组化结果的图像分析与人工计数方法的对比研究[J].生物医学工程学杂志,2003,20(2):288-290.
[10]施纯朝,薛 峰,孙延富,等.乙型肝炎肝硬化并发原发性肝癌的危险因素[J].实用癌症杂志,2013,28(4):399-401.
[11]孙丽红.原发性肝癌饮食危险因素的流行病学研究[J].中国卫生统计,2010,27(3):269-270,277.
[12]齐鲁楠,彭 涛,苗志国,等.乙肝病毒/黄曲霉毒素双暴露因素下肝癌13号染色体畸变以及RB1基因表达的初步研究[J].中国癌症防治杂志,2012,4(4):307-311.
[13]Fan Qi,Wang X,Zhang H,et al.Silencing cathepsin S gene expression inhibits growth,invasion and angiogenesis of human hepatocellular carcinoma in vitro[J].Biochem Biophys Res Commun,2012,425(4):703-710.
[14]吴飞翔,王方为,马 良,等.原发性肝癌术后复发246例再治疗的近期疗效[J].中国癌症防治杂志,2012,4(2):167-170.
[15] Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[16] Shou W,Aghdasi B,Armstrong DL,et al.Cardiac defects and altered ryanodine receptor function in mice lacking FKBP12[J].Nature,1998,391(6666):489-492.
[17]Higgins JP,Montgomery K,Wang L,et al.Expression of FKBP12 in benign and malignant vascular endothelium:an immunohistochemical study on conventional sections and tissue microarrays[J].Am J Surg Pathol,2003,27(1):58-64.
[2014-03-16收稿][2014-04-30修回][编辑 阮萃才]
Expression and clinical significance of FKBP12 and FKBP52 in primary hepatocellular carcinoma
LI Chuan-wei,WANG Xue-di,ZHANG Zhi,LI Dong-dong,YU Guo-tang,XU-Jing△(Graduate School of Guangxi Medical University;△Department of Hepatobiliary Surgery,First Affiliated Hospital of Guangxi Medical University,Nanning 530021,P.R.China)
XU Jing.E-mail:jxuapr@aliyun.com
Liver neoplasm;Hepatocellular carcinoma;FKBP12;FKBP52;Immunohistochemistry
R735.7
A
1674-5671(2014)02-05
10.3969/j.issn.1674-5671.2014.02.08
国家自然科学基金资助项目(81360372);广西卫生厅中医药管理局科研基金资助项目(GZKZ10-114)【通信作者】徐 静。E-mail:jxuapr@aliyun.com
【Abstract】Objective To analyze the expression of FKBP12 and FKBP52 in hepatocellular carcinoma(HCC)and explore its relationship with clinicopathological factors.Methods Expression of FKBP12 and FKBP52 was measured in 60 samples of HCC tissue,60 samples of normal adjacent tissue,10 samples of hepatic hemangioma and 10 cases of normal liver tissue.Expression was analyzed using the immunohistochemical streptavidin-peroxidase method and correlated with clinicopathological factors.Results Expression of FKBP12 was detected in 66.7%of HCC samples,a rate significantly higher than the 30.0%of adjacent tissues,20.0%of liver hemangioma and 40.0%of normal liver tissues(P<0.05).The rate of FKBP52 expression was significantly higher in HCC tissues(63.3%)than in adjacent tissues(26.7%)and normal liver tissues(20.0%),but similar to the rate in liver hemangioma(40.0%).Rates of FKBP12 and FKBP52 expression were similar in HCC tissues.There was no significant relationship between FKBP12 expression in HCC tissue and patient age,gender,cirrhosis,or hepatitis B virus infection,but expression was related to tumor size,pathology grade,and serum AFP level.There was no significant relationship between FKBP52 expression in HCC tissue and age,gender,tumor size,cirrhosis,or serum AFP level(P>0.05),but expression was related to pathology grade and hepatitis B virus infection(P<0.05).Conclusion Expression of FKBP12 and FKBP52 correlate closely with incidence of HCC.FKBP12 may be involved in the proliferation and differentiation of tumor cells,and it may contribute to elevated serum AFP levels in liver cancer patients.FKBP52 may contribute to the differentiation of hepatocellular carcinoma and may participate in cellular processes in liver infected by hepatitis B virus.

