枣果主要酶活性与枣缩果病的关系研究
马俊青,宋宏伟,卢绍辉,袁国军,梅象信
枣果主要酶活性与枣缩果病的关系研究
马俊青,宋宏伟,卢绍辉,袁国军,梅象信
(河南省林业科学研究院,郑州 450008)
为揭示缩果病的发生对枣果和枣叶片中的MDA、PPO、CAT和PAL活性的影响,测试了发病与不发病的枣树中的叶与果中MDA、PPO、CAT和PAL活性,结果表明:MDA活性整体式呈上升趋势,病叶均大于健叶;在新郑灰枣枣果中,MDA活性呈下降趋势,而且病果均大于健果;在新郑灰枣中,病果和健果的PPO活性均是上升趋势,到完熟期达到高峰,且病果一直高于健果;在扁核酸中病果的PAL活性一直高于健果。
枣缩果病;酶活性;灰枣;扁核酸
枣缩果病,又称铁皮病,主要危害枣果,在果实白熟期发病,造成果肉变褐、味苦、提前落果,在河南新郑、濮阳等枣主产区,缩果病的病果率常达30%~80%,有的年份甚至绝收,缩果病已成为枣树生产上亟待解决的难题[1]。造成了巨大的经济损失,是我国各大枣区的主要病害之一。我国自正式报道枣缩果病以来,在病原、发生规律、病害防控等方面取得了一些成果,然而至今对其病因仍存争议(前后出现过9种真菌及2种细菌单独或者混合侵染),药剂防治效果一直不够理想。酶普遍存在于生物体内,是生物体内起催化作用的蛋白质。酶活力也称酶活性是指催化一定化学反应的能力。当植物受到侵害时,植物细胞中控制物质代谢的酶首先做出反应[2],试验采取发病前与发病后动态测试,分析MDA、PPO、CAT和PAL酶活与缩果病关系。其中PAL 和 PPO 是植物次生代谢过程的关键酶,与植物的抗病虫能力紧密相关。
本研究旨在通过对发病与不发病的枣树中的叶与果中MDA、PPO、CAT和PAL活性的测定,为揭示枣缩果病的发生原因提供一个有力的依据,早日解决枣树缩果病带来的危害。
1 材料与方法
1.1 试验材料
供试样品为新郑灰枣和濮阳扁核酸。
1.2 采样方法
①果实采样方法。于白熟期、脆熟期、完熟期3个时期各采样1次,共3次。采集病果和健果样品各15个果,分成3组,每组样品5个果。
②叶片采样方法。于花期、白熟期、脆熟期、完熟期4个时期各采样1次,共4次。在灰枣和扁核酸中各选取2011年发病严重树3株,每株树采叶样鲜样200 g,同时选取健康树3棵,每株树采叶样鲜样200 g。采样回去后,将病叶样制成3个混合样,健康叶样制成3个混合样。
1.3 实验方法
1.3.1丙二醛MDA活性测定[3]
1.3.1.1 酶液提取
称取样品0.5 g ,置研钵中,加 2~3 mL 4℃下预冷的 pH7.8 磷酸缓冲液和少量石英砂研磨成匀浆后,转入 25 mL 容量瓶中,并用缓冲液冲洗研钵数次,合并缓冲洗液,并定容到刻度。混合均匀,将容量瓶置 5℃冰箱中静置 l0 min ,取上部澄清液在 10 000 r/min 下离心 15 min ,上清液即为过氧化氢酶粗提液, 5℃下保存备用。
1.3.1.2 MDA的测定
取 l0 mL 试管,依次加入1 mL酶、2 mL0.6%的TBA,封口沸水浴15 min,迅速冷却后再离心,取上清液。在600、532、450 nm 三个波长下比色。
结果计算:
/(μmol/gfw)
=(6.45×(D532-D600)-0.56D450)×0.015/W或(6.45×(D532-D600)-0.56D450)×0.03/W
1.3.2多酚氧化酶PPO活性测定[3]
1.3.2.1 酶液提取
同MDA方法。
1.3.2.2 测定
在含有4 mL pH5.8的0.2M磷酸氢二钠-0.1M柠檬酸缓冲液试管中加入0.05 mL 0.05M邻苯二酚溶液,在30℃恒温水浴中预热后加入0.05 mL酶液,反应5 min,在分光光度计410 nm处读取吸光值。在上述条件下,以A410读数,以每分钟增加0.01 OD值定义为一个酶活性单位(U)。
1.3.3过氧化氢酶{CAT}活性测定[3]
1.3.3.1 酶液提取同MDA方法。
1.3.3.2 测定
取 l0 mL 试管,按照50μL酶液、3 mL pH7.8 磷酸缓冲液的顺序加入试剂,25℃预热后,逐管加入 0.3 mL 0.1 mol/L 的 H2O2,每加完 1 管立即计时,并迅速倒入石英比色杯中, 240 nm 下测定吸光度,每隔 l min 读数 1 次,共测 4 min ,待 3 支管全部测定完后,计算酶活性以 1 min 内 A 240 减少 0.1 的酶量为1个酶活单位(u)。
1.3.4苯丙氨酸解氨酶{PAL}活性测定[3]
1.3.4.1 酶的粗提液制备
将采回的样品每个样品各1 g(叶片剪碎,枣果去核切碎)。加入3 mL冷硼酸提取缓冲液(0.1M,pH8.8,1mL EDTA-Na2,1mL DTT)、少量石英砂及约0.1 g聚乙烯吡咯烷酮(PVP),迅速在冰浴上研磨成匀浆,转入离心管中,搅动20 min后, 4℃,10 000转/min,离心20 min,上清液即为酶粗提取液,- 4℃保存。
1.3.4.2 酶活测定
试管中加入0.6 mL硼酸缓冲液(0.05M,pH8.8)、0.1 mL 0.01ML-苯丙氨酸及0.3 mL酶粗提液混匀, 40℃水浴反应15 min后,于冰浴中终止反应,稀释5倍后,用惠普6010紫外线-可见分光光度计在290 nm处测吸光值,10 min后再测1次,以每小时使OD值变化0.01作为1个酶活力单位U,计算酶的比活性U/g。以0.3 mL硼酸提取缓冲液(0.1M,pH8.8,含1mL EDTA-Na2,1mL DTT)代替酶粗提液(其余同前试管)为空白对照。
2 结果与分析
从图1-8可以看出:MDA活性在灰枣和扁核酸中均为完熟期时病果大于健果;PPO活性在灰枣和扁核酸中,在花期就已出现病叶大于健叶,并且一直持续到枣果的完熟期,病果也是一直都高于健果;CAT活性在灰枣和扁核酸中均呈现枣叶在完熟期达到高峰期,脆熟期为低谷期,枣果是在白熟期病果大于健果;PAL活性在灰枣和扁核酸中枣果的生长时期就一直是病果大于健果,并且在脆熟期病果的PAL达到最高值,在完熟期时PAL活性降低。
从图1可以看出:在新郑灰枣枣叶中,MDA活性整体式呈上升趋势,病叶均大于健叶;在新郑灰枣枣果中,MDA活性呈下降趋势,而且病果均大于健果。
从图2可以看出:在濮阳扁核酸枣叶中,健叶的MDA活性整体呈下降趋势,而病叶在脆熟期后呈上升趋势;在新郑灰枣枣果中,健果和病果MDA活性均为先上升到脆熟期达到最高值后又下降趋势,并且在完熟期时,病果和病叶均高于健康的。
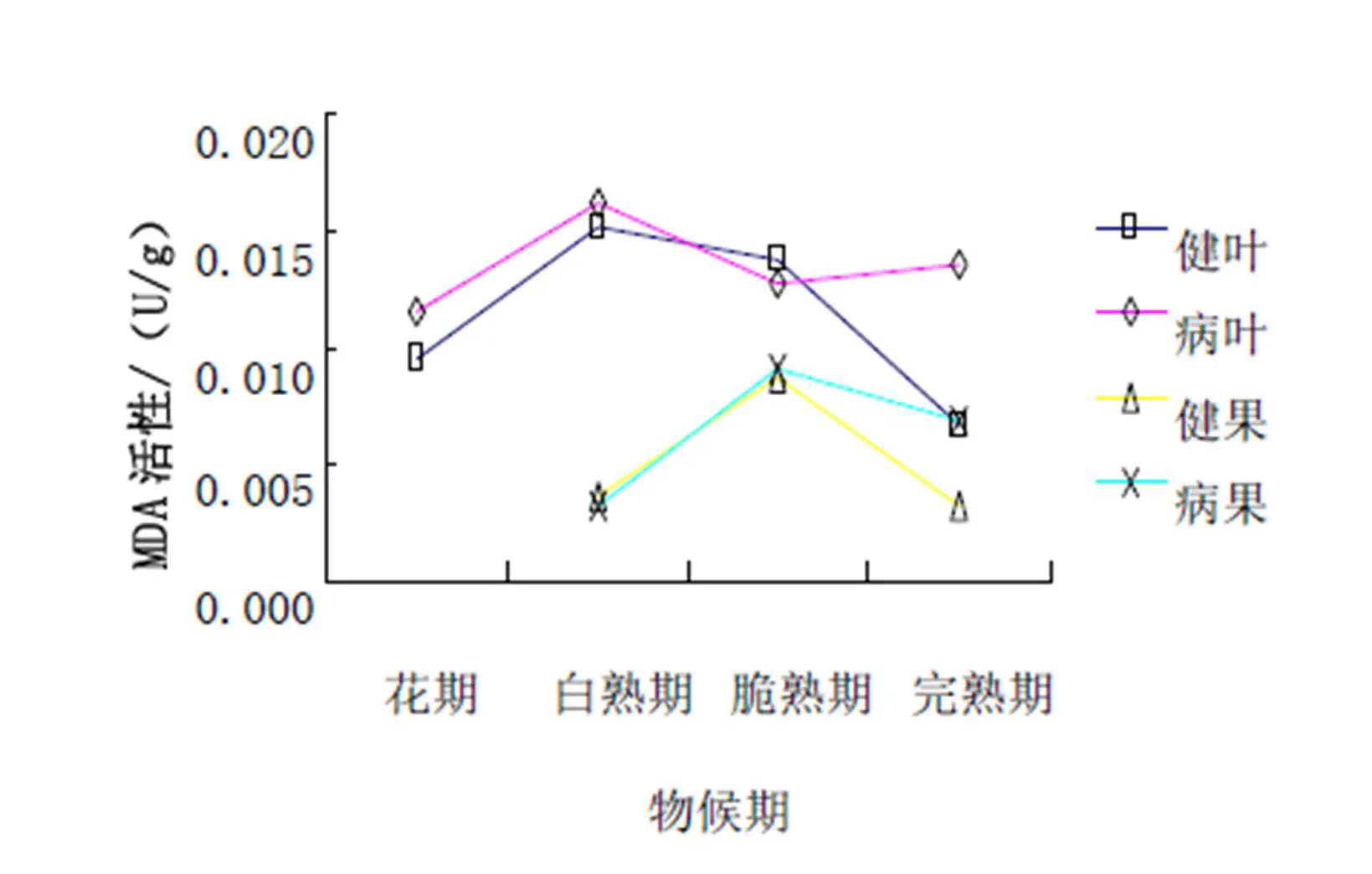
图1 新郑灰枣MDA活性

图2 濮阳扁核酸MDA活
从图3可以看出:在新郑灰枣枣叶中,PPO活性在健叶呈下降趋势,且最后趋近于0,而病叶在花期与脆熟期呈现高峰值,且每个时期均高于健叶;在新郑灰枣枣果中,PPO活性基本呈上升趋势,而在完熟期到达高峰,且病果在各个时期均大于健果。
从图4可以看出:在濮阳扁核酸枣叶中,PPO活性在病叶中是缓慢上升的趋势,健叶在花期、白熟期和完熟期的PPO的活性均低于病叶;在濮阳扁核酸枣果中,病果和健果的PPO活性均是上升趋势,到完熟期达到高峰,且病果一直高于健果。
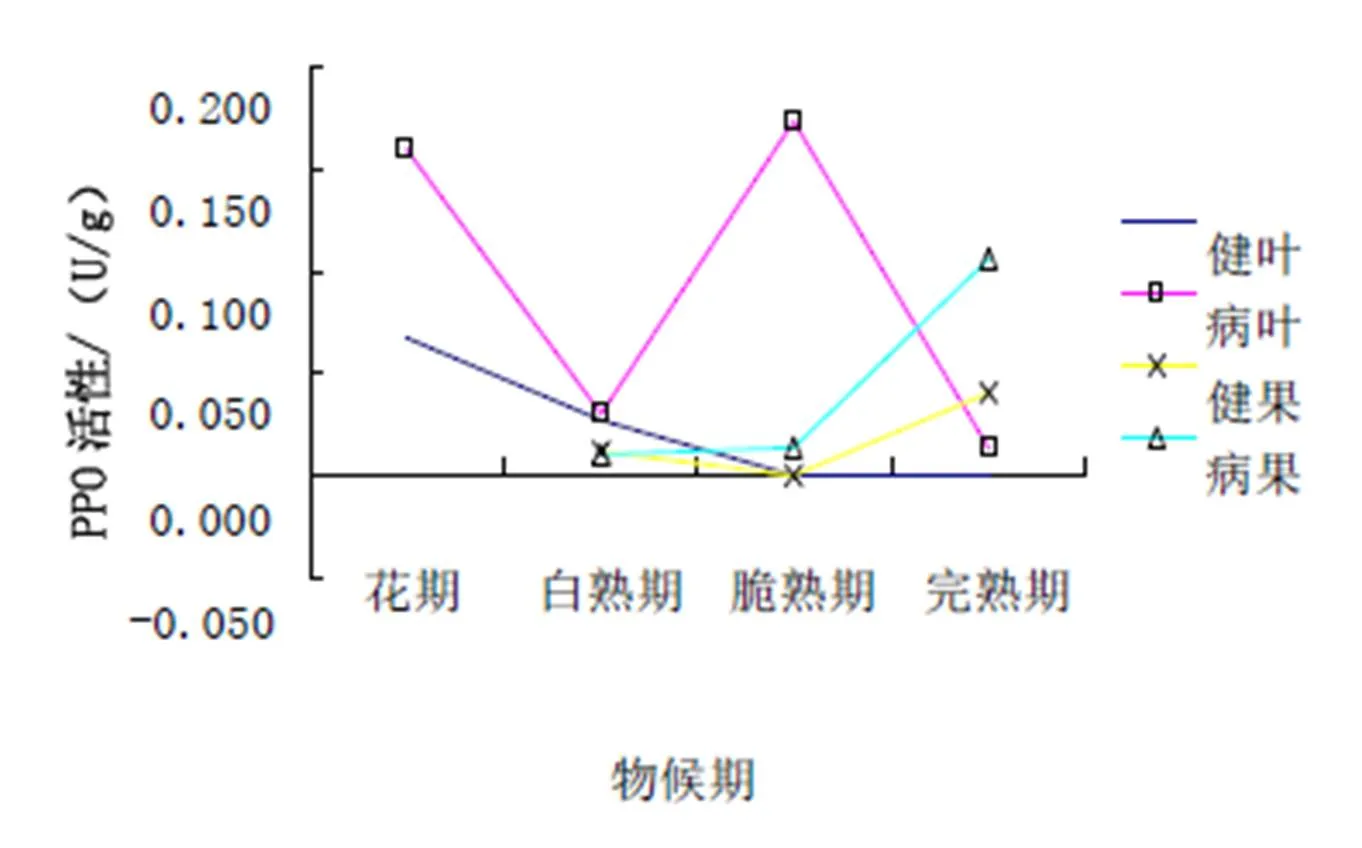
图3 新郑灰枣PPO活性

图4 濮阳扁核酸PPO活性
从图5可以看出:在新郑灰枣枣叶中,病叶和健叶的CAT活性在完熟期出现峰值,花期和脆熟期是低谷;在新郑灰枣枣果中,白熟期病果高于健果。
从图6可以看出:在濮阳扁核酸枣叶中,在脆熟期出现低谷,完熟期达到峰值,在花期健叶大于病叶;在濮阳扁核酸枣果中,白熟期病果高于健果。

图5 新郑灰枣CAT活性
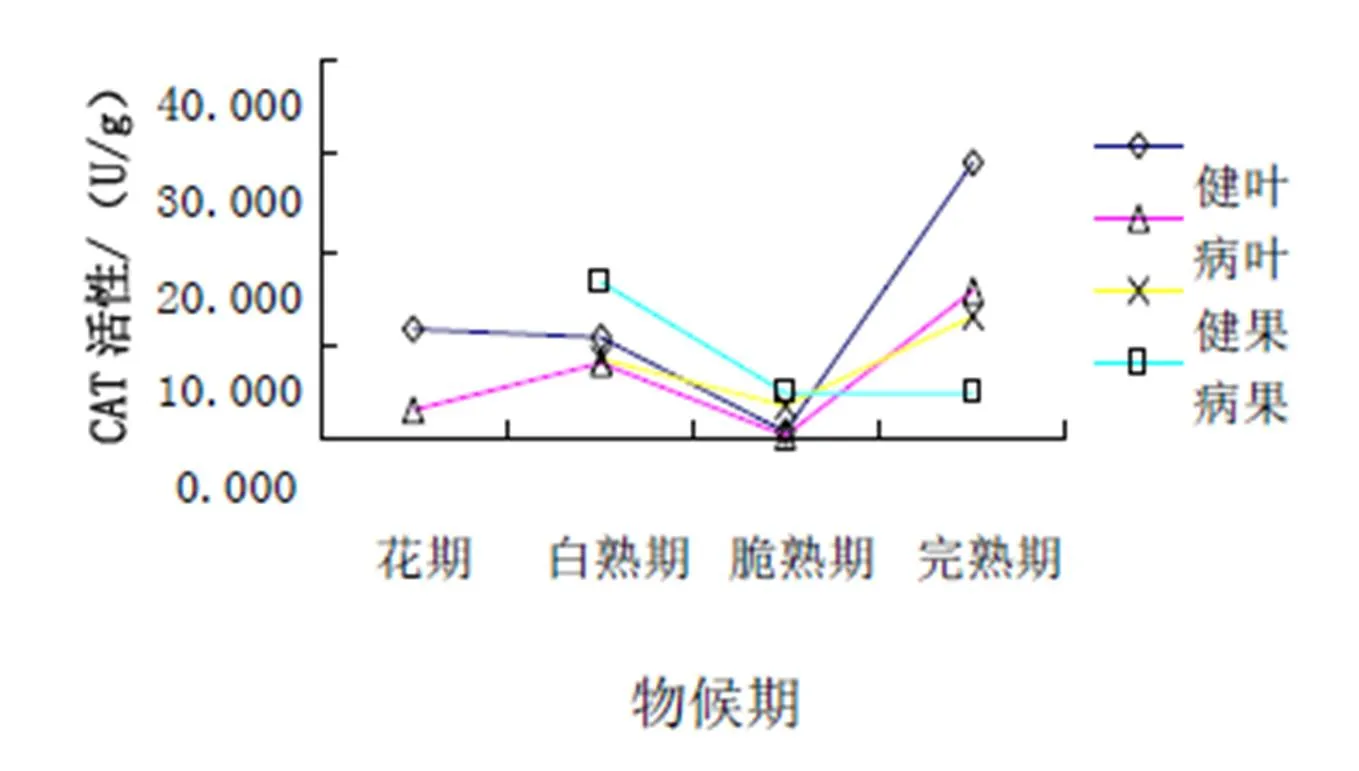
图6 濮阳扁核酸CAT活性
从图7可以看出:在新郑灰枣枣叶中,PAL活性总体呈先上升后下降的趋势,健叶在白熟期出现高峰,病叶则在脆熟期出现高峰,在花期和白熟期健叶高于病叶,在脆熟期和完熟期病叶高于健叶。在新郑灰枣枣果中,健果和病果的PAL活性均在脆熟期有小的高峰,且病果一直高于健果。
从图8可以看出:在濮阳扁核酸枣叶中,整体呈下降趋势,并且在花期健叶的PAL活性达到峰值。在濮阳扁核酸枣果中,病果的PAL活性一直高于健果。
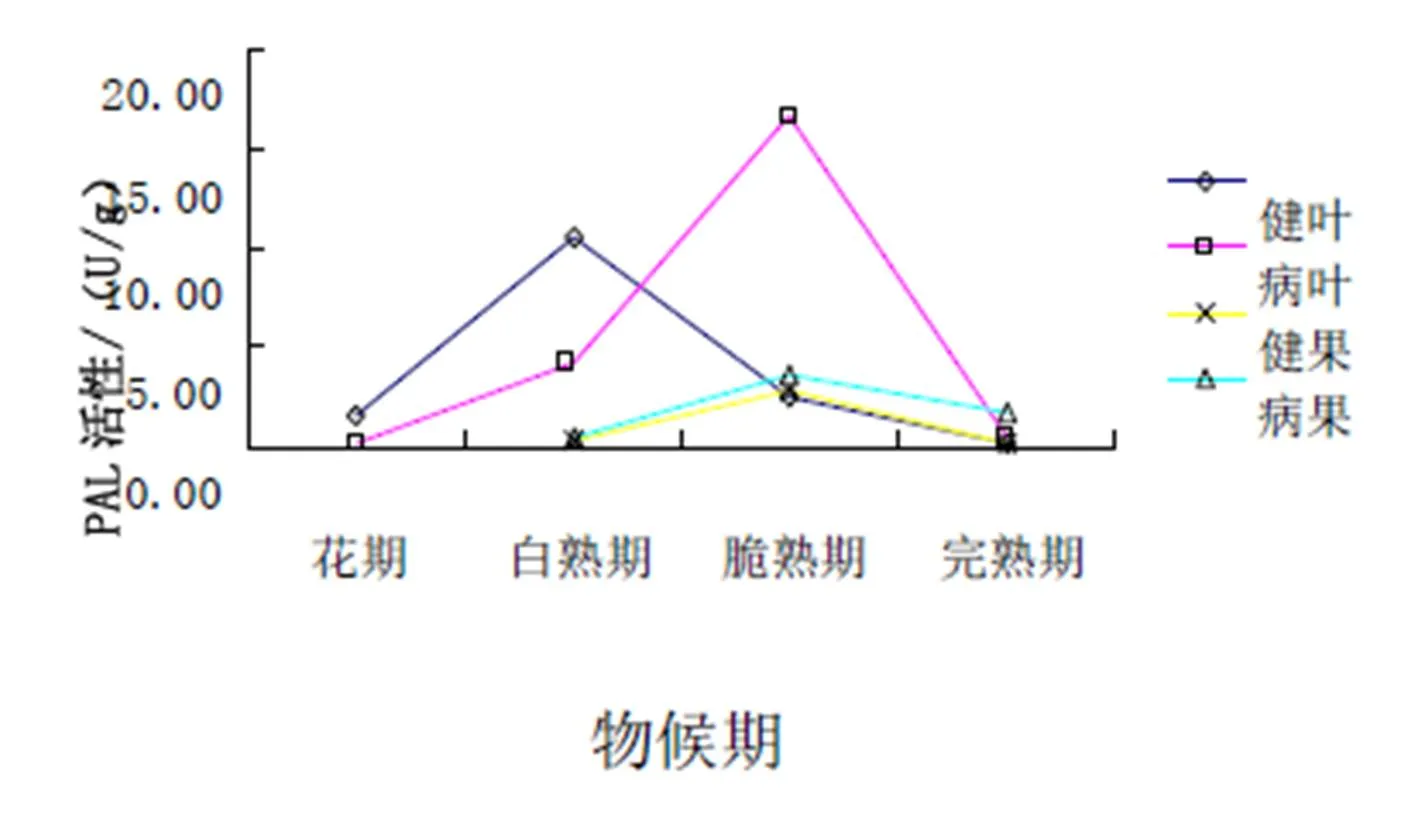
图7 新郑灰枣PAL活性
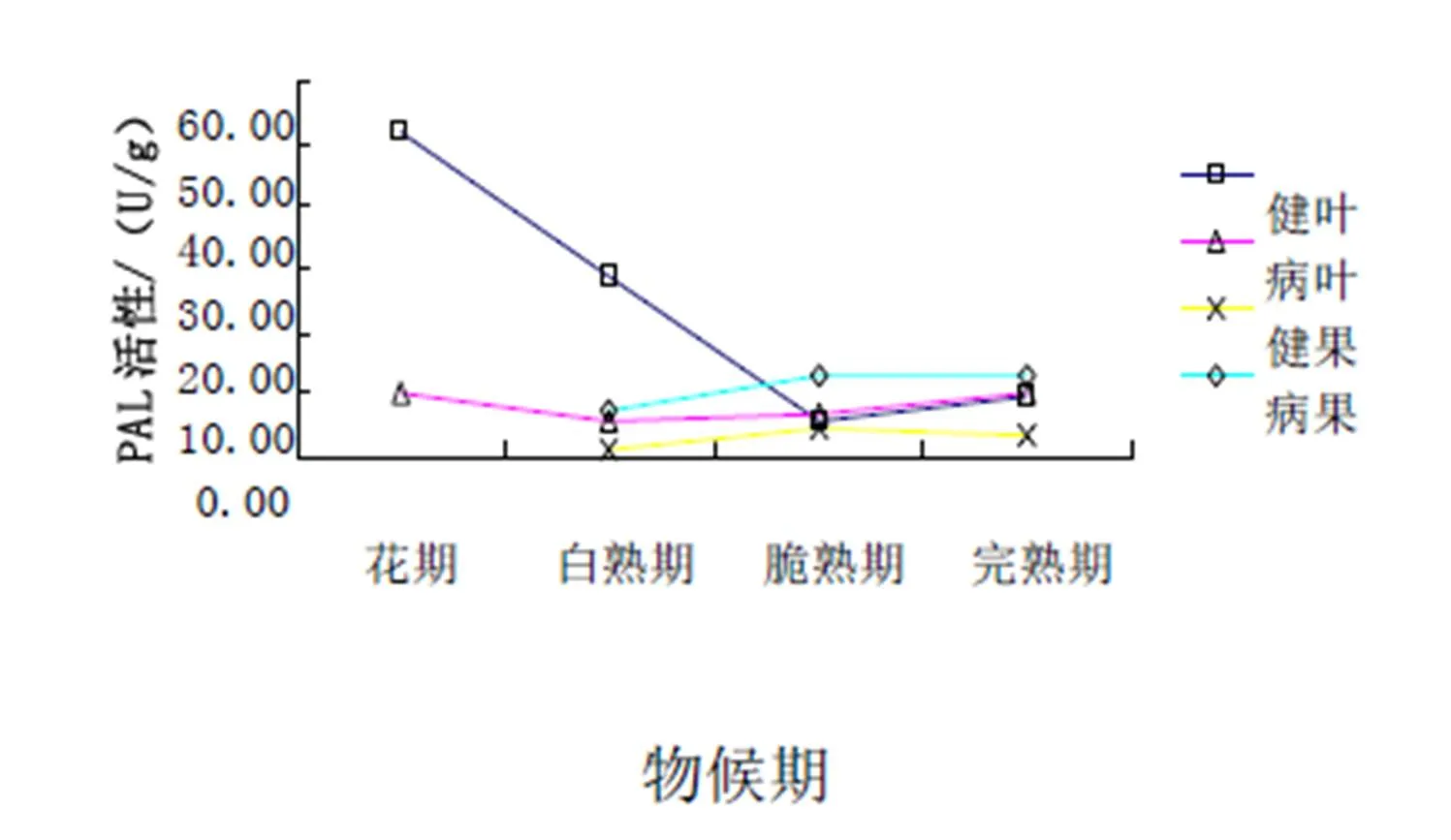
图8 濮阳扁核酸PAL活性
3 结论与讨论
MDA是自由基作用于脂质发生过氧化反应而产生的氧化终产物,MDA会引起蛋白质、核酸等生命大分子的交联聚合,且具有细胞毒性。MDA活性在完熟期时病果大于健果,原因可能是在枣果患病的过程中,机体的应激反应造成的脂质过度发生过氧化反应,使MDA升高,并且到完熟期表现出来,这也是积累效应导致的结果,当植物机体的还原性与氧化性打破平衡,最终氧化产物占优势时,也就表现出MDA活性在病果中高于健果。
PPO与抗病性的关系人们已进行了广泛的研究。植物在抵御病原微生物的侵染过程中,抗性相关酶发挥了重要作用,这主要包括了酚类代谢系统中的一些酶和病原相关蛋白家族PPO通过催化木质素及醌类化合物形成,构成保护性屏蔽而使细胞免受病菌的侵害,也可以通过形成醌类物质直接发挥抗病作用。在试验中,从花期开始就有病叶的PPO活性高于健叶,这说明在花期就已经有病原微生物侵染的枣树,并且整个果实成长期也是病果在任何时期PPO活性高于健果。PPO作为抗性酶在抵御病原微生物的侵染过程中发挥了重要作用。
CAT是一种酶类清除剂,又称为触酶,是以铁卟啉为辅基的结合酶。它可促使H2O2分解为分子氧和水,清除体内的过氧化氢,从而使细胞免于遭受H2O2的毒害,是生物防御体系的关键酶之一。CAT活性在白熟期病果大于健果,而在脆熟期和完熟期,健果大于病果,可能是枣果在脆熟期前后对病原产生一定的作用,灰枣叶中的表现和枣果表现一致。出现这一现象,则具体机制还需进一步研究。
PAL是植物次生物质代谢系统中比较关键的一个酶,是苯丙烷类代谢途径即酚类物质、植保素、黄酮和木质素等抗菌物质合成过程中的关键酶和限速酶,PAL活性的高低直接决定以后一系列次生物质合成步骤中生物活性的高低,所以PAL被认为对植物的抗病性是十分有利的。在试验中发现,病果中的PAL活性一直高于健果,且呈上升趋势,这也表明在果实成长期间一直有病原微生物侵染枣树,并且随着果实的生长过程有加大的趋势,这种现象可能是由于在果实生长期随着果实的生长,营养越来越多地供给到果实,而枣树的其他器官出现营养不良,树势衰弱导致的。随着病原微生物的侵染,PAL有逐渐增强的趋势,到脆熟期达到了最高值,随着果实的成熟,树体就不需在大量供给营养到果实上,树势就会慢慢增强,此时的PAL活性就会降低。由此可推断出:缩果病可能是由于树势衰弱而抵抗不了病原微生物的侵染而导致的,并且导致枣缩果病的这个病原微生物有可能是弱寄生菌。
[1]张朝红,刘孟军,孔得仓,等. 枣种质缩果病抗性多样性研究[J]. 植物遗传资源学报,2011(04):13-14.
[2]张欣. 与植物抗病性有关酶的研究进展[J]. 华南热带农业大学学报,2000(01):46.
[3] 张树生,胡蕾,刘忠良,等. 植物体内抗病相关酶与植物抗病性的关系[J]. 安徽农学通报,2006(13): 1 349-1 350.
2014-12-15
林业公益性科研专项“枣树重大病虫害防治及优质商品枣安全生产技术研究”(201104017)
马俊青(1979-),女,河南郑州人,工程师,主要从事森林病虫害、生态方面的研究。E-mail::27298191@qq.com
S 665.1
A
1003-2630(2014)04-0007-04
(责任编辑:王团荣)

